- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Ртуть
Содержание
- 2. Физические свойстваРтуть как простое вещество - это
- 3. В природеРтуть — относительно редкий элемент в
- 4. Истрория открытияРтуть (англ. Mercury, франц. Mercure, нем.
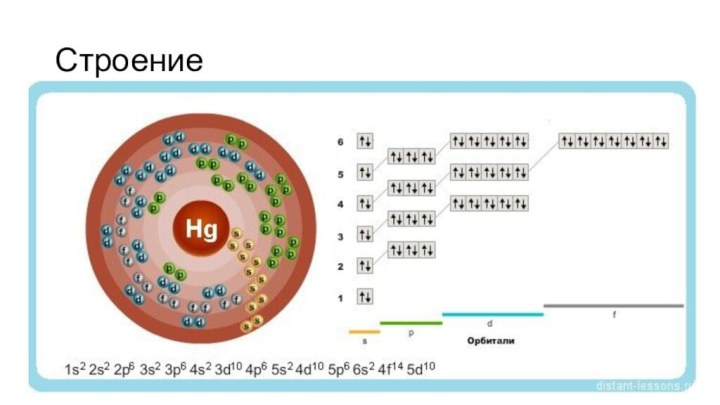
- 5. Строение
- 6. ПолучениеПромышленным способом ртуть получают обжигом руды HgS
- 7. Химические свойстваВзаимодействие с неметалламиВыше 300°С окисляется кислородом,
- 8. Химические свойстваВзаимодействие с кислотамиВ электрохимическом ряду напряжений
- 9. Химические свойстваВзаимодействие с солямиРтуть взаимодействует с солями
- 10. ПрименениеРтуть широко применяется при изготовлении научных приборов
- 11. Чем опасна ртуть?По классу опасности ртуть относится
- 12. ПрофилактикаВ быту основным источником возможных отравлений являются
- 14. Как избавиться от ртути в помещении:1. Для
- 15. Собрать ртуть можно с помощью:– кисточки из
- 16. Категорически нельзя:Сметать ртуть веником. Прутья разбивают шарик
- 17. Скачать презентацию
- 18. Похожие презентации
Физические свойстваРтуть как простое вещество - это переходный металл, который при комнатной температуре представляет собой тяжёлую серебристо-белую жидкость. Пары ртути очень ядовиты, отравление может привести к тяжелым заболеваниям, слабоумию и смерти. Плотность ртути – 13,5 г/см3,













Слайд 3
В природе
Ртуть — относительно редкий элемент в земной
коре со средней концентрацией 83 мг/т. Однако ввиду того,
что ртуть слабо связывается химически с наиболее распространёнными в земной коре элементами, ртутные руды могут быть очень концентрированными по сравнению с обычными породами. Наиболее богатые ртутью руды содержат до 2,5 % ртути. Основная форма нахождения ртути в природе — рассеянная, и только 0,02 % её заключено в месторождениях.Одно из крупнейших в мире ртутных месторождений находится в Испании (Альмаден). Известны месторождения ртути на Кавказе (Дагестан, Армения), в Таджикистане, Словении, Киргизии (Хайдаркан — Айдаркен), Донбассе (Горловка, Никитовский ртутный комбинат).
В России находятся 23 месторождения ртути, промышленные запасы составляют 15,6 тыс. тонн (на 2002 год), из них крупнейшие разведаны на Чукотке — Западно-Палянское и Тамватнейское.
Самородная ртуть
Слайд 4
Истрория открытия
Ртуть (англ. Mercury, франц. Mercure, нем. Quecksilber)
входит в число семи металлов древности. Она была известна
по крайней мере за 1500 лет до н.э., уже тогда ее умели получать из киновари. Ртуть употребляли в Египте, Индии, Месопотамии и Китае; она считалась важнейшим исходным веществом в операциях священного тайного искусства по изготовлению препаратов, продлевающих жизнь и именуемых пилюлями бессмертия. В IV - Ш вв. до н.э. о ртути как о жидком серебре ( от греч. вода и серебро) упоминают Аристотель и Теофраст. Позднее Диоскорид описал получение ртути из киновари путем нагревания последней с углем. Ртуть считали основой металлов, близкой к золоту и поэтому называли меркурием (Mercurius), по имени ближайшей к солнцу (золоту) планеты Меркурий. С другой стороны, полагая, что ртуть представляет собой некое состояние серебра, древние люди именовали ее жидким серебром (откуда произошло лат. Hydrargirum).Аристотель
История открытия
Слайд 6
Получение
Промышленным способом ртуть получают обжигом руды HgS (киноварь)
при высокой температуре (700°C):
HgS + O2 = Hg
+ SO2Металлотермия
HgS + Fe = Hg + FeS
Пары ртути конденсируют и собирают. Этот способ применяли ещё алхимики древности.
Минерал Киноварь
Слайд 7
Химические свойства
Взаимодействие с неметаллами
Выше 300°С окисляется кислородом, образуя
оксид ртути (II):
2Hg + O2 = 2HgO.
Очень легко взаимодействует
с серой с образованием сульфида ртути (II):Hg + S = HgS.
При нормальных условиях реагирует с галогенами:
Hg + Cl2 = HgCl2.
При нагревании – с фосфором, образуя фосфид:
3Hg + 2P = Hg3P2.
Оксид ртути (II)
Слайд 8
Химические свойства
Взаимодействие с кислотами
В электрохимическом ряду напряжений металлов
ртуть находится после водорода; с водой, щелочами и неокисляющими
кислотами не взаимодействует.Растворяется в разбавленной и концентрированной азотной кислоте и концентрированной серной кислоте, образуя соли ртути и продукты восстановления кислот:
Hg + 4HNO3 (конц.) = Hg(NO3)2 + 2NO2 + 2H2O,
6Hg + 8HNO3 (разб.) = 3Hg2(NO3)2 + 2NO + 4H2O,
Hg + 2H2SO4 = HgSO4 + SO2 + 2H2O;
при избытке ртути возможно образование сульфата ртути (I):
2Hg + 2H2SO4 = Hg2SO4 + SO2 + 2H2O.
Слайд 9
Химические свойства
Взаимодействие с солями
Ртуть взаимодействует с солями ртути
(II) с образованием солей ртути (I):
Hg + Hg(NO3)2 =
Hg2(NO3)2,Hg + HgCl2 = Hg2Cl2.
Другие металлы, из-за малой активности, вытеснять из растворов не может.
Слайд 10
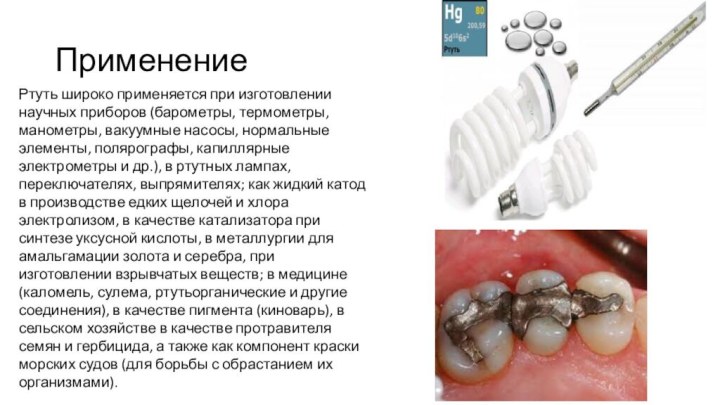
Применение
Ртуть широко применяется при изготовлении научных приборов (барометры,
термометры, манометры, вакуумные насосы, нормальные элементы, полярографы, капиллярные электрометры
и др.), в ртутных лампах, переключателях, выпрямителях; как жидкий катод в производстве едких щелочей и хлора электролизом, в качестве катализатора при синтезе уксусной кислоты, в металлургии для амальгамации золота и серебра, при изготовлении взрывчатых веществ; в медицине (каломель, сулема, ртутьорганические и другие соединения), в качестве пигмента (киноварь), в сельском хозяйстве в качестве протравителя семян и гербицида, а также как компонент краски морских судов (для борьбы с обрастанием их организмами).
Слайд 11
Чем опасна ртуть?
По классу опасности ртуть относится к
первому классу, то есть считается чрезвычайно опасным химическим веществом.
Проникновение ртути в организм чаще происходит при вдыхании её паров, не имеющих запаха.Острое отравление ртутью может привести к смерти. Также если при отравлениях не проводить лечение, то могут быть нарушены функции центральной нервной системы, снижена умственная активность, появляются судороги, истощение. Острые стадии отравления ртутью вызывают потерю зрения, полный паралич, облысение.
Особенно ртуть и её соединения опасны для беременных женщин, так как представляют угрозу для развития ребёнка.
Слайд 12
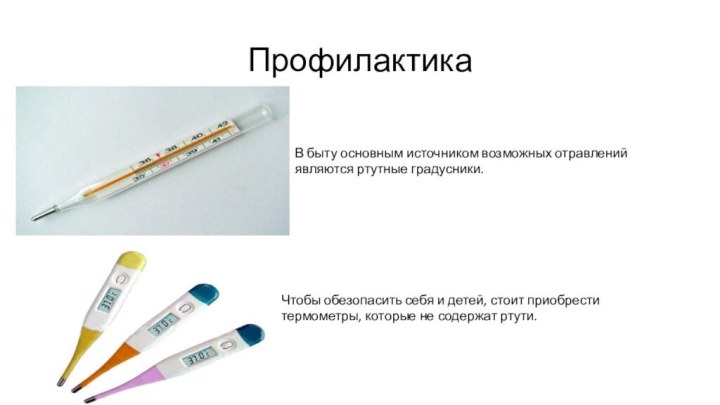
Профилактика
В быту основным источником возможных отравлений являются ртутные
градусники.
Чтобы обезопасить себя и детей, стоит приобрести термометры,
которые не содержат ртути.
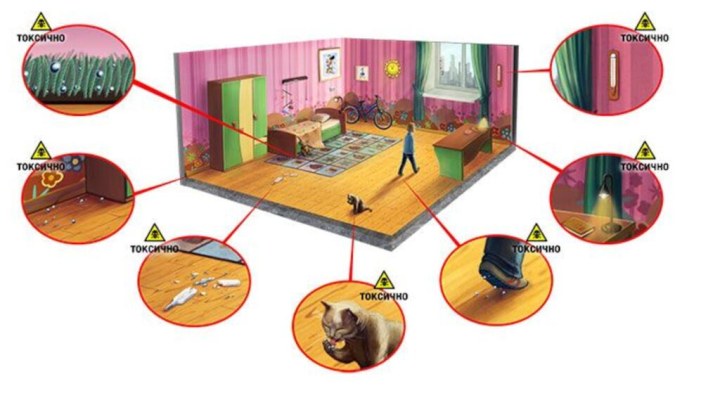
Слайд 14
Как избавиться от ртути в помещении:
1. Для начала
из комнаты нужно вывести детей и домашних животных
2. отрыть
окно, чтобы обеспечить приток свежего воздуха3. Перед уборкой ртути стоит максимально себя защитить — надеть респиратор или марлевую повязку, резиновые перчатки
4. Осколки градусника можно положить в плотный полиэтиленовый пакет и плотно его завязать. Саму ртуть лучше помещать в герметичную ёмкость, например, в банку с холодной водой
5. Во время сбора можно использовать бумажный конверт или бумажное полотенце. Перед тем как начать собирать ртуть, осветите пространство лампой — под лучами света шарики ртути будут заметны, так как начнут блестеть.
Слайд 15
Собрать ртуть можно с помощью:
– кисточки из амальгамирующихся
металлов; – кусочков проволоки, они помогут собрать ртуть в щелях; –
клейкой ленты — подойдёт для сбора маленьких шариков; – пипетки с тонким носиком.Выбрасывать ртуть в мусоропровод или канализацию нельзя!!!
Собрав ртуть, позвоните в местную службу МЧС, они обязаны принять её для утилизации.
Слайд 16
Категорически нельзя:
Сметать ртуть веником. Прутья разбивают шарик ртути
на более мелкие, и собирать их станет сложнее.
Собирать ртуть
пылесосом, так как при работе он нагревается и испарение ртути увеличивается. Кроме этого, ртуть осядет внутри пылесоса, и его придётся выкинуть.Стирать одежду, в которой вы убирали ртуть, так как это может привести к загрязнению вредным металлом стиральной машины. Все вещи, которые соприкасались с ртутью, нужно выбросить.