- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Готовимся к ЕГЭ. Молекулярная кристаллическая решетка
Содержание
- 2. Кристаллические решётки веществ -это упорядоченное расположение частиц
- 4. МОЛЕКУЛЯРНАЯ кристаллическая решетка Молекулярными называют кристаллические решётки,
- 5. Силы связи между молекулами в кристалле
- 6. Деление молекулВ узлах решетки находятся нейтральные молекулы,
- 7. Взаимодействия2) Индукционное взаимодействие – между полярной и
- 8. Дисперсионные силы – это физическое взаимодействие,
- 9. Неорганические соединения в обычных условиях
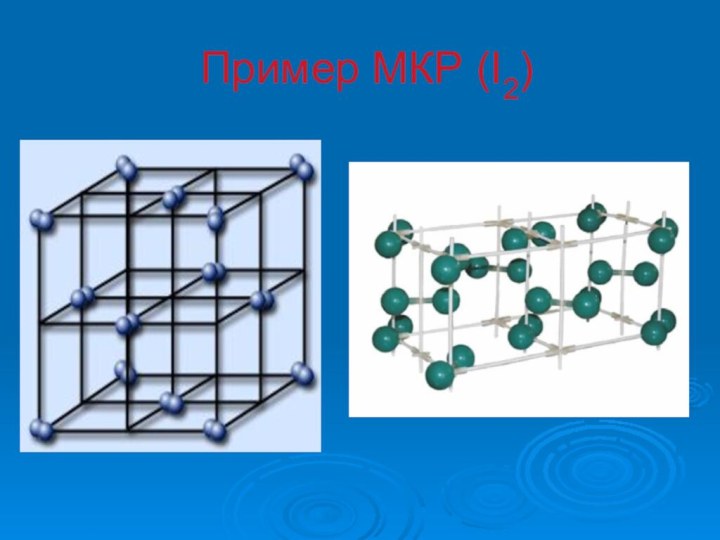
- 10. Пример МКР (I2)
- 11. Примеры веществМолекулярные решетки образуют, например, следующие вещества
- 12. Кристаллический иодСераУглекислый газ
- 13. Кристаллическая решетка воды
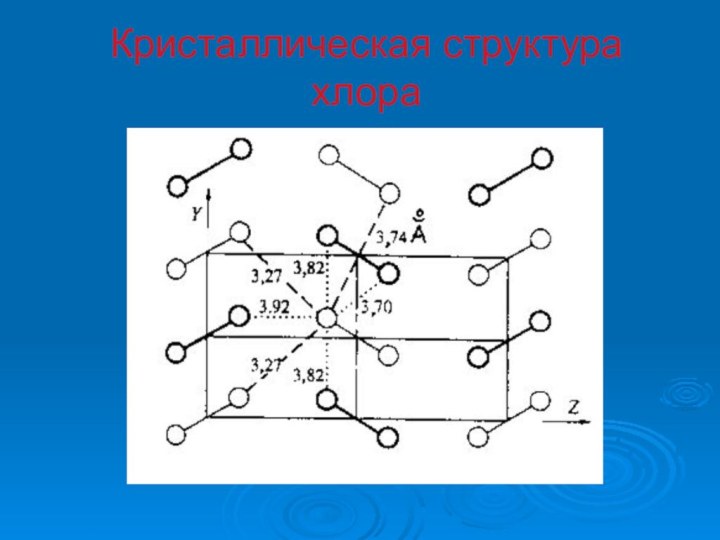
- 14. Кристаллическая структура хлора
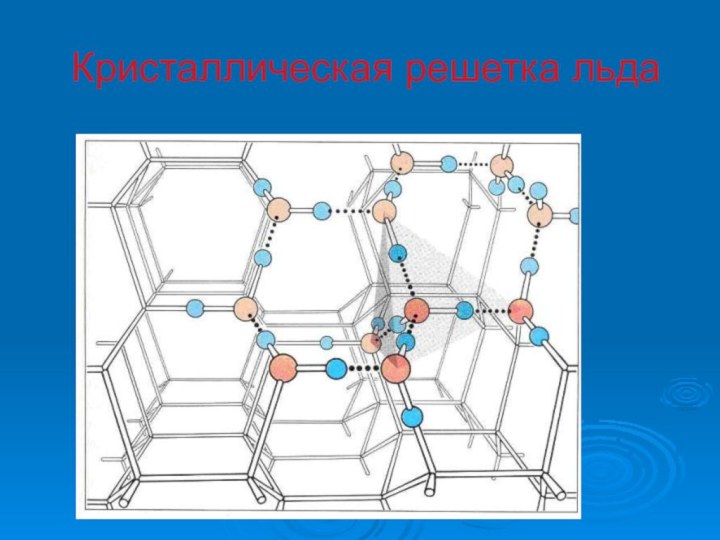
- 15. Кристаллическая решетка льда
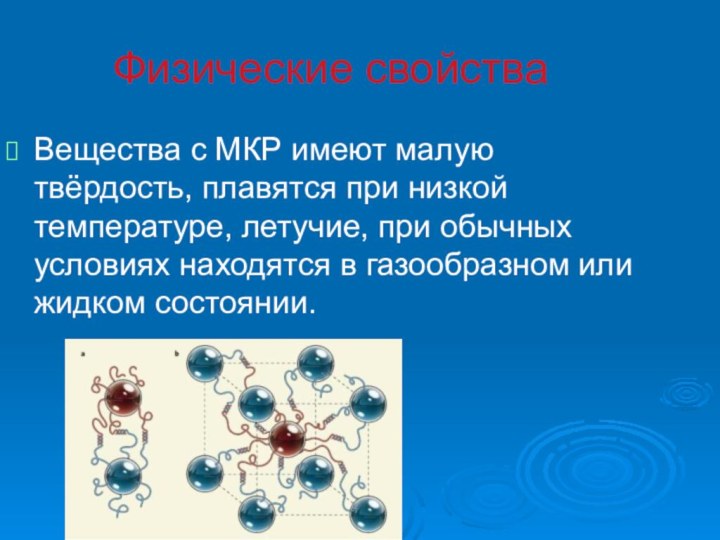
- 16. Физические свойстваВещества с МКР имеют малую твёрдость,
- 17. Скачать презентацию
- 18. Похожие презентации
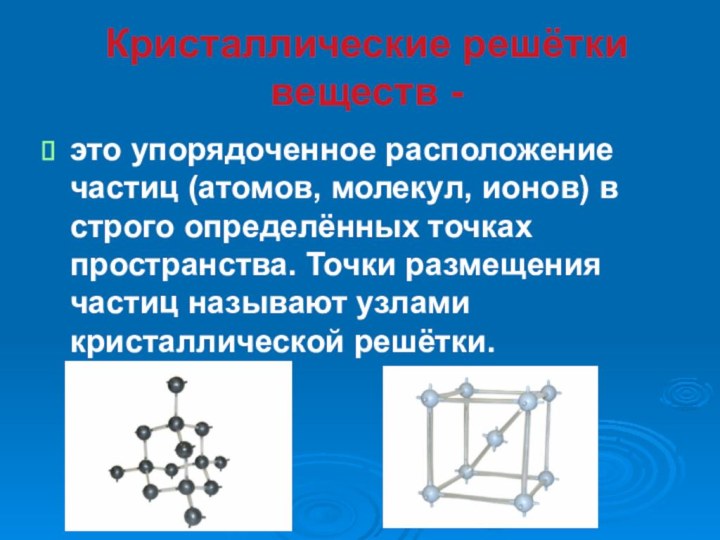
Кристаллические решётки веществ -это упорядоченное расположение частиц (атомов, молекул, ионов) в строго определённых точках пространства. Точки размещения частиц называют узлами кристаллической решётки.