- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему к уроку в 9 классе Серная кислота
Содержание
- 2. ПЛАН УРОКА.Состав и строение молекулы.Свойства серной кислоты.Получение
- 3. МОЛЕКУЛЯРНАЯ ФОРМУЛА H2SO4
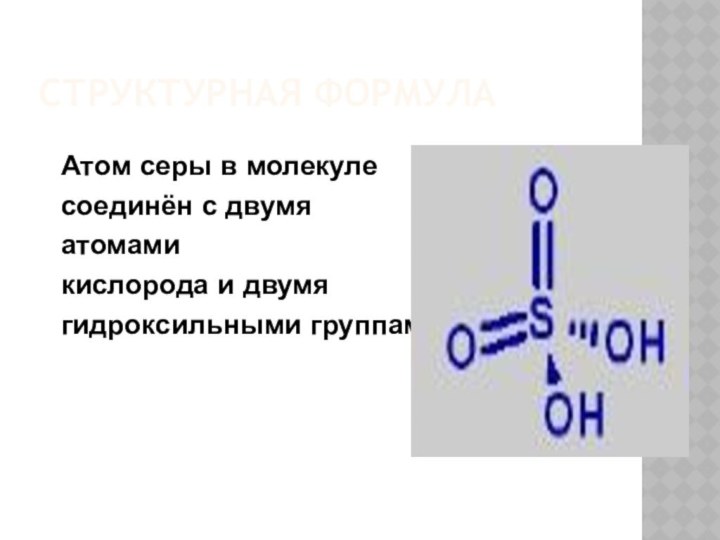
- 4. СТРУКТУРНАЯ ФОРМУЛААтом серы в молекулесоединён с двумя атомами кислорода и двумя гидроксильными группами
- 5. ФИЗИЧЕСКИЕ СВОЙСТВАТемпература плавления 10,38 °CТемпература кипения
- 6. ХИМИЧЕСКИЕ СВОЙСТВАСерная кислота — довольно сильный окислитель,
- 7. ХИМИЧЕСКИЕ СВОЙСТВАРазбавленная H2SO4взаимодействует со всеми металлами, находящимися
- 9. Реакция с Ме:
- 13. ПРОИЗВОДСТВО СЕРНОЙ КИСЛОТЫ КОНТАКТНЫМ СПОСОБОМ
- 14. РЕАКЦИИ В ОСНОВЕ ПОЛУЧЕНИЯ СЕРНОЙ КИСЛОТЫ4FeS2 +11O2 = 2Fe2O3+ 8SO2SO2+ O2 =SO3SO3+ H2O= H2SO4+ Q
- 15. РЕШИТЕ ЗАДАЧУВы главный технолог предприятия. Вам необходимо
- 16. ПРИМЕНЕНИЕ СЕРНОЙ КИСЛОТЫ Серную кислоту применяют:В
- 17. ПРОБЛЕМЫ ПРОИЗВОДСТВА СЕРНОЙ КИСЛОТЫСерная кислота и олеум
- 18. Скачать презентацию
- 19. Похожие презентации
ПЛАН УРОКА.Состав и строение молекулы.Свойства серной кислоты.Получение и практическое применение серной кислоты.Экологические проблемы связанные с производством серной кислоты.


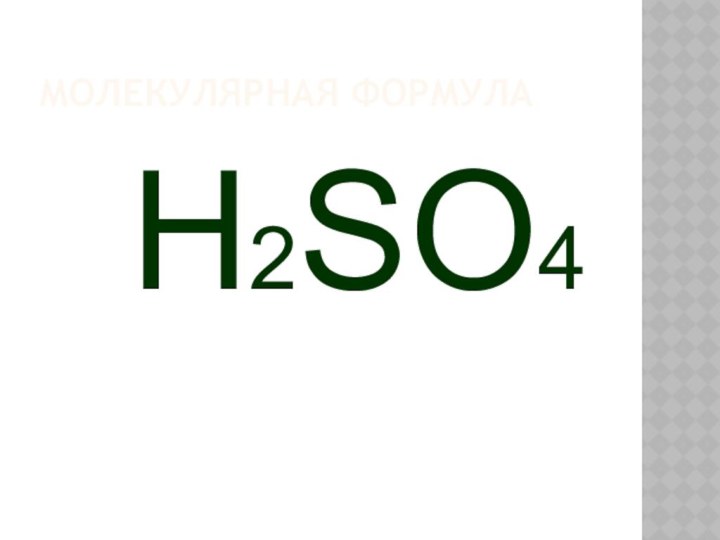














Слайд 2
ПЛАН УРОКА.
Состав и строение молекулы.
Свойства серной кислоты.
Получение и
практическое применение серной кислоты.
кислоты.
Слайд 4
СТРУКТУРНАЯ ФОРМУЛА
Атом серы в молекуле
соединён с двумя
атомами
кислорода и двумя
гидроксильными группами
Слайд 5
ФИЗИЧЕСКИЕ СВОЙСТВА
Температура плавления 10,38 °C
Температура кипения
279,6 °C
Плотность вещества 1,8356 г/см3
Растворимость смешивается
во всех соотношениях г/100 млСостояние (ст.усл) бесцветная маслянистая жидкость без запаха
Слайд 6
ХИМИЧЕСКИЕ СВОЙСТВА
Серная кислота — довольно сильный окислитель, особенно
при нагревании; окисляет HI и частично НВr до свободных
галогенов, углерод доCO2, S — до SO2, окисляет многие металлы (Cu, Hg и др.). При этом серная кислота восстанавливается до SO2, а наиболее сильными восстановителями — до S иH2S.
Слайд 7
ХИМИЧЕСКИЕ СВОЙСТВА
Разбавленная H2SO4взаимодействует со всеми металлами, находящимися в
электрохимическом ряду напряжений левее водорода, с выделениемH2. Окислительные свойства
для разбавленной H2SO4нехарактерны.
Слайд 14
РЕАКЦИИ В ОСНОВЕ ПОЛУЧЕНИЯ СЕРНОЙ КИСЛОТЫ
4FeS2 +11O2 =
2Fe2O3+ 8SO2
SO2+ O2 =SO3
SO3+ H2O=
H2SO4+ Q
Слайд 15
РЕШИТЕ ЗАДАЧУ
Вы главный технолог предприятия. Вам необходимо заложить
количество исходного материала в смету. Сколько вам потребуется закупить
пиррита, если вам поступил заказ на 300 л серной кислоты. Не забудьте учесть, что исходный материал содержит примеси в размере 10%, а выход производственные потери при получении кислоты составляют 5%.
Слайд 16
ПРИМЕНЕНИЕ СЕРНОЙ КИСЛОТЫ
Серную кислоту применяют:
В производстве
минеральных удобрений;
Как электролит в свинцовых аккумуляторах;
Для получения различных минеральных
кислот и солей,В производстве химических волокон, красителей, дымообразующих веществ и взрывчатых веществ,
В нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности.
В пищевой промышленности зарегистрирована в качестве пищевой добавки E513(эмульгатор).
В промышленном органическом синтезе
Слайд 17
ПРОБЛЕМЫ ПРОИЗВОДСТВА СЕРНОЙ КИСЛОТЫ
Серная кислота и олеум —
чрезвычайно агрессивные вещества, поражают дыхательные пути, кожу, слизистые оболочки,
вызывают затруднение дыхания, кашель, нередко — ларингит, трахеит, бронхит и т. д. Поражающая концентрация паров серной кислоты 0,008 мг/л (экспозиция 60 мин), смертельная 0,18 мг/л (60 мин).Класс опасности 2. Аэрозоль серной кислоты может образовываться в атмосфере в результате выбросов химических и металлургических производств, содержащих оксиды S, и выпадать в виде кислотных дождей.