Слайд 2
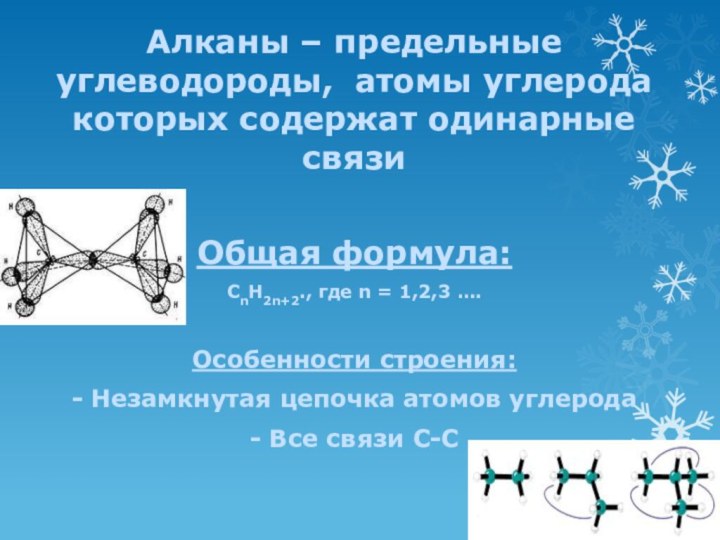
Алканы – предельные углеводороды, атомы углерода которых содержат
одинарные связи
Общая формула:
CnH2n+2., где n = 1,2,3
….
Особенности строения:
- Незамкнутая цепочка атомов углерода
- Все связи С-С
Слайд 3
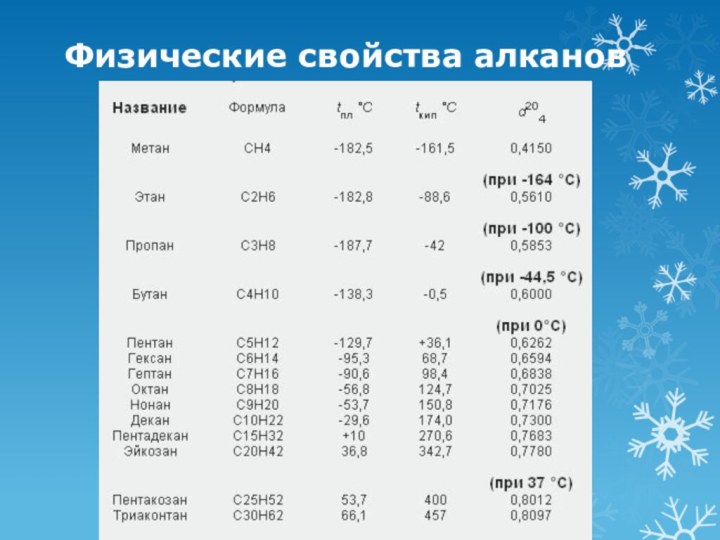
Физические свойства алканов
При обычных условиях
С1 – С4 –
газы,
С5 – С17 – жидкости,
С18 – С……
- твердые вещества.
С увеличением относительной молекулярной массы увеличивается температура кипения, плавления и плотность. Температура плавления и кипения понижается от менее разветвленных к более разветвленным. Газообразные алканы горят бесцветным или бледно-голубым пламенем с выделением большого количества тепла
Слайд 4
Физические свойства алканов
Слайд 5
Радикалы
Гомологический ряд алканов
Слайд 6
Структурные формулы первых 10 членов
Метан CH4
Этан CH3—CH3
Пропан CH3—CH2—CH3
Бутан CH3—CH2—CH2—CH3
Пентан CH3—CH2—CH2—CH2—CH3
Гексан CH3—CH2—CH2—CH2—CH2—CH3
Гептан CH3—CH2—CH2—CH2—CH2—CH2—CH3
Октан CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH3
Нонан CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3
Декан CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3
Слайд 7
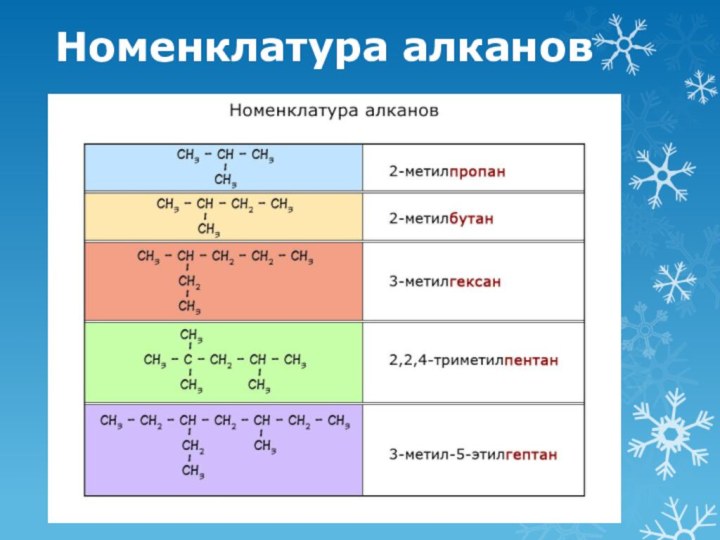
Номенклатура алканов
выбрать самую длинную углеродную цепь
Пронумеровать углероды с
того конца, где ближе расположен радикал
(радикал - одновалентная
частица, полученная при отщеплении атома водорода от молекулы алкана, название радикала образуется от названия соответствующего алкана с заменой суффикса – ан на суффикс – ил)
3. назвать радикал указав место расположения радикала
(если группы повторяются, то перечисляют цифры, указывающие их положение, а число одинаковых групп указывают приставками ди-, три-, тетра-. Если группы неодинаковые, то их названия перечисляются в алфавитном порядке)
4. назвать длинную углеродную цепь
Слайд 9
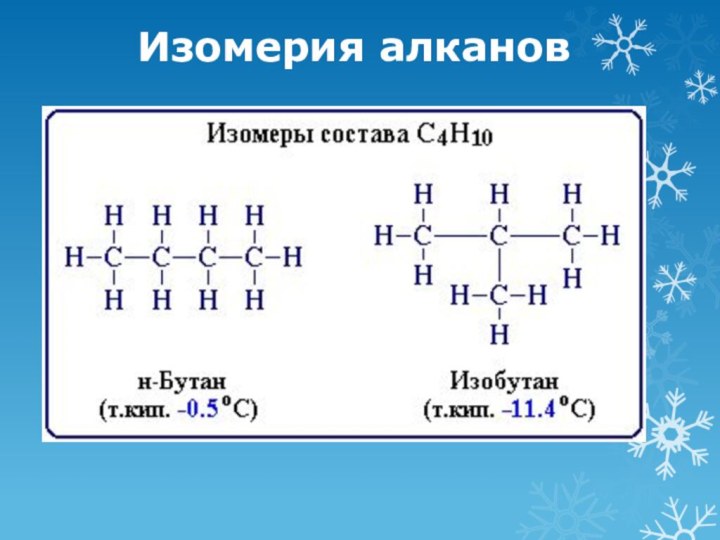
Изомерия алканов
Структурная изомерия углеродного скелета - атомы
углерода алкана образовывают цепи различного строения.
Первые три члена
гомологического ряда алканов
изомеров не имеют.
Слайд 11
Изомерия алканов
Поворотная изомерия алканов
Вращение атомов вокруг
s-связи не будет приводить к ее разрыву. В результате
внутримолекулярного вращения по s-связям С–С молекулы алканов, начиная с этана С2Н6, могут принимать разные геометрические формы.
Различные пространственные формы молекулы, переходящие друг в друга путем вращения вокруг s-связей С–С, называют конформациями или поворотными изомерами (конформерами).
Поворотные изомеры молекулы представляют собой энергетически неравноценные ее состояния. Их взаимопревращение происходит быстро и постоянно в результате теплового движения. Поэтому поворотные изомеры не удается выделить в индивидуальном виде, но их существование доказано физическими методами. Некоторые конформации более устойчивы (энергетически выгодны) и молекула пребывает в таких состояниях более длительное время.
Слайд 12
Получение алканов. Природный газ
Важнейшим источником алканов в природе
является природный газ, минеральное углеводородное сырье - нефть и
сопутствующие ей нефтяные газы. Природный газ на 95 % состоит из метана. Такой же состав имеет болотный газ, образующийся в результате переработки бактериями (гниения) углеводов. Попутные нефтяные газы состоят в основном из этана, пропана, бутана и частично пентана. Их отделяют от нефти на специальных установках по подготовке нефти. Одновременно с газами нефть очищается от воды, грязи и песка.
Из нефти при ее разгонке (перегонке, дистилляции) отбирая последовательно все более и более высококипящие фракции получают: бензины - т. кип. от 40 до 180 С, керосин 180-230 C, (С11-С12); легкий газойль (дизельное топливо) 230-305 С (С13-С17); тяжелый газойль и легкий дистиллят смазочного масла 305-405 С (С18-С25); смазочные масла 405-515 С (С26-С38). Остаток после перегонки нефти называется асфальтом или битумом.
Слайд 13
Способы получения алканов
Гидрирование угля под давлением, гидрирование CO
и CO2 в присутствии катализаторов (Fe, Co, Ni) при
повышенной температуре
400°С,p
C + H2 → CnH2n+2
200°С,Ni
CO + H2 → CnH2n+2+ H2O
kat
R–CH=CH–R' + H2 → R–CH2–CH2–R'
2. Реакция Вюрца, взаимодействие натрия на с галогенопроизводнымие углеводородов
2CH3–CH2Br+ 2Na → CH3–CH2–CH2–CH3+ 2NaBr
3. Термическое декарбоксилирование солей карбоновых кислот в присутствии щелочей:
R-COONa + NaOH → R-H + Na2CO3
4. Электролиз солей карбоновых кислот (реакция Кольбе):
2R-COO- -2е → R-R + 2 CO2
Слайд 14
Химические свойства
Алканы химически малоактивны. Низкая реакционная способность алканов
обусловлена очень малой полярностью связей С-С и С-Н в
их молекулах вследствие почти одинаковой электроотрицательности атомов углерода и водорода. Предельные углеводороды в обычных условиях не взаимодействуют ни с концентрированными кислотами, ни со щелочами, ни даже с таким активным реагентом как перманганат калия.
Для них свойственны реакции замещения водородных атомов и расщепления.
В этих реакциях происходит гомолитическое расщепление кoвалентных связей, т. е. они осуществляются по свободно-радикальному (цепному) механизму.
Реакции вследствие прочности связей C–C и C–H протекают или при нагревании, или на свету, или с применением катализаторов.
Слайд 15
Химические свойства
Галогенирование:
CH4 + Cl2 →CH3Cl + HCl
CH3Cl +
Cl2 → CH2Cl2 + HCl
CH2Cl2+ Cl2 → CHCl3 +
HCl
CHCl3 + Cl2 →CCl4 + HCl
2. Реакция М.И. Коновалова - замещение атома водорода нитрогруппой при температуре до 140°С с разбавленной (10%-ной) азотной кислотой под давлением:
NO2
t °, p │
CH3–CH–CH3 +…HNO3 → CH3–C–CH3 + H2O
| |
CH3 CH3
Слайд 16
Химические свойства
3. Крекинг. При высокой температуре в присутствии
катализаторов предельные углеводороды подвергаются расщеплению, которое называется крекингом. При
крекинге происходит гомолитический разрыв углерод-углеродных связей с образованием насыщенных и ненасыщенных углеводородов с более короткими цепями.
400°C
CH3–CH2–CH2–CH3(бутан) → CH3–CH3(этан) + CH2=CH2(этилен)
1500°C
2CH4 → H–C=C–H(ацетилен) + 3H2
4. Изомеризация – при наличии катализаторов и нагревании углеводороды нормального строения подвергаются перестройке углеродного скелета с образованием алканов разветвленного строения.
5. Окисление. При поджигании на воздухе алканы горят, превращаясь в CO2 и воду и выделяя большое количество тепла:
CH4 + 2O2 → CO2 + 2H2O
C5H12 + 8O2 → 5CO2 + 6H2O
Слайд 17
Применение:
Метан –основной компонент природных и попутных газов, широко
используется в качестве промышленного и бытового газа. Перерабатывается в
промышленности в ацетилен, газовую сажу, фторо- и хлоропроизводные.
Низшие члены гомологического ряда используются для получения соответствующих непредельных соединений реакцией дегидрирования. Смесь пропана и бутана используется в качестве бытового топлива. Средние члены гомологического ряда применяются как растворители и моторные топлива.
Большое промышленное значение имеет окисление высших предельных углеводородов — парафинов с числом углеродных атомов 20-25. Этим путем получают синтетические жирные кислоты с различной длиной цепи, которые используются для производства мыл, различных моющих средств, смазочных материалов, лаков и эмалей.
Жидкие углеводороды используются как горючее (они входят в состав бензина и керосина).
Алканы широко используются в органическом синтезе.