- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Все о железе и его соединения
Содержание
- 2. Железо и его соединенияУрок-проект в 9 классеподготовила
- 3. План изучения веществаЖелезо как химический элемент.Нахождение в
- 4. Визитная карточка железаПорядковый номерПериодГруппаПодгруппаAr264VIIIПобочная56
- 5. Строение атома железа2е; 8е; 14е;
- 6. Степени окисленияДля железа характерны две
- 7. Распространенность в природе4-е место среди
- 8. Железо – простое вещество
- 9. Нахождение в природеFe3O4 – магнитный
- 10. Способы полученияДомны.Кислородный конвертер.
- 11. Биологическая роль железа В организме
- 12. Биологическая роль железаСуточная норма потребности
- 13. Химические свойства 1. Железо
- 14. Генетические ряды железаFe
- 16. Применение железа и его соединений
- 17. Качественные реакции на ионы
- 18. Качественные реакции на ионы
- 19. «Определение содержания Fe3+ в воде,
- 21. Железо не только основа всего мира, самый
- 22. Скачать презентацию
- 23. Похожие презентации
Железо и его соединенияУрок-проект в 9 классеподготовила Яскевич В.А. учитель химии МОУ «Кадетская школа «Патриот» г.Энгельса2010 г.





















Слайд 3
План изучения вещества
Железо как химический элемент.
Нахождение в природе.
Получение.
Физические свойства железа.
Химические свойства железа.
Соединения железа.
Применение железа.
Качественные реакции на
ионы железа и их применение.
Слайд 5
Строение атома железа
2е; 8е; 14е; 2е.
1s2
2s2 2р6 3s2 3р6 3d6 4s2
26 p; 26е
; 30nЗапомни!
Особенностью электронного строения элементов побочных подгрупп является заполнение электронами не последнего, а предпоследнего энергетического уровня.
Слайд 6
Степени окисления
Для железа характерны две основные
степени окисления: +2, +3.
Fe0 –2e = Fe+2
Fe0 –3e = Fe+3
Железо - восстановитель
Слайд 7
Распространенность в природе
4-е место среди элементов
после O, Si, Al.
2-е место по количеству в литосфере
среди металлов. Россия занимает 1-е место по запасам железных руд.
Слайд 8
Железо – простое вещество
Физические свойства железа
Цвет
Блеск
Пластичность
Магнитные свойства
Температура плавления
Твердость
Серебристо-белый
Блестящий
Очень пластичный, легко куется, прокатывается,
штампуетсяНамагничивается и размагничивается
1539 C
Твердый
Теплопроводный
Электропроводный
Слайд 9
Нахождение в природе
Fe3O4 – магнитный железняк
(72%)
Fe2O3 – красный железняк (гематит) (65%)
2Fe2O3 * 3H2O
– бурый железняк(60%)
FeS2 – железный колчедан
(47%)
Слайд 10
Способы получения
Домны.
Кислородный конвертер.
Генри Бессемер
Электродуговые печи.
Пьер Мартен
Слайд 11
Биологическая роль железа
В организме
человека содержится около 5 г железа.
Из них 57%
приходится на гемоглобин крови,7% – на миоглобин мышц,
16% связаны с тканевыми ферментами,
20% – это запас, отложенный в печени, селезёнке, костном
мозге и почках.
Слайд 12
Биологическая роль железа
Суточная норма потребности человека
составляет около 15 мг железа.
Много железа в сливовом
соке, кураге, изюме, орехах, тыквенных и подсолнечных семечкахВ 10 г проросшей пшеницы содержится 1 мг железа. Черный хлеб, отруби, хлеб грубого помола также богаты железом.
Следует учесть, что организмом усваивается всего лишь 10% от всего железа, получаемого с пищей.
Слайд 13
Химические свойства
1. Железо реагирует
с неметаллами:
2 Fe+3Cl2 = 2FeCl3 Fe+S = FeS
3 Fe+ 2O2 = Fe3O4
2. Железо реагирует с кислотами.
Fe+H2SO4=FeSO4+H2
Fe + 2HCl = FeCl2 + H2
В концентрированных азотной и серной кислотах железо не растворяется
3. Реагирует с растворами солей металла
согласно электрохимическому ряду напряжений металлов. Fe + CuSO4 = Fe SO4 + Cu
4. С водой: 3Fe + 4H2O = Fe3O4 + 4H2 (900 0C)
5. Во влажном воздухе ржавеет:
4Fe +6H2O + 3O2 = 4Fe(OH)3
Слайд 16
Применение железа и его соединений
Железный
купорос, хлорное железо, оксиды железа используют для приготовления лекарств,
катализаторов, магнитных материалов, составов, защищающих древесину от гниения, при крашении тканей, для борьбы с вредителямиТермит используется для сварки стальных изделий, например, железнодорожных рельсов встык).
Железный сурик Fe2O3 , охра – применяется как пигмент для приготовления красок.
Слайд 17
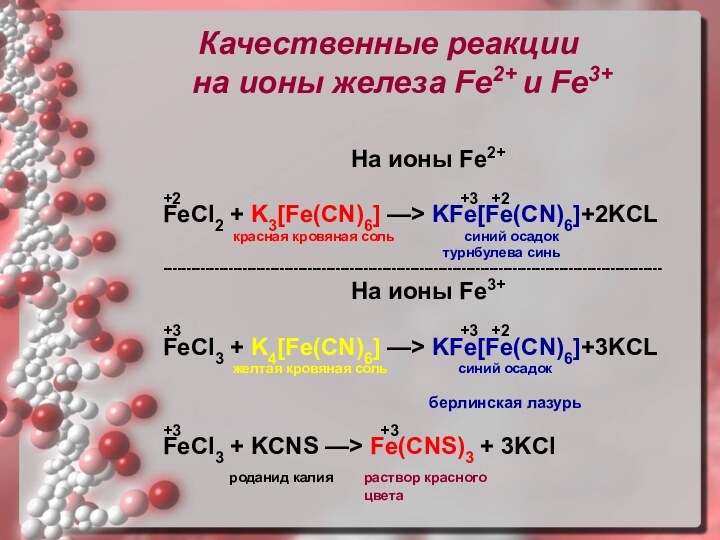
Качественные реакции
на ионы железа Fe2+
и Fe3+
На ионы Fe2+
+2
+3 +2FeCl2 + K3[Fe(CN)6] —> KFe[Fe(CN)6]+2KCL
красная кровяная соль синий осадок
турнбулева синь
-----------------------------------------------------------------------------------------------------------
На ионы Fe3+
+3 +3 +2
FeCl3 + K4[Fe(CN)6] —> KFe[Fe(CN)6]+3KCL
желтая кровяная соль синий осадок
берлинская лазурь
+3 +3
FeCl3 + KCNS —> Fe(CNS)3 + 3KCl
роданид калия раствор красного
цвета
Слайд 18
Качественные реакции
на ионы железа Fe2+
и Fe3+
Качественная реакция на ионы железа Fe2+:
реактив – гидроксид натрия,результат - осадок зеленого цвета
FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4
зеленый осадок
Качественная реакция на ионы железаFe3+:
реактив – гидроксид натрия,
результат - осадок бурого цвета
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
бурый осадок
Слайд 19
«Определение содержания Fe3+ в воде,
взятой из различных источников»
Материалы: проб воды, взятые в разных
местах, речная вода, водопроводная вода, вода из ржавого водопровода.Реактив: отвар коры дуба (танин).
Результат: темно-синее окрашивание.
Слайд 20
Вывод
Железо – жизненно необходимый элемент для всех
живых организмовЖелезо – металл без которого невозможен научно-технический прогресс
Слайд 21 Железо не только основа всего мира, самый главный
металл окружающей нас природы, оно – основа культуры и
промышленности, оно – орудие войны и мирного труда. И трудно во всей таблице Менделеева найти другой элемент, который был бы так связан с прошлым, настоящим и будущими судьбами человечества.А. Е. Ферсман





























