- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Фосфор (9 класс)
Содержание
- 2. ФосфорТо я камень философский, То огонь холодный
- 3. Хеннинг Бранд,1669 г Роберт БойльФосфор, в переводе с греческого «phosphoros» означает «светоносец»
- 4. Михаил Васильевич ЛомоносовФосфор
- 5. Нахождение в природеСодержание в земной коре –
- 6. Содержание фосфора в организме человекаВ тканях мозга
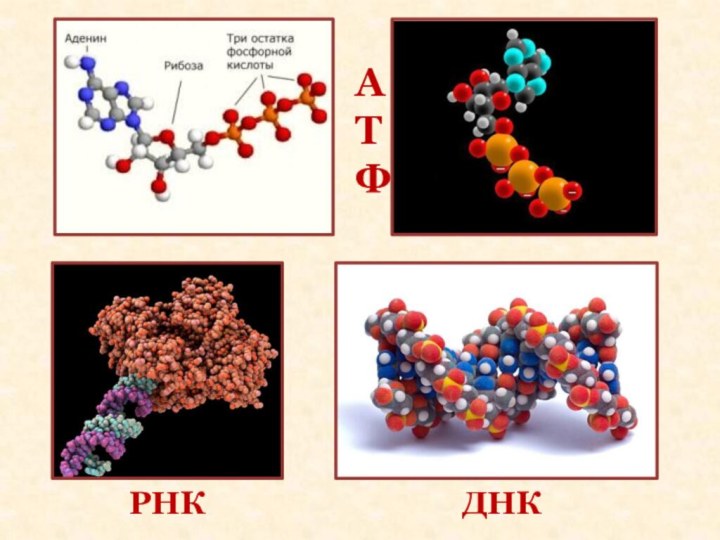
- 7. АТФДНКРНК
- 8. Знаете ли вы, что... В теле
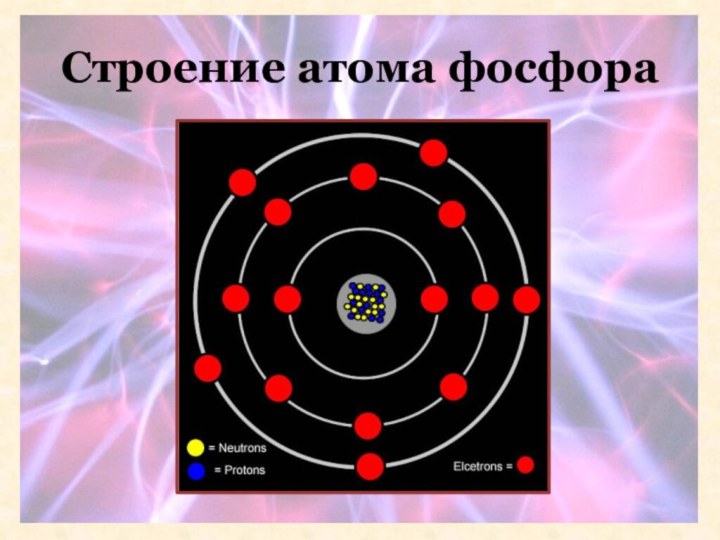
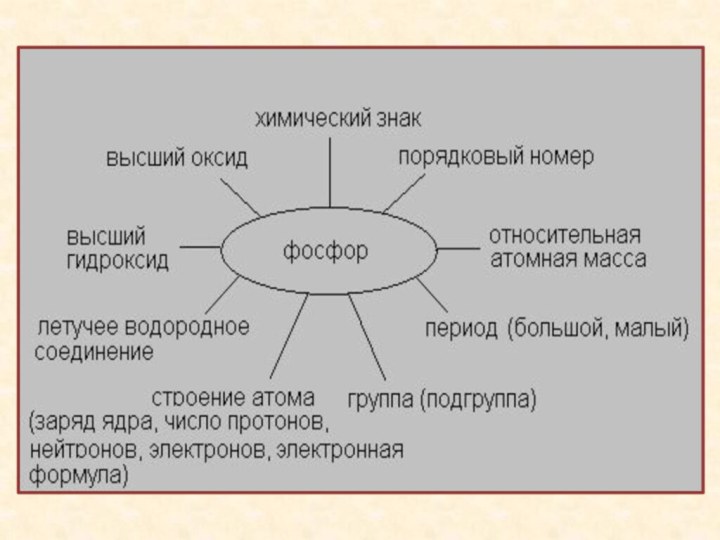
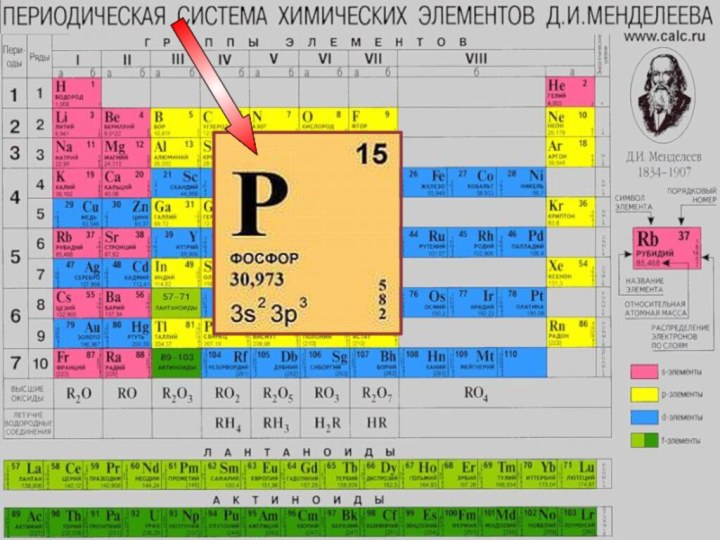
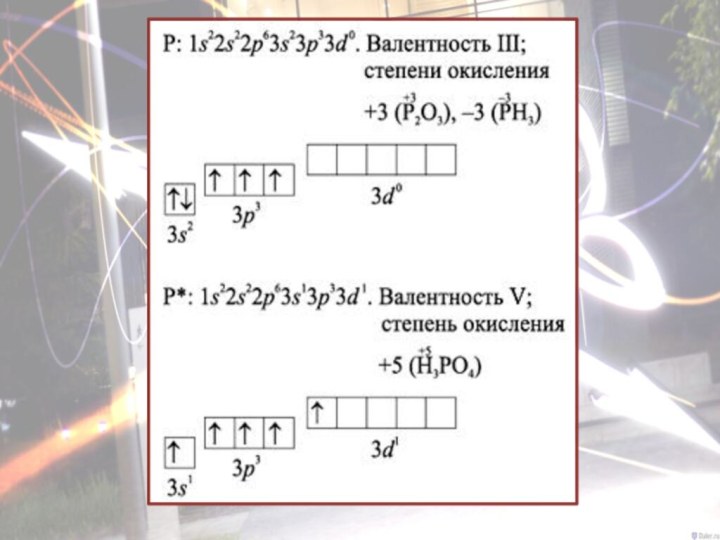
- 9. Строение атома фосфора
- 15. Белый фосфорБелый фосфор самовозгорается на воздухе.
- 16. Красный фосфорНе растворяется ни в воде, ни
- 17. Получение фосфорафосфат кальция Ca3(PO4)2электропечьбелый фосфор(желтый фосфор)2Ca3(PO4)2 + 6SiO2 + 10C = 6CaSiO3 + P4 + 10CO
- 18. Химические свойства фосфораФосфор проявляет и окислительные, и восстановительные свойства.Pˉ³–––––––P°––––––– P +⁵ (P+³) окислитель восстановитель восстанавливается окисляется
- 19. Взаимодействие с простыми веществами – неметаллами. Фосфор
- 20. 2. Взаимодействие с металлами. При нагревании фосфора
- 21. 3. Взаимодействие со щелочами. При нагревании белого
- 22. Сильные окислители превращают фосфор в фосфорную кислоту:
- 23. Реакция окисления также происходит при поджигании спичек,
- 24. Применение фосфораР Р Р Простой суперфосфат,
- 25. Двойной суперфосфат Ca3(PO4)2 + 4H3PO4 = 3Ca(H2O4)2
- 26. Оружие массового поражения
- 27. А. Е. ФерсманМечтая раздобыть свой философский камень,
- 28. Скачать презентацию
- 29. Похожие презентации
ФосфорТо я камень философский, То огонь холодный я, То цвет белый, красный, черный представляю я, А в России появился, светоносцем объявился.




















Слайд 3
Хеннинг Бранд,1669 г
Роберт Бойль
Фосфор, в переводе
с греческого «phosphoros» означает «светоносец»
Слайд 5
Нахождение в природе
Содержание в земной коре – 0,08%.
В природе фосфор встречается только в виде соединений.
Важнейшее
из них – фосфат кальция – минерал апатит, наиболее распространен фторапатит3Ca3(PO4)2 * CаF2. Разновидности апатита слагают осадочные горные породы – фосфориты.
Апатит
Слайд 6
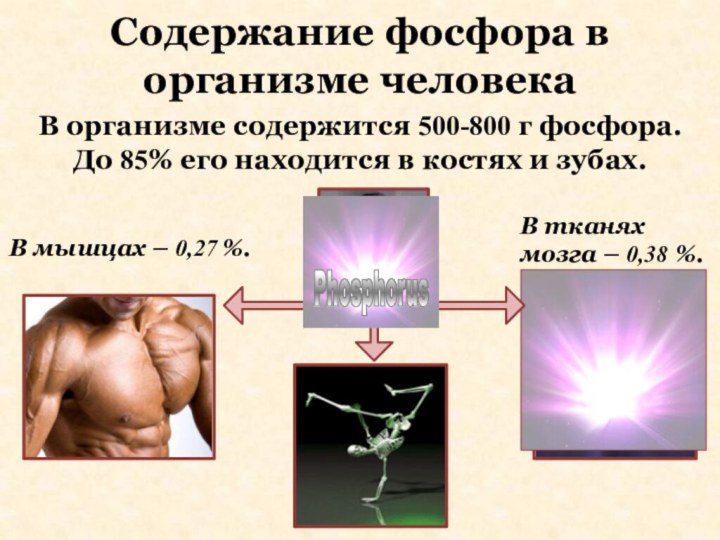
Содержание фосфора в организме человека
В тканях
мозга –
0,38 %.
В мышцах – 0,27 %.
В организме содержится
500-800 г фосфора. До 85% его находится в костях и зубах.
Phosphorus
Слайд 8
Знаете ли вы, что...
В теле человека
более 1,5 кг фосфора (1,4 кг в костях,
130
г в мышцах, 12 г в нервных тканях).Ежесуточная потребность взрослого человека в фосфоре от 1 до 1,2 г.
С каждым куском хлеба весом 100 г человек съедает до 10.0000000000000000000000 атомов фосфора.
Слайд 15
Белый фосфор
Белый фосфор самовозгорается на воздухе. Кроме
того, процесс окисления катализируется органическим веществом. Поэтому собака Баскервилей
не могла быть окрашена белым фосфором. Доза фосфора в 0,05-0,15 г для человека смертельна. Профессиональное заболевание рабочих спичечных фабрик был фосфорный некроз – поражение челюстей. Белый фосфор не только сильный яд, при попадании на кожу вызывает долго не заживающие ожоги.
Слайд 16
Красный фосфор
Не растворяется ни в воде, ни в
сероуглероде. На воздухе окисляется медленно и не самовоспламеняется.
Не
ядовит и не светится в темноте.Белый фосфор
Слайд 17
Получение фосфора
фосфат кальция
Ca3(PO4)2
электропечь
белый фосфор
(желтый фосфор)
2Ca3(PO4)2 + 6SiO2
+ 10C = 6CaSiO3 + P4 + 10CO
Слайд 18
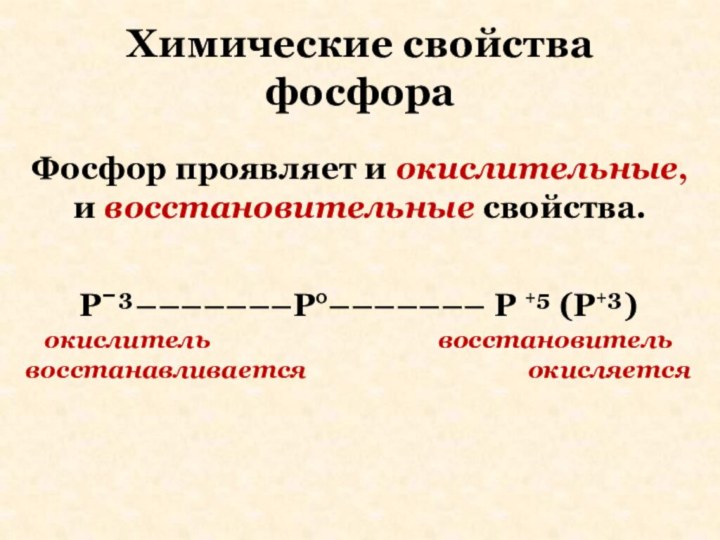
Химические свойства фосфора
Фосфор проявляет и окислительные, и восстановительные
свойства.
Pˉ³–––––––P°––––––– P +⁵ (P+³)
окислитель восстановитель
восстанавливается окисляется
Слайд 19
Взаимодействие с простыми веществами –
неметаллами.
Фосфор может
реагировать со многими неметаллами: кислородом, серой, галогенами, с водородом
фосфор не реагирует. В зависимости от того, находится фосфор в избытке или недостатке, образуются соединения фосфора (III) и (V), например: 2P + 3Br2 = 2PBr3 или 2P + 5Br2 = 2PBr52P + 3Cl2 = 2PCl3
4P + 5O2 = 2P2O5
(с избытком кислорода)
4P + 3O2 = 2P2O3
(при медленном окислении или при недостатке О2)
или 2P + 5Cl2 = 2PCl5
Слайд 20 2. Взаимодействие с металлами. При нагревании фосфора с
металлами образуются фосфиды:
3Mg + 2P = Mg3P2
Фосфиды некоторых металлов
могут разлагаться водой с образованием газообразногофосфина PH3:
Mg3P2 + 6H2O = 3Mg(OH)2 + 2PH3↑
Фосфин – очень ядовитый газ с неприятным запахом, легко воспламеняется на воздухе. Это свойство фосфина объясняет появление болотных блуждающих огней.
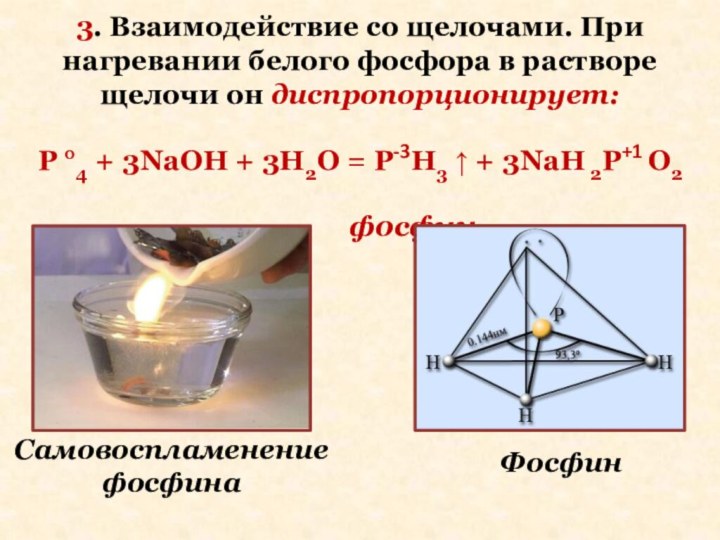
Слайд 21 3. Взаимодействие со щелочами. При нагревании белого фосфора
в растворе щелочи он диспропорционирует:
P °4 + 3NaOH +
3H2O = P-3H3 ↑ + 3NaH 2P+1 O2фосфин
Самовоспламенение фосфина
Фосфин
Слайд 22
Сильные окислители превращают фосфор в фосфорную кислоту:
3P°
+ 5HN+5O3 + 2H2O = 3H3P+5O4 + 5N+2O;
P°
- 5 е- = P+5 восстановитель (окисление) N+5+8 е- = N+2 окислитель
(восстановление)
Взаимодействие фосфора с азотной кислотой