беруге үйрету.
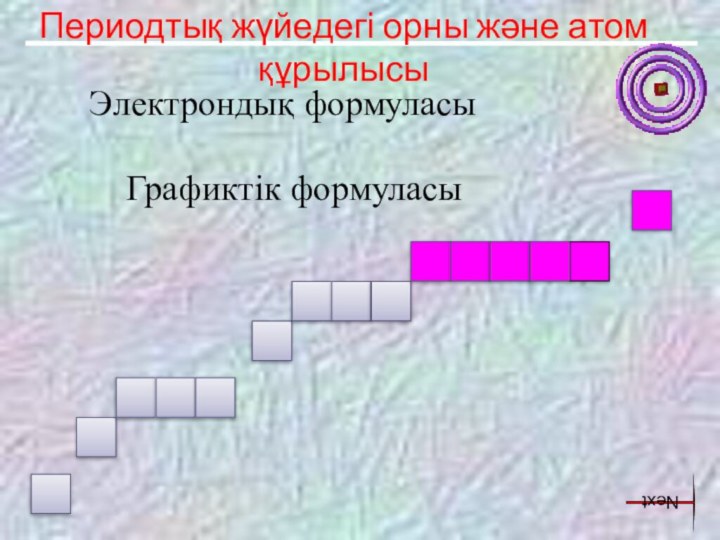
Темірдің құрылысы мен қасиеттерінің тікелей байланысын табу.
Оқушылардың қызығушылығын
дамыту.ХИМИЯ
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть














![Темір тақырыбына химиядан презентация Темірдің маңызды қосылыстарын анықтау Fe+2- ионына сапалық реакция2Fe2+ + K4[Fe(CN)6] → Fe2](/img/tmb/7/602870/4945fcfa83790b966ade3e8ff33a1cd3-720x.jpg)









ХИМИЯ
Back
Next
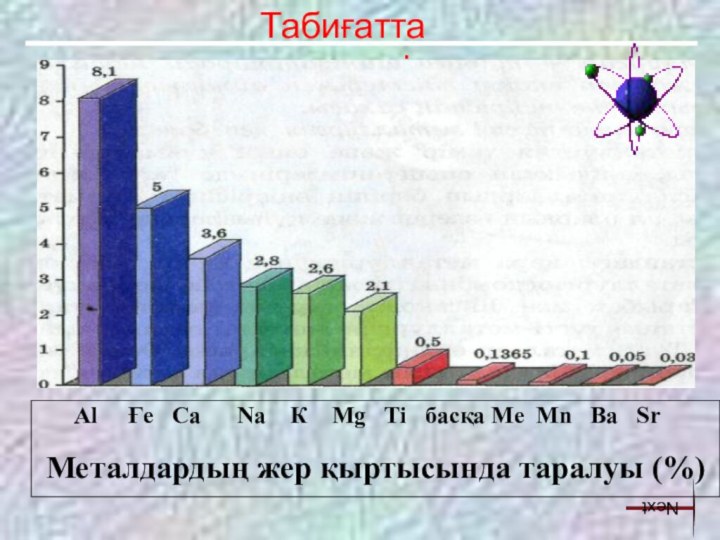
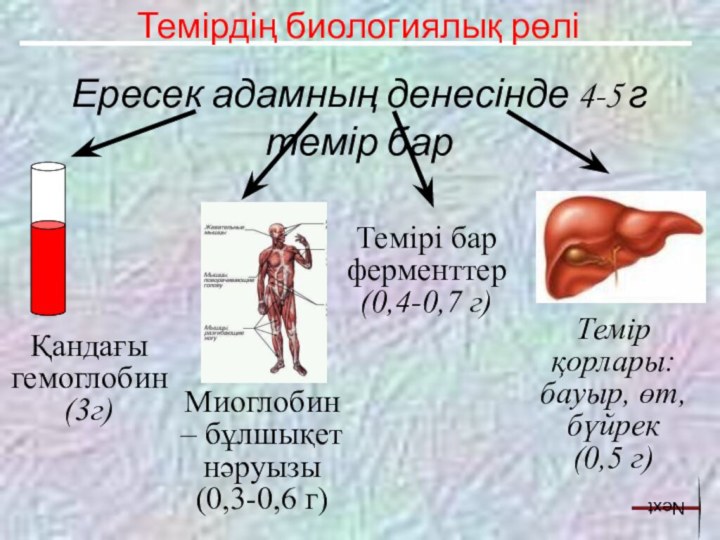
Темір қорлары: бауыр, өт, бүйрек
(0,5 г)
Next
Back
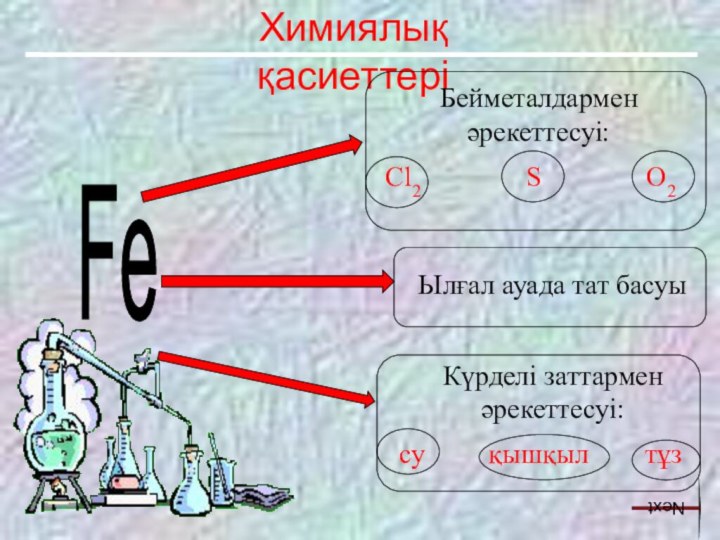
Ылғал ауада тат басуы
Күрделі заттармен әрекеттесуі:
су қышқыл тұз
Next
Next
Тотығу дәрежесі +3:
Cl2 HNO3
O2
Н2O
Fe + 4HNO3(сұйылт.) = Fe(NO3)3 + NO + 2H2O
Fe + H2SO4(сұйылт.) = FeSO4 + H2
Темір белсенділігі төмен металдарды олардың тұздарынан тотықсыздандырып, ығыстырып шығарады:
Fe + CuCl2 = FeCl2 + Cu
Fe+3- ионына сапалық реакция
Fe3+ + 3KCNS → Fe(CNS)3 + 3K+
калий тиоцианаты темір тиоцианаты
көк тұнба
қан қызыл
ерітінді
Back
Көміртек (II) оксидімен тотықсыздандыру
Fe3O4 + 4СО =
Алюминотермиялық әдіс:
Fe +
H2O
3Fe +
4СО2
2Fe +
Al2O3
Back