- Главная
- Разное
- Бизнес и предпринимательство
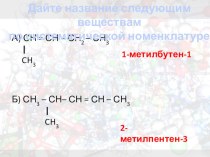
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Водород (9класс)
Содержание
- 2. Я, газ, легчайший и бесцветный,Неядовитый и безвредный,Соединяясь с кислородом,Я для питья даю вам воду!
- 3. Начало всех начал – водород!Взгляни на звезды:
- 4. Водород в космосе.
- 5. Ближайшая к нам звезда Галактики, которую мы
- 6. Водород на Земле.Вода Нефть Природныйгаз
- 7. Открытие водорода.Водород был открыт в первой половине
- 8. Первым ученым, описавшим свойства этого газа и
- 9. 1787 год Антуан Лавуазье доказал, что «горючий
- 10. Русское наименование «водород» предложил в 1824 году химик Михаил Федорович Соловьев
- 11. Химический элемент – водород Порядковый номер –
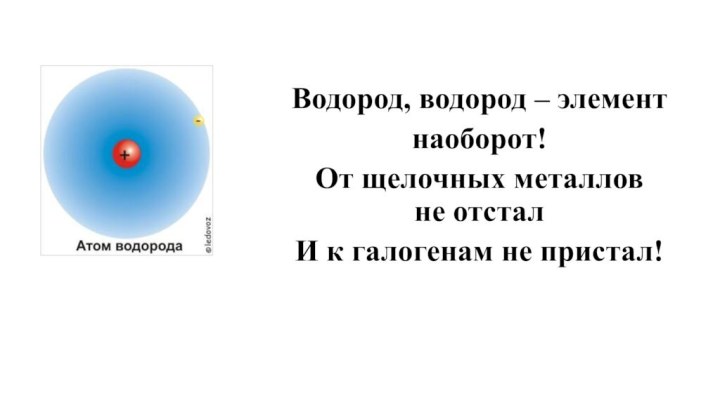
- 12. Водород, водород – элемент наоборот!От щелочных металлов не отстал И к галогенам не пристал!
- 13. Водород записывают в 2 резко противоположныегруппы химических
- 14. Физические свойства водорода. Лёгкий горючий газ без
- 15. Строение молекулы водорода.Тип химической связи – ковалентная
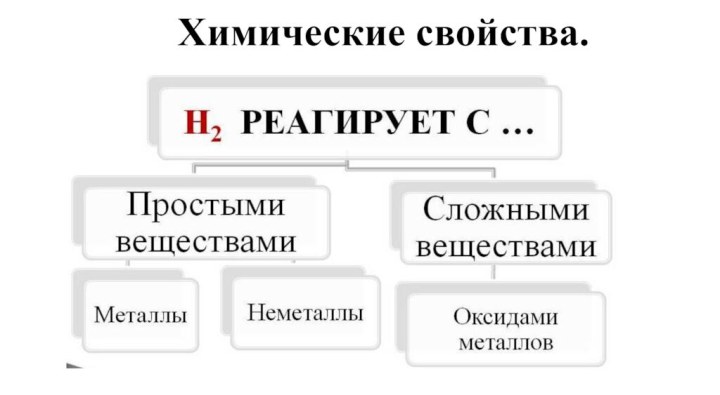
- 16. Химические свойства.
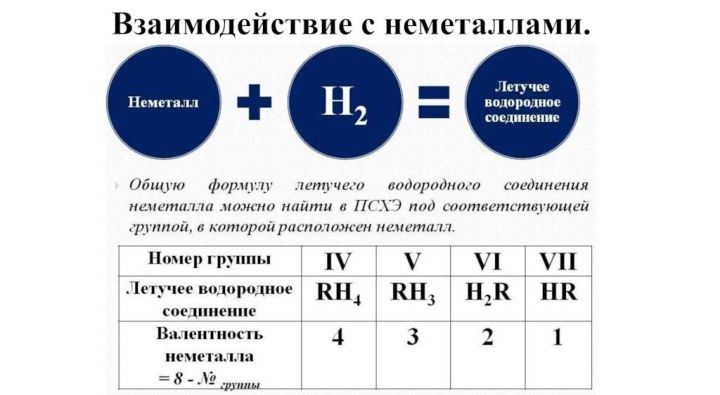
- 17. Взаимодействие с неметаллами.
- 18. Восстановительные свойства.1. При поджигании реагирует с кислородом
- 19. 3. С галогенами образует галогеноводороды: F2 +
- 20. 4. С азотом — при нагревании, повышенном
- 21. Окислительные свойства.С простыми веществами (с активными металлами):Mg
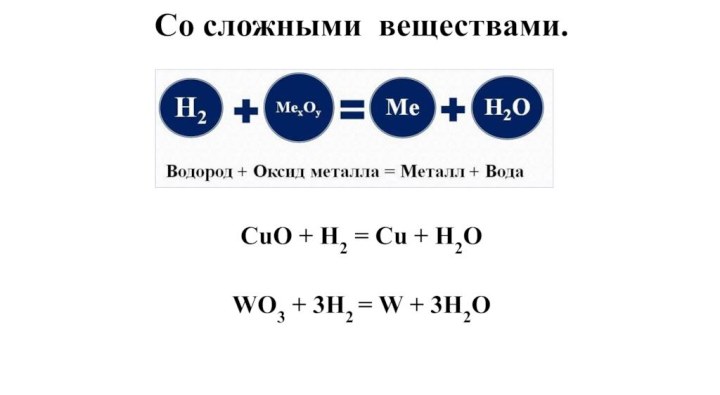
- 22. Со сложными веществами.CuO + H2 = Cu + H2O WO3 + 3H2 = W + 3H2O
- 23. Получение водорода.В промышленности : 1. Конверсией метана
- 24. 3. Термическим разложением метана:
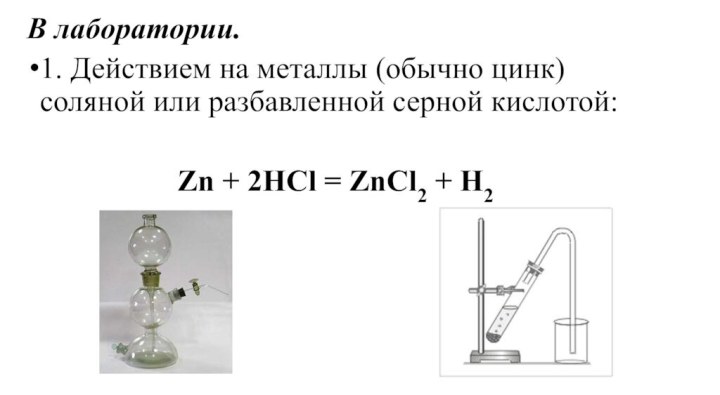
- 25. В лаборатории. 1. Действием на металлы (обычно
- 26. Собирание водорода.Методом вытеснения водыМетодом вытеснения воздуха
- 27. Образование гремучей смеси.Обычно лёгок и летуч,Он вдруг
- 28. Скачать презентацию
- 29. Похожие презентации
Я, газ, легчайший и бесцветный,Неядовитый и безвредный,Соединяясь с кислородом,Я для питья даю вам воду!























Слайд 3
Начало всех начал – водород!
Взгляни на звезды: много
звезд
В безмолвии ночном
Горит, блестит вокруг луны
На небе голубом.
Слайд 5 Ближайшая к нам звезда Галактики, которую мы знаем
под именем «Солнце», на 70 % своей массы состоит
из водорода.
Слайд 7
Открытие водорода.
Водород был открыт в первой
половине XVI века
немецким
врачом и естествоиспытателем
Теофрастом Парацельсом
То, что в одном веке
считают мистикой, в другом становится научным знанием.Слайд 8 Первым ученым, описавшим свойства этого газа и получивший
водород в чистом виде, был английский учены Генри Кавендиш в
1766 году.Он получил «искусственный воздух» действием цинка на разведённую соляную кислоту. Это было совершенно новое вещество, которое хорошо горело и получило название «горючего воздуха».
Слайд 9 1787 год Антуан Лавуазье доказал, что «горючий воздух»,
открытый в 1766 году входит в состав воды и
дал ему название «гидрогениум», т.е. «рождающий воду», «водород».«Ничто не теряется бесследно и ничто не возникает из ниоткуда, но всё трансформируется, перетекая из одной формы в другую»
Слайд 11
Химический элемент – водород
Порядковый номер – 1
Группа
– I
Период – 1
Электронная формула 1s1
Степени окисления: -1,
0, +1
Слайд 12
Водород, водород – элемент
наоборот!
От щелочных металлов
не
отстал
И к галогенам не пристал!
Слайд 13
Водород записывают в 2 резко противоположные
группы химических элементов:
-
в главной подгруппе I группы – подгруппе щелочные металлы
в
главной подгруппе VII группы- подгруппе галогены.Почему?
Слайд 14
Физические свойства водорода.
Лёгкий горючий газ без цвета,
запаха и вкуса.
Температура плавления -259,15°С
Температура кипения -252,7°СПлохо растворим в воде.
Простое вещество - водород.
Слайд 15
Строение молекулы водорода.
Тип химической связи – ковалентная неполярная
Тип
кристаллической решетки – молекулярная
Молекулярная масса – 2 г/моль
Слайд 18
Восстановительные свойства.
1. При поджигании реагирует с кислородом (горит
в кислороде с выделением большого количества тепла, 3000ºС )
O2
+ 2H2 = 2H2О2. При нагревании реагирует с серой :
S + H2 ↔ H2S
Слайд 19
3. С галогенами образует галогеноводороды:
F2 + H2 =
2HF
реакция протекает со взрывом при любой температуре
Cl2 + H2
↔ 2HClреакция протекает только на свету.
Слайд 20 4. С азотом — при нагревании, повышенном давлении
и в присутствии катализатора (железо):
N2 + 3H2 ↔ 2NH3
Fe
Слайд 21
Окислительные свойства.
С простыми веществами (с активными металлами):
Mg +
H2 → MgH2
MgH2 + H2O → Mg(OH)2 + H2
MgH2 + 2HCl → MgCl2 + 2H2
Слайд 23
Получение водорода.
В промышленности :
1. Конверсией метана парами
воды:
CH4 + H2O = 3H2 + CO
2. Конверсией оксида
углерода:СО + H2O = CO2 + H2
Слайд 24
3. Термическим разложением метана:
СН4 =
С + 2Н24. Электролизом воды. Получаемый водород
чистый, но очень дорогой.
2H2O = 2H2 + O2
t°