Слайд 2
Коррозия металлов
Ржавчина, которая появляется на поверхности
стальных и чугунных изделий, -это яркий пример коррозии.
О.Коррозией(от
лат. Corrodere – разъедать) называют самопроизвольное разрушение металлов и сплавов под влиянием окружающей среды.
Металлы подвергаются коррозии. Под коррозией понимают разрушение металла под воздействием окружающей среды. Это самопроизвольный окислительно-восстановительный процесс. По механизму протекания разрушения различают два типа коррозии: химическую и электрохимическую.
Слайд 3
Подразделение коррозии
Коррозия
Химическая Электрохимическая
(разрушение металла (разрушение металла в
окислением его в результате возникновения
окружающей среде гальванической пары и
без возникновения появления внутри системы
электрического тока электрического тока)
в системе)
Слайд 4
При этом наряду с химическими процессами(Отдача электронов)
протекают и электрические(перенос электронов от одного участка к другому)
Примером электрохимической коррозией можно привести коррозию железа в контакте с медью в растворе электролита-соляной кислоты. При таком контакте возникает гальванический элемент.
Как было показано на рисунке, более активный металл-железо (анод) окисляется, посылая электроны атома меди, и переходит в раствор в виде ионов Fe, образуя с хлорид-ионами среды хлорид и железа (II) FeCL2.
Ионы же водорода движутся к меди (катоду), где, принимая электроны, разряжаются.
Слайд 5
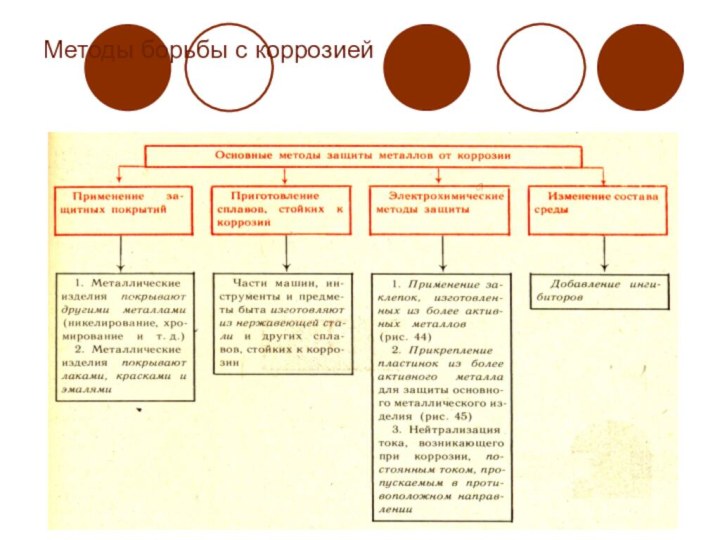
Защита от коррозии
Коррозия металлов протекает непрерывно и причиняет
огромные убытки. Подсчитано, что прямые потери железа от коррозии
составляют около 10% его ежегодной выплавки. В результате коррозии металлические изделия теряют ценные технические свойства. Поэтому имеют очень большое значение методы защиты металлов и сплавов от коррозии. Они весьма разнообразны.
Металлические Неметаллические
(покрытые цинком, оловом, (покрытые лаком, краской,
свинцом, никелем, хромом эмалью и другими
и другими металлами) веществами)
Слайд 6
Создание сплавов с
антикоррозионными свойствами
Введением в состав стали
до 12% хрома получают нержавеющую сталь, устойчивую к коррозии.
Добавки никеля, кобальта и меди усиливают антикоррозионные свойства стали, так как повышается склонность сплавов к пассивации. Создание сплавов с антикоррозионными свойствами – одно из важных направлений борьбы с коррозионными потерями.
Слайд 7
Сущность процесса коррозии
Железо и его сплавы сильно подвергаются
коррозии. Сущность этого процесса заключается в том, что атомы
железа под воздействием кислорода, воды, ионов водорода постепенно окисляются.
Так как в воздухе могут содержаться оксид углерод(IV), оксид серы(IV), то в результате получаются кислоты. При диссоциации последних образуются ионы водорода, которые тоже окисляют атомы металлов
Слайд 8
Сущность процесса коррозии
Железо и его сплавы сильно подвергаются
коррозии. Сущность этого процесса заключается в том, что атомы
железа под воздействием кислорода, воды, ионов водорода постепенно окисляются.
Так как в воздухе могут содержаться оксид углерод(IV), оксид серы(IV), то в результате получаются кислоты. При диссоциации последних образуются ионы водорода, которые тоже окисляют атомы металлов:
Fe + 2H = Fe +H2
Слайд 9
Опытным путем установлено, что металл быстрее окисляется ионами
водорода, если он находится в контакте с другим менее
активным металлом. Так, например, если поместить кусочек цинка в раствор серной кислоты, то сначала реакция протекает энергично, а затем постепенно замедляется. Однако если прикоснуться к кусочку цинка медной проволокой, то реакция заметно ускоряется.
Слайд 10
Рассмотренное явление характерно не только для цинка и
меди, но и для любых двух различных металлов. При
взаимном контакте в присутствии электролита один из металлов (находящихся в электрохимическом ряду напряжение левее) заряжается отрицательно, а другой – положительно. Если соединить эти металлы проводником через гальванометр, то последний покажет наличие тока(гальванический элемент). Более активный металл разрушается.
Слайд 12
Занимательное о железе
Люди издавна интересовались вопросами защиты металла
от коррозии. Древнегреческий историк Геродот (V век до н.э.)
и древнеримский ученый Плиний Старший (I век н.э.) упоминают о применении олова для защиты железа от ржавчины. Средневековые алхимики мечтали получении нержавеющего железа.
Защита металла от коррозии сейчас осуществляется различными способами: снижением агрессивности коррозионной среды; повышением коррозионной стойкости металла путем его легирования; нанесением на поверхность металла различных защитных пленок, лавок, красок, эмалей. Ученые создали новое стеклокристаллическое покрытие, которое отличалось стойкостью и способностью работать при более высокой, чем металлы, температуре.
Слайд 14
Влияние условий окружающей среды
на коррозию металлов
Чаще всего
подвергаются изделия из железа. Особенно сильно корродирует металл во
влажном воздухе. Упрощенно этот процесс можно выразить следующем уравнением химической реакции:
4Fe + 3O2 + 6H2O = 4Fe(OH)3