- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Алкены - непредельные углеводороды. Получение, химические свойства и применение
Содержание
- 2. Учебная цель: изучить состав, строение молекул,способы
- 3. Проверь себя: 1
- 4. Физические свойства Алкены – этен, пропен
- 6. ПРОМЫШЛЕННЫЕСПОСОБЫПОЛУЧЕНИЯ АЛКЕНОВЛАБОРАТОРНЫЕКРЕКИНГ АЛКАНОВДЕГИДРИРОВАНИЕАЛКАНОВДЕГИДРАТАЦИЯСПИРТОВДЕГАЛОГЕНИРОВАНИЕДЕГИДРО-ГАЛОГЕНИРОВАНИЕ
- 7. ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯКРЕКИНГ НЕФТЕПРОДУКТОВАЛКАН →
- 8. ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯДЕГИДРИРОВАНИЕ АЛКАНОВ АЛКАН →
- 9. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯДЕГИДРАТАЦИЯ СПИРТОВСПИРТ → АЛКЕН +
- 10. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯДЕГАЛОГЕНИРОВАНИЕПРИМЕР:
- 11. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯДЕГИДРОГАЛОГЕНИРОВАНИЕ
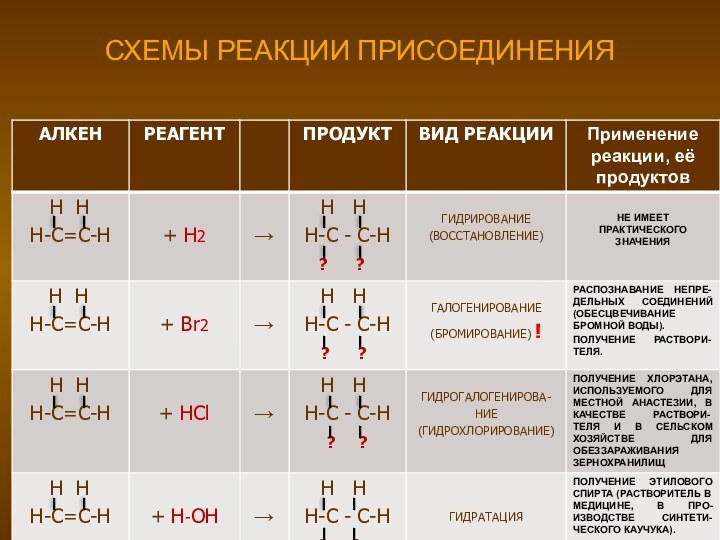
- 12. СХЕМЫ РЕАКЦИИ ПРИСОЕДИНЕНИЯ
- 13. РЕАКЦИЯ ПОЛИМЕРИЗАЦИИЭто процесс соединения одинаковых молекул в
- 14. РЕАКЦИИ ОКИСЛЕНИЯГОРЕНИЕ АЛКЕНОВ ПРИМЕР:
- 15. РЕАКЦИИ ОКИСЛЕНИЯ МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С
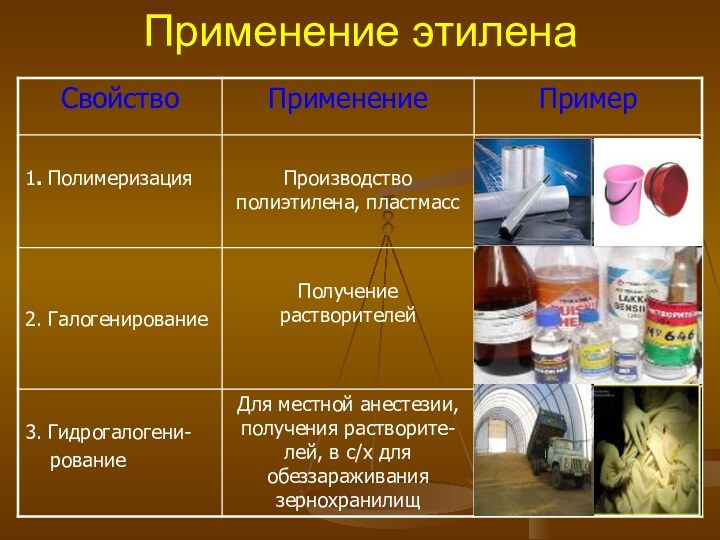
- 16. Применение этилена
- 18. Ответьте, пожалуйста, на следующие вопросы:Какие углеводороды называются
- 19. ДОМАШНЕЕ ЗАДАНИЕОценка «3»: & 4, Оценка «4»:
- 20. Скачать презентацию
- 21. Похожие презентации
Учебная цель: изучить состав, строение молекул,способы получения,химические свойства и применение алкенов на примере непредельного углеводорода - этилена















Слайд 2
Учебная цель:
изучить состав, строение молекул,способы получения,химические
свойства и применение алкенов
этилена
Слайд 3
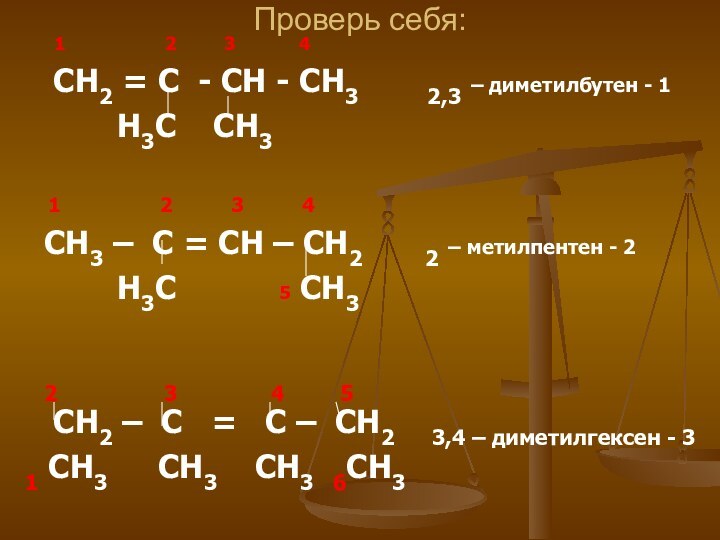
Проверь себя:
1
2
3 4СН2 = С - СН - СН3 2,3 – диметилбутен - 1
Н3С СН3
1 2 3 4
СН3 – С = СН – СН2 2 – метилпентен - 2
Н3С 5 СН3
2 3 4 5
СН2 – С = С – СН2 3,4 – диметилгексен - 3
1 СН3 СН3 СН3 6СН3
Слайд 4
Физические свойства
Алкены – этен, пропен
и бутен – при обычных условиях (20 °С, 1 атм)
– газы, от С5Н10 до С18Н36 – жидкости,высшие алкены – твердые вещества.
Алкены нерастворимы в воде, но хорошо растворимы в органических растворителях.
Слайд 6
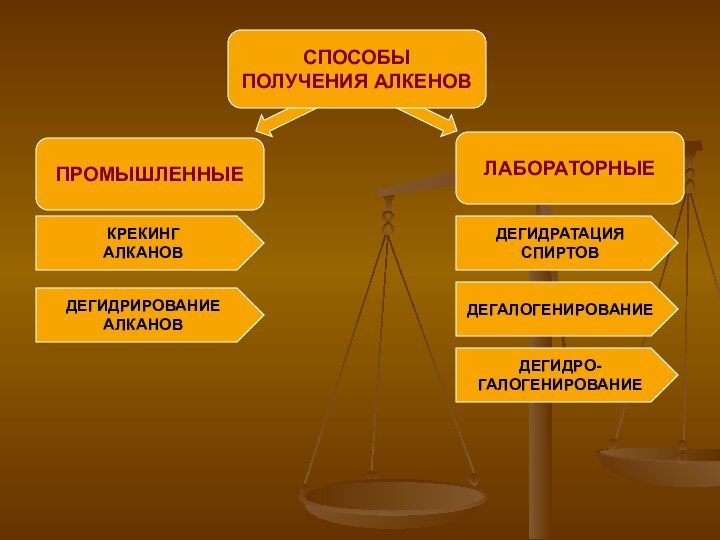
ПРОМЫШЛЕННЫЕ
СПОСОБЫ
ПОЛУЧЕНИЯ АЛКЕНОВ
ЛАБОРАТОРНЫЕ
КРЕКИНГ
АЛКАНОВ
ДЕГИДРИРОВАНИЕ
АЛКАНОВ
ДЕГИДРАТАЦИЯ
СПИРТОВ
ДЕГАЛОГЕНИРОВАНИЕ
ДЕГИДРО-
ГАЛОГЕНИРОВАНИЕ
Слайд 7
ПРОМЫШЛЕННЫЙ
СПОСОБ ПОЛУЧЕНИЯ
КРЕКИНГ НЕФТЕПРОДУКТОВ
АЛКАН → АЛКАН +
АЛКЕН
С БОЛЕЕ ДЛИННОЙ
С МЕНЕЕ ДЛИНОЙУГЛЕРОДНОЙ УГЛЕРОДНОЙ
ЦЕПЬЮ ЦЕПЬЮ
ПРИМЕР:
t=400-700C
С10Н22 → C5H12 + C5H10
декан пентан пентен
Слайд 8
ПРОМЫШЛЕННЫЙ
СПОСОБ ПОЛУЧЕНИЯ
ДЕГИДРИРОВАНИЕ АЛКАНОВ
АЛКАН → АЛКЕН
+ ВОДОРОД
ПРИМЕР:
Ni, t=500CН3С - СН3 → Н2С = СН2 + Н2
этан этен
(этилен)
Слайд 9
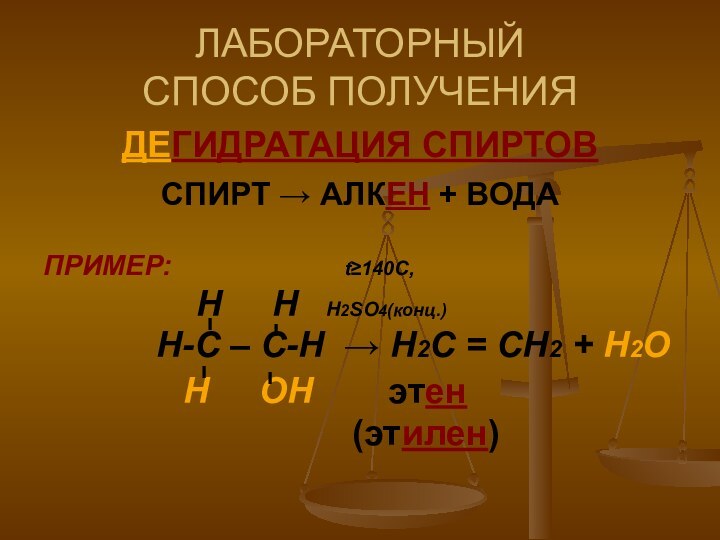
ЛАБОРАТОРНЫЙ
СПОСОБ ПОЛУЧЕНИЯ
ДЕГИДРАТАЦИЯ СПИРТОВ
СПИРТ → АЛКЕН + ВОДА
ПРИМЕР:
t≥140C,
Н Н Н2SO4(конц.)
Н-С – С-Н → Н2С = СН2 + Н2О
Н ОН этен
(этилен)
Слайд 10
ЛАБОРАТОРНЫЙ
СПОСОБ ПОЛУЧЕНИЯ
ДЕГАЛОГЕНИРОВАНИЕ
ПРИМЕР:
t
Н2С – СН2 + Zn → Н2С = СН2 + ZnBr2
Br Br этен
1,2-дибромэтан (этилен)
Слайд 11
ЛАБОРАТОРНЫЙ
СПОСОБ ПОЛУЧЕНИЯ
ДЕГИДРОГАЛОГЕНИРОВАНИЕ
УДАЛИТЬ ВОДОРОД ГАЛОГЕН ДЕЙСТВИЕ
ПРИМЕР:
спиртовойH H раствор
Н-С–С-Н+KOH→Н2С=СН2+KCl+H2O
Н Cl этен
хлорэтан (этилен)
Слайд 13
РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ
Это процесс соединения одинаковых молекул в более
крупные.
ПРИМЕР: n CH2=CH2 (-CH2-CH2-)n
этилен полиэтилен (мономер) (полимер)
n – степень полимеризации, показывает число молекул, вступивших в реакцию
-CH2-CH2- структурное звено
Слайд 15
РЕАКЦИИ ОКИСЛЕНИЯ
МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С РАСТВОРОМ
ПЕРМАНАГАНАТА КАЛИЯ
(реакция Е.Е.Вагнера)
Н2С=СН2 + [O] + H2O
H2C - CH2OH OH
этиленгликоль
(этандиол-1,2)
! Качественная реакция на непредельность углеводорода – на кратную связь.
Слайд 18
Ответьте, пожалуйста, на следующие вопросы:
Какие углеводороды называются алкенами?
Какова
общая формула алкенов?
Каковаособенность строения представителей гомологического ряда алкенов? Назовите
первого представителя ряда.Какие способы получения алкенов вы знаете? Каким лабораторным способом можно получить алкены?
Какие химические свойства обуславливает наличие кратной (двойной) связи в молекулах алкенов?
Для чего используют алкены?
Слайд 19
ДОМАШНЕЕ ЗАДАНИЕ
Оценка «3»: & 4,
Оценка «4»: &
4, Хомченко И.Г.: 20.21
Оценка «5»: & 4, Составить уравнения
реакций по цепочке превращений, используя материал по теме «Алкены»C2H5CL? C2H4?C2H6? C2H4?C2H5OH