Слайд 2
Из глины я обыкновенной,
И на редкость современный,
Не боюсь
электротока,
Хозяйкам на кухне служу без срока,
Бесстрашно в воздухе лечу,
Мне
все задачи по плечу.
Конструкции лёгкие из дюрали,
Не перечислить всех регалий,
Горжусь своим я именем
Зовусь я …
Слайд 4
План урока:
Строение атома
алюминия
Нахождение
в природе
Открытие
металла и
получение
Физические
свойства
Химические
свойства
Применение
Слайд 5
Периодическая система химических элементов Д.И.Менделеева
Группы элементов
I
II
III
IV
VII
VI
V
VIII
3
2
1
4
5
6
7
1
2
3
4
5
6
7
8
9
10
s
d
p
Слайд 6
Периодическая система химических элементов Д.И.Менделеева
Периоды
1
2
3
4
5
6
7
Ряды
1
2
3
4
10
9
8
7
5
6
Группы элементов
I
II
VI
V
VII
III
IV
VIII
Al
Слайд 7
Алюминий
7. Содержание в земной коре
Слайд 8
Алюминий
Нахождение в природе
Слайд 9
ПРИРОДНЫЕ СОЕДИНЕНИЯ АЛЮМИНИЯ
АЛЮМОСИЛИКАТЫ
КОРУНД Al2O3 – прозрачные кристаллы
Слайд 10
Алюминий
1. Из истории открытия
Впервые Al был получен датским
физиком Эрстедом Х.
в 1825 г. Название элемента происходит
от лат.
алюмен, так в древности называли квасцы,
которые использовали для крашения
тканей (KAl(SO4)2 . 12H2O).
Позже в 1827 г. немецкий химик
Фридрих Велер получил алюминий
следующим способом:
Слайд 11
Алюминий
1. Из истории открытия
В период
открытия алюминия - металл был дороже золота. Англичане хотели
почтить богатым подарком великого русского химика Д.И Менделеева, подарили ему химические весы, в которых одна чашка была изготовлена из золота, другая - из алюминия. Чашка из алюминия стала дороже золотой. Полученное «серебро из глины» заинтересовало не только учёных, но и промышленников и даже императора Франции.
Слайд 12
В 1852г. килограмм алюминия
стоил 1200 долларов –
дороже золота!
Когда его открыли в 1825 году, он стоил в 1500 раз дороже железа. Даже 30 лет спустя на его слиток, демонстрировавшийся на Всемирной выставке в Париже смотрели как на драгоценность.
алюминий стал намного дешевле , т.к.
Чарльз Холл изобрел способ получения
алюминия электролизом
Слайд 14
Метод Холла позволил получать сравнительно недорогой алюминий в
больших масштабах. Если с 1855 до 1890 г. было
произведено лишь 200 т алюминия, то за следующее десятилетие по новому методу – уже 28 тысяч тонн!
Чарлз Холл разработал электролитический
способ получения алюминия
Слайд 15
Метод Чарлза Холла позволял получать сравнительно недорогой
алюминий в больших масштабах –
началась эпоха алюминия…
Слайд 16
Алюминий
Al
27
+13
0
2
8
3
p = 13
e = 13
n = 14
−
Краткая электронная
запись:
Слайд 17
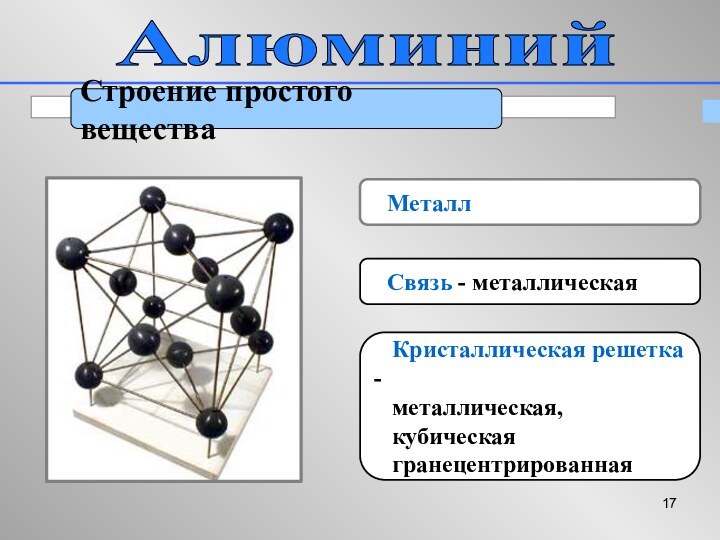
Алюминий
Строение простого вещества
Металл
Связь -
металлическая
Кристаллическая решетка -
металлическая,
кубическая
гранецентрированная
Слайд 19
Алюминий покрыт
тонкой, прочной оксидной пленкой
tпл.Al2O3 = 2050 0C
tпл.Al = 660 0C
Слайд 20
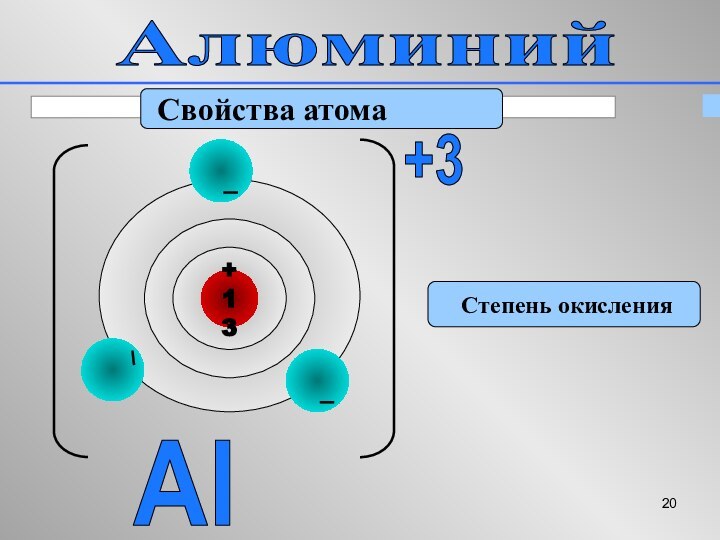
Алюминий
Свойства атома
Степень окисления
Al
+3
Слайд 21
Алюминий
Свойства атома
Восстановительные
Электрохимический ряд напряжений металлов
Li, K, Ca,
Na, Mg, Al, Cr, Zn, Fe, Co, Pb,H2,Cu,Hg,Ag
Ослабление восстановительных
свойств
Слайд 22
Химические свойства алюминия:
Al
+
простые
вещества
сложные
вещества
О2
СL2
N2
S
H2O
NaOH+H2O
HCl
Fe2O3
Слайд 23
Химические свойства
2Al
+3O2
Al2O3
+3Cl2
2AlCl3
+3S
Al2S3
Слайд 24
Химические свойства.
С водой:
2Al + 3H2O = 2Al(OH)3 +
3H2
Почему алюминиевую посуду используют в быту?
Слайд 25
Алюминий – очень активный металл.
Однако при комнатной температуре
на воздухе алюминий не изменяется, поскольку его поверхность покрыта
очень прочной тонкой оксидной плёнкой, которая защищает металл от воздействия компонентов воздуха и воды.
Слайд 26
Алюминий без защиты
Лишенный оксидной пленки, алюминий активно взаимодействует
с водой, а на воздухе быстро окисляется, при этом
металл нагревается и обрастает белой «бородой» оксида
Слайд 27
Химические свойства.
С кислотами:
соляной
серной
фосфорной
2Al + 6HCl = 2AlCl3 +
3H2
2Al + 3H2SO4 = Al2(SO4)3+ 3H2
Al + H3PO4 =
не возможно
Слайд 28
НО образуется нерастворимая соль AlPO4.
Доступ кислоты H3PO4 к
алюминию невозможен.
Реакция прекращается.
Al + H3PO4 AlPO4 + H2
Слайд 29
Алюминий – нетипичный металл
2 Аl + 6 HCl
= 2 AlCl3 +3 Н2↑
алюминий
хлорид
2 Аl + 2NaOH + 6 Н2О = 2 Na[Al(OH)4] + 3 H2↑
натрий алюминат
Слайд 30
Химическая природа Al2O3
Al2O3 – амфотерен
Al2O3 + 6 НCl = 2AlCl3 + 3 Н2О
Al2O3+2NaOH+6H2O = 2Na[Al(OH)4]+3H2↑
Слайд 31
Почему алюминиевую кастрюлю не рекомендуется мыть с содой
?
Раствор соды обладает щелочной реакцией, поэтому алюминий может постепенно
просто растворяться, взаимодействуя со щелочью
Слайд 32
Химические свойства.
С растворами солей:
хлоридом железа (III)
хлоридом натрия
Al
+ FeCl3 = AlCl3 + Fe
Al + NaCl =
не возможно
Слайд 33
Al + NaCl AlCl3 +Na
Но алюминий в
электрохимическом ряду напряжений металлов:
K Ca Na Mg Al Zn
Fe Pb H2 Cu Ag Hg Pt
находится правее натрия, а значит его восстановительные свойства меньше, чем у натрия.
Следовательно, алюминий не может вытеснить натрий из его солей.
Слайд 34
Алюминий может покраснеть …!!!
2Аl
+ 3СиSO4 = Al2(SO4 )3 + 3 Cu
Al – является восстановителем
Алюминий покрылся медным налетом в растворе медного купороса
Слайд 35
Это реакция алюминотермии
Аl и в этой реакции «работает» как восстановитель
2 Al
+ Fe2O3 = Al2O3 + 2 Fe
Слайд 40
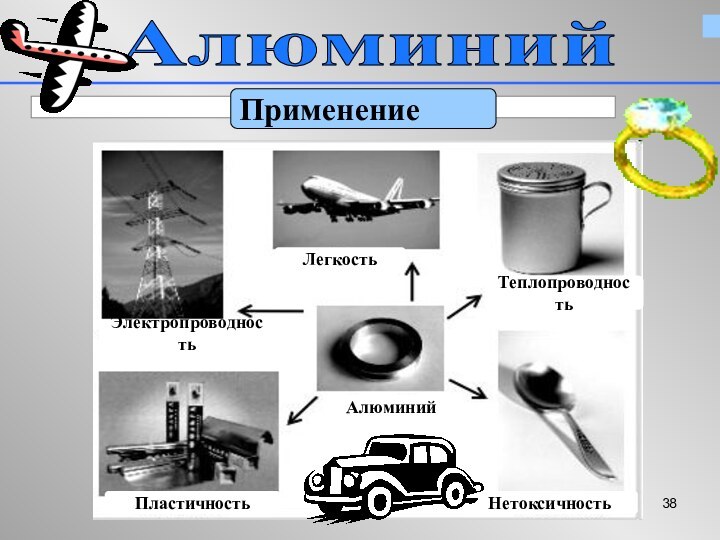
Алюминий – «крылатый металл»
Входит в состав известных сплавов
– дюралюминий, магналий, силумин,
используемых в самолетостроении
Используемые свойства:
легкость, прочность, коррозионная стойкость (устойчивость к воздуху и воде )
Слайд 41
Алюминий и его сплавы широко применяют как конструкционный
материал
Слайд 43
Конструкционные сплавы в архитектуре городов
Слайд 45
В том числе при изготовлении транспортных средств
Слайд 47
Алюминий в электротехнике
Используемые свойства
Высокая электропроводность
Легкость
При одинаковом электросопротивлении
алюминиевый провод весит вдвое меньше медного
Слайд 49
Из алюминия делают линии электропередач, ёмкости, цистерны, «серебряную»
краску.
Используемые свойства: легкость,прочность,коррозионная
прочность, нетоксичность
Слайд 51
Термит – смесь Fe3O4 с порошком Al.
При поджигании
смеси происходит энергичная реакция с выделением большого количества теплоты,
которой достаточно для полного расплавления получаемого железа.
8Al + 3Fe3O4 4Al2O3 + 9Fe
Этот процесс используют для сварки стальных рельс.
Слайд 52
Металл будущего
Вывод: Обладая такими свойствами как лёгкость, прочность,
коррозионноустойчивость, устойчивость к действию сильных химических реагентов - алюминий
нашёл большое значение в авиационном и космическом транспорте применение во многих отраслях народного хозяйства. Особое место алюминий и его сплавы занимают в электротехнике, а за ними будущее нашей науки и техники.