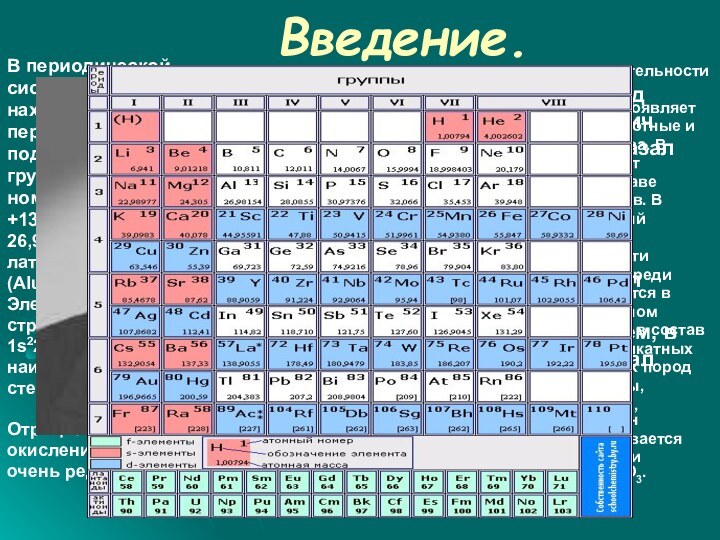
его атомный
номер13, заряд ядра
+13,атомная масса
26,9815.Обозначается
латинскими буквами AL
(Aluminium).
Электронное
строение атома
1s22s22p63s23p1,
наиболее
характернаястепени окисления
+3 и 0.
Отрицательные степени
окисления проявляются
очень редко.
По электроотрицательности
(1,47) одинаков с
бериллием(Be), проявляет
амфотерные (кислотные и
основные) свойства. В
соединениях может
находиться в составе
катионов и анионов. В
природе- четвертый
по химической
распространенности
элемент (первый среди
металлов), находится в
химически связанном
состоянии. Входит в состав
многих алюмосиликатных
минералов, горных пород
(граниты, порфиры,
базальты, сланцы), различных глин
(белая глина называется
каолин), бокситов и глинозёма Аl2О3.
Около 100 лет назад Николай Гаврилович Чернышевский, сказал об алюминии, что этому металлу суждено великое будущее, что алюминий – металл социализма. Он оказался провидцем, в XX в. алюминий стал основой многих конструкционных материалов