- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Ферменты
Содержание
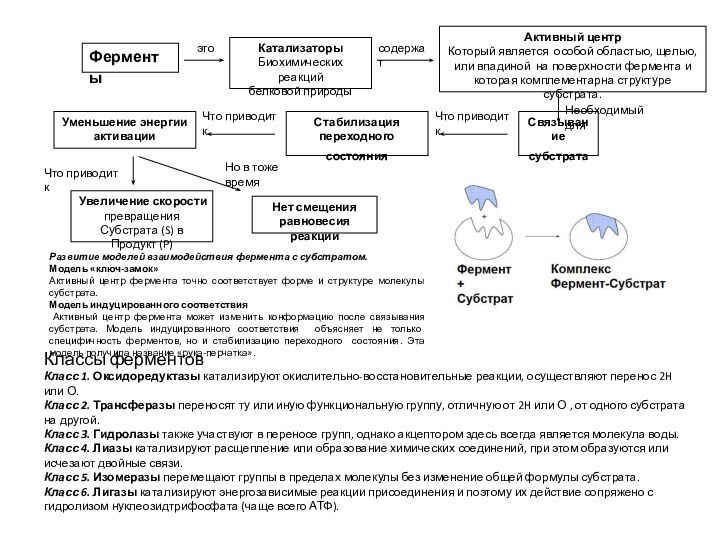
- 2. Ферменты это Катализаторы биохимических реакций белковой природы,
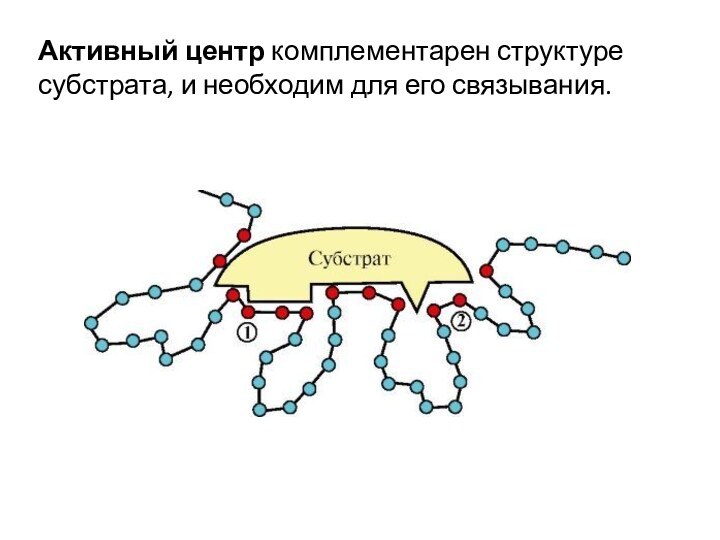
- 3. Активный центр комплементарен структуре субстрата, и необходим для его связывания.
- 4. Связывание субстрата приводит к: Стабилизации переходного состояния,
- 5. Развитие моделей взаимодействия фермента с субстратом.Модель «ключ-замок»
- 6. Модель индуцированного соответствия (Дениел Кошланд, 1958 г.)
- 7. Поскольку молекула фермента довольно гибкая, а субстрат
- 8. Химическая природа и структура ферментов. Большинство ферментов
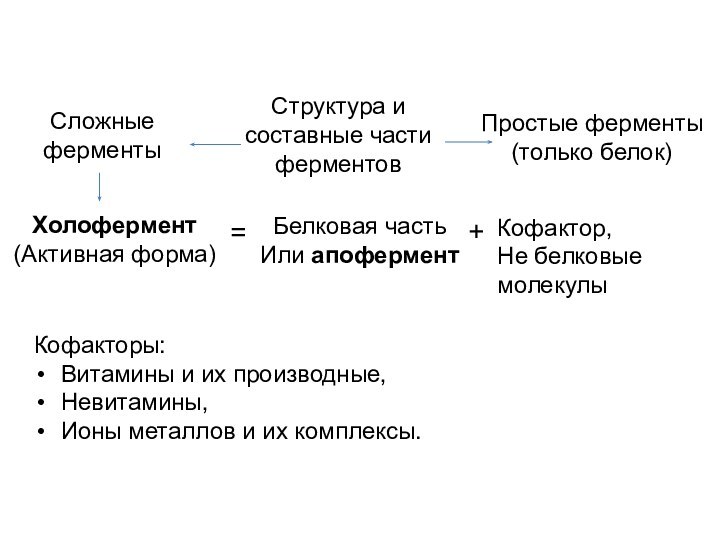
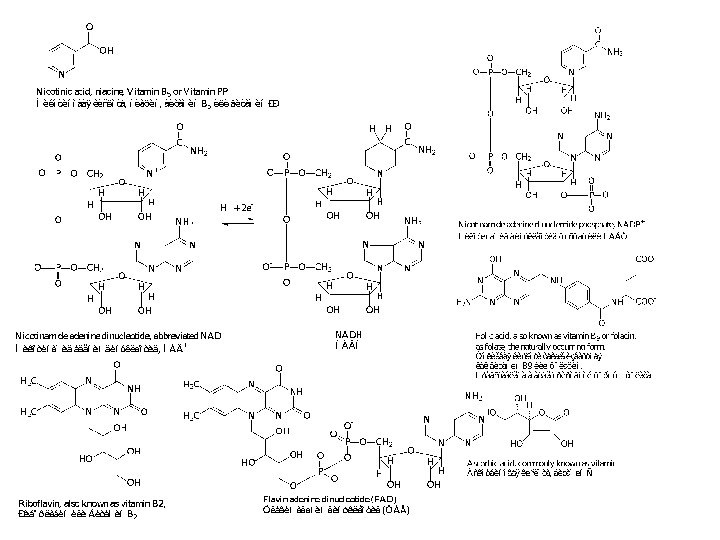
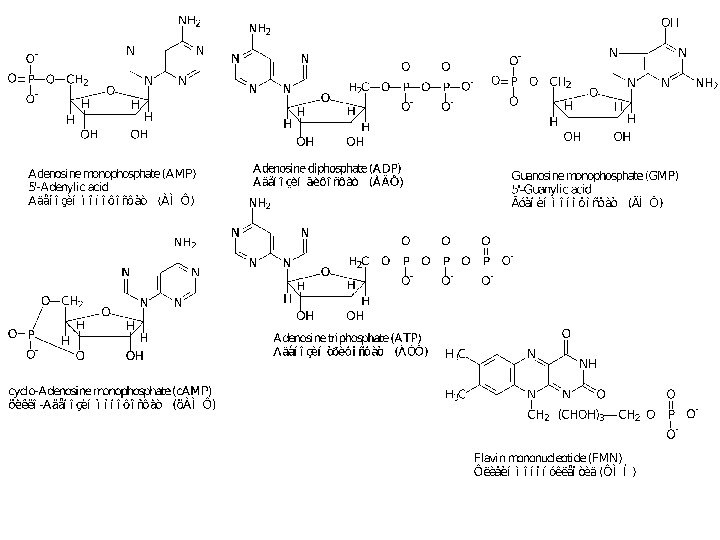
- 9. Кофакторы:Витамины и их производные,Невитамины,Ионы металлов и их комплексы.
- 10. Кофакторы:Кофермент не связан ковалентно с ферментом, но
- 14. Ионы металлов и их комплексы
- 15. Классификация ферментов. Различают два главных вида специфичности ферментов:
- 16. Различают 4 типа субстратной специфичности:1. Стереоспецифичность –
- 17. Специфичность к цис- и транс-изомерам. Например, аспартаза
- 18. 2. Абсолютная специфичность – фермент производит катализ только одного вещества. Например, расщепление мочевины уреазой.
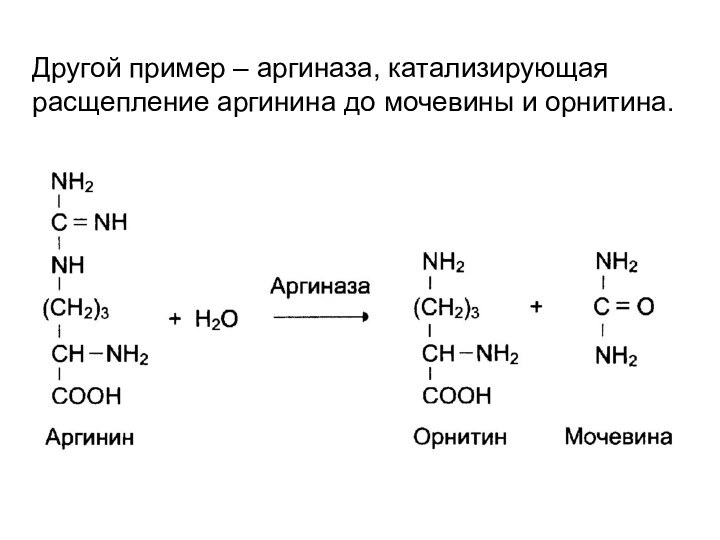
- 19. Другой пример – аргиназа, катализирующая расщепление аргинина до мочевины и орнитина.
- 20. 3. Групповая специфичность – катализ субстратов с
- 21. 4. Относительная групповая специфичность – превращение субстратов
- 22. Специфичность действия - это способность фермента катализировать
- 23. Номенклатура ферментов принята V Международным конгрессом биохимиков
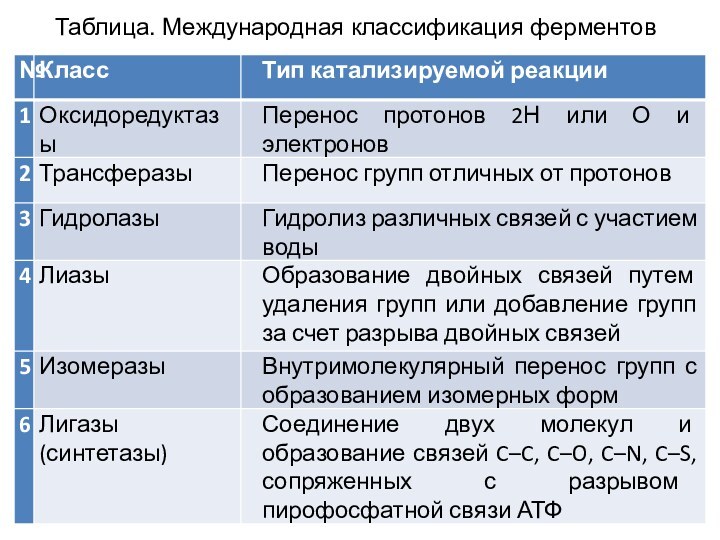
- 24. Таблица. Международная классификация ферментов
- 25. Классы ферментовКласс 1. Оксидоредуктазы катализируют окислительно-восстановительные реакции,
- 26. На основании разработанной системы, которая служит основой
- 27. Код каждого фермента содержит четыре цифры, разделенные
- 28. Эти подклассы в свою очередь делятся на
- 29. Клеточная организация ферментативной активностиФерменты располагаются в субклеточных
- 30. Зависимость скорости ферментативной реакции от температуры. Ферментативные
- 31. Зависимость активности ферментов от температуры называется термолабильностью.
- 32. Зависимость ферментативной активности от рН среды.Каждый фермент
- 34. Классы ферментовКласс 1. Оксидоредуктазы катализируют окислительно-восстановительные реакции,
- 36. Скачать презентацию
- 37. Похожие презентации
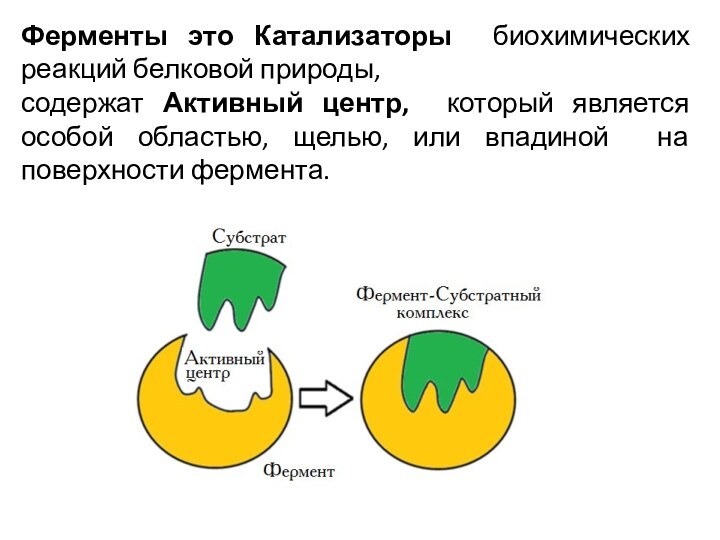
Ферменты это Катализаторы биохимических реакций белковой природы, содержат Активный центр, который является особой областью, щелью, или впадиной на поверхности фермента.


















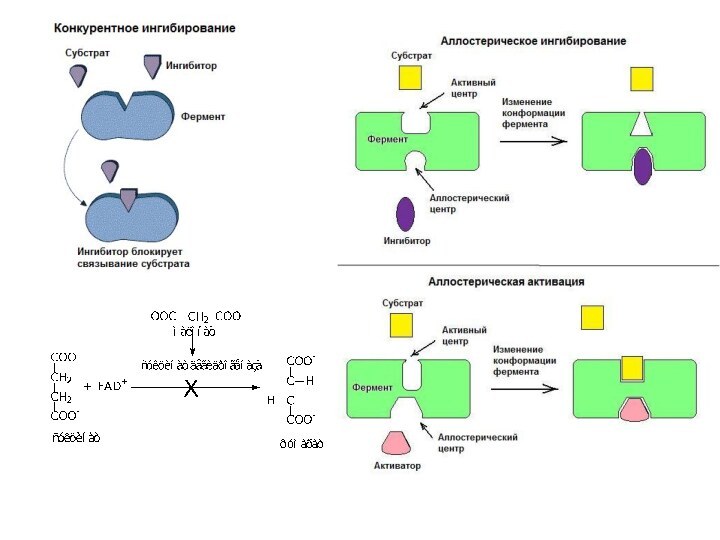
Слайд 4
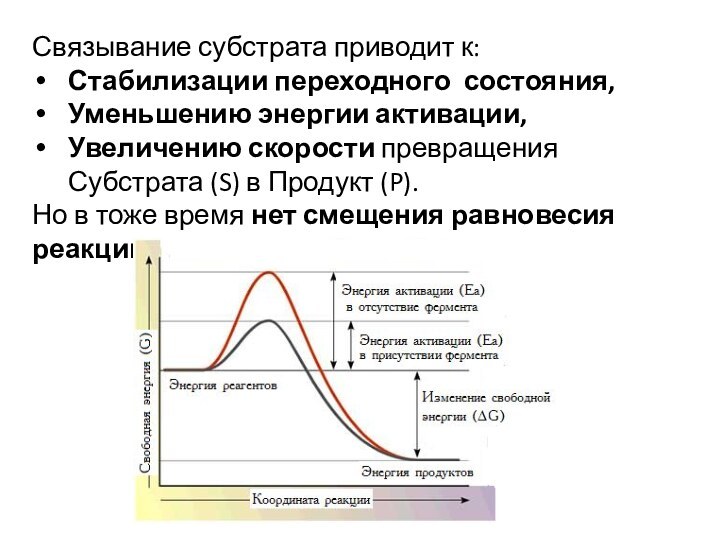
Связывание субстрата приводит к:
Стабилизации переходного состояния,
Уменьшению
энергии активации,
Увеличению скорости превращения Субстрата (S) в Продукт
(P).Но в тоже время нет смещения равновесия реакции.
Слайд 5
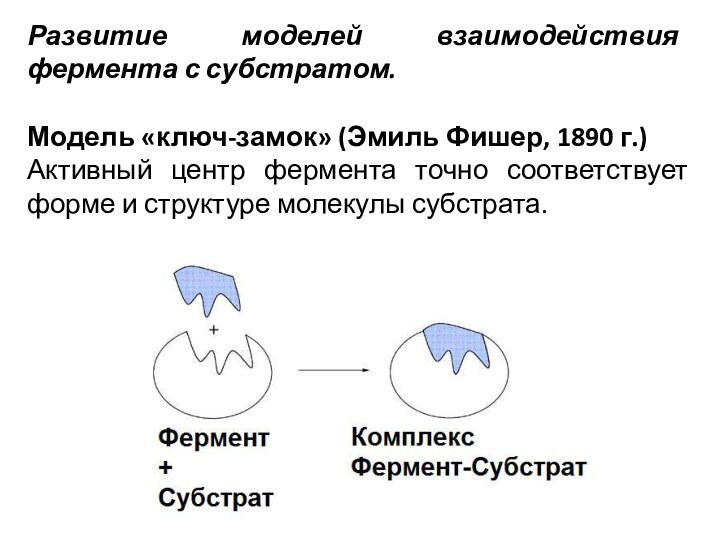
Развитие моделей взаимодействия фермента с субстратом.
Модель «ключ-замок» (Эмиль
Фишер, 1890 г.)
Активный центр фермента точно соответствует форме
и структуре молекулы субстрата.
Слайд 6
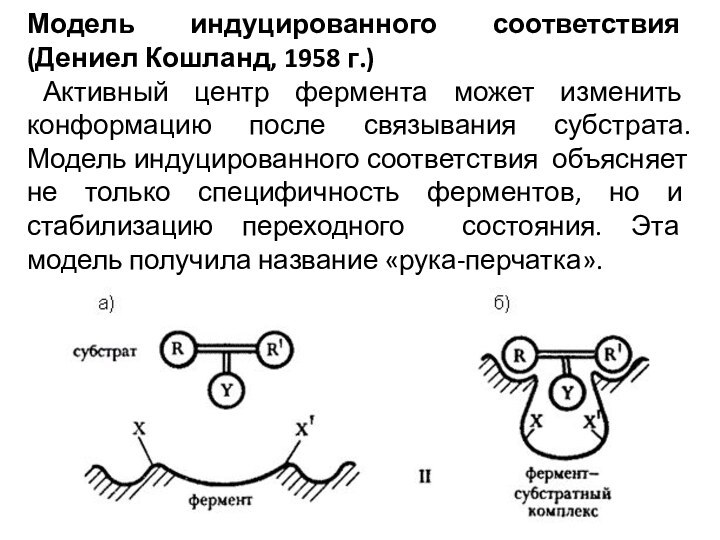
Модель индуцированного соответствия (Дениел Кошланд, 1958 г.)
Активный центр фермента может изменить конформацию после связывания субстрата.
Модель индуцированного соответствия объясняет не только специфичность ферментов, но и стабилизацию переходного состояния. Эта модель получила название «рука-перчатка».Слайд 7 Поскольку молекула фермента довольно гибкая, а субстрат имеет
жесткую структуру, энергетически менее предпочтительная, но каталитически активная конформация
активного центра образуется лишь в фермент-субстратном комплексе (схема б). На образование ее тратится часть свободной энергии сорбции.Рассмотрим индуцированное соответствие на примере фосфорилирующего белка - гексокиназы - его субстрату. Этот белок переносит фосфатную группу с АТФ на глюкозу. Но эта же фосфатная группа может быть перенесена и на воду; однако этого не происходит. В попытке ответить на вопрос, почему этого не происходит, Кошланд постулировал следующее.
1) До связывания с субстратом фермент находится в "открытой" форме (в которой он может захватить субстрат из воды, но не способен провести его фосфорилирование).
2) После связывания с субстратом домены поворачиваются, щель закрывается, вода из нее вытесняется, а все компоненты каталитического центра сходятся вместе: фермент - переходит в "закрытую", каталитически-активную форму, но вода вытеснена из активного центра и потому не конкурирует с субстратом за фосфорилирование.
3) После каталитического акта фермент снова открывается, и фосфорилированный субстрат уходит.
Впоследствии опыт полностью подтвердил эту гипотезу, но только для тех белков, которым нужно скрыть обрабатываемый субстрат от конкурирующей с ним воды. Для действия трипсина, например, этого не нужно, и в нем индуцированного соответствия субстрату не наблюдается: трипсин (а также - химотрипсин, эластаза, субтилизин и т.д.) не деформируется и опознает субстрат по простейшему принципу "ключ - замок".
Индуцированное соответствие достигается смещением либо крупных блоков, либо целых белковых доменов, - а не полной перестройкой укладки белковой цепи. А смещения эти происходят в основном путем мелких локальных деформаций. [Аналогия: мышцы сокращаются ("локальная деформация"), и пальцы ("домены") сжимаются в кулак.]
Слайд 8
Химическая природа и структура ферментов.
Большинство ферментов имеют
белковую природу, но ферментативной активностью обладает также иРНК (Томас
Р. Чек, Нобелевская премия 1989 г.).Доказательства белковой природы ферментов таковы:
а) потеря активности при кипячении; б) денатурация при УФ и рентгеновском облучении, действии ультразвука, кислот, щелочей, тяжелых металлов; в) гидролиз до аминокислот; г) осаждение под действием солей, (высаливание) без потери каталитических свойств; д) высокая молекулярная масса, амфотерные свойства, способность к электрофорезу; е) возможность искусственного синтеза из аминокислот (впервые так была синтезирована рибонуклеаза).
Слайд 10
Кофакторы:
Кофермент не связан ковалентно с ферментом, но присоединяется
во время реакции к молекуле фермента подобно субстрату, химически
изменяется и затем снова освобождается. Первоначальная форма кофермента регенерируется во второй, независимой реакции.Простетическая группа прочно связана с протеиновой молекулой фермента и во время реакции ее не покидает. Группа, связавшаяся с коферментом, далее переносится на следующий субстрат или другую молекулу кофермента.
Слайд 15
Классификация ферментов.
Различают два главных вида специфичности ферментов: субстратную
специфичность и специфичность действия.
Субстратная специфичность это способность фермента катализировать
превращения только одного определенного субстрата или же группы сходных по строению субстратов. Определяется структурой адсорбционного участка активного центра фермента. Специфичность, т.е. высокая избирательность действия ферментов, основана на комплементарности структуры субстрата и активного центра фермента и способности фермента катализировать превращения определенных стереоизомеров.
Слайд 16
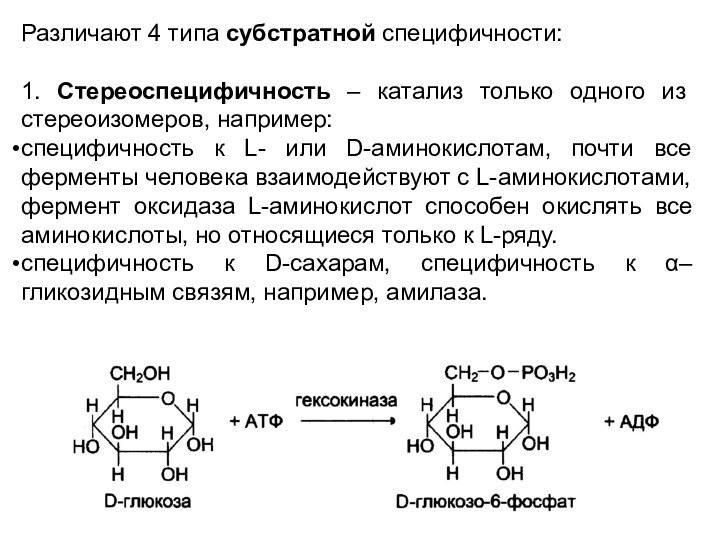
Различают 4 типа субстратной специфичности:
1. Стереоспецифичность – катализ
только одного из стереоизомеров, например:
специфичность к L- или D-аминокислотам,
почти все ферменты человека взаимодействуют с L-аминокислотами, фермент оксидаза L-аминокислот способен окислять все аминокислоты, но относящиеся только к L-ряду.специфичность к D-сахарам, специфичность к α–гликозидным связям, например, амилаза.
Слайд 17
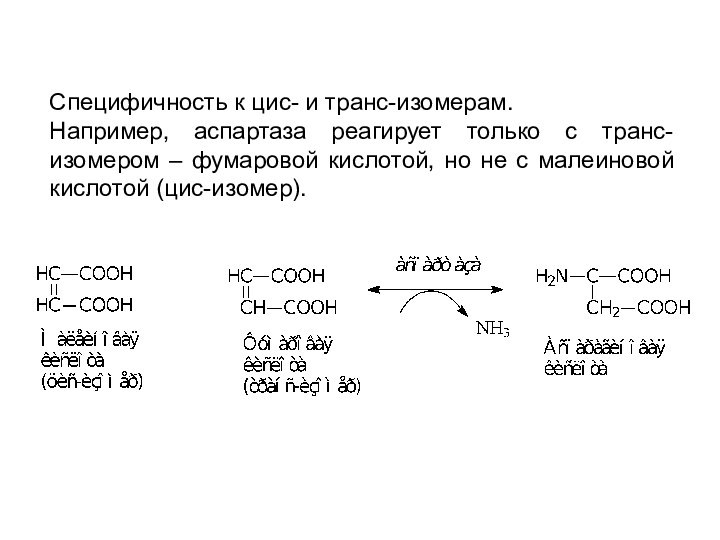
Специфичность к цис- и транс-изомерам.
Например, аспартаза реагирует
только с транс-изомером – фумаровой кислотой, но не с
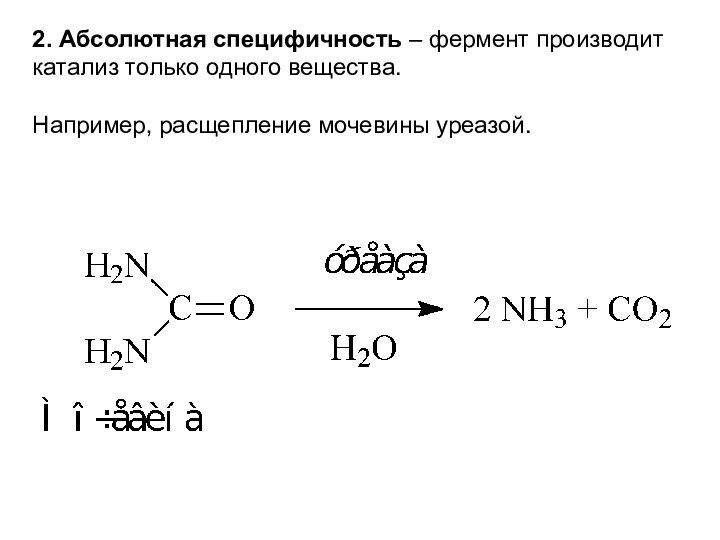
малеиновой кислотой (цис-изомер).Слайд 18 2. Абсолютная специфичность – фермент производит катализ только
одного вещества.
Например, расщепление мочевины уреазой.
Слайд 20 3. Групповая специфичность – катализ субстратов с общими
структурными особенностями, т.е. при наличии в молекуле определенной связи
или химической группы:например, наличие пептидной связи:
• бактериальный фермент субтилизин специфичен к пептидной связи независимо от строения образующих ее аминокислот,
• пепсин катализирует разрыв пептидной связи, образованной аминогруппами ароматических аминокислот, • тромбин расщепляет пептидную связь только между аргинином и глицином.
Или например, наличие ОН-группы:
алкогольдегидрогеназа окисляет до альдегидов одноатомные спирты (этанол, метанол, пропанол).
Слайд 21 4. Относительная групповая специфичность – превращение субстратов с
некоторыми общими признаками.
Например, цитохром Р450 окисляет только гидрофобные
вещества, которых насчитывается около 7000.Слайд 22 Специфичность действия - это способность фермента катализировать только
определенный тип химической реакции.
В соответствии со специфичностью действия
все ферменты делятся на 6 классов. Классы ферментов обозначаются латинскими цифрами. Название каждого класса ферментов соответствует этой цифре.
В основу принятой классификации положен тип катализируемой реакции, который является специфичным для действия любого фермента. Этот принцип логично использовать в качестве основы для классификации и номенклатуры ферментов.
Слайд 23
Номенклатура ферментов принята V Международным конгрессом биохимиков (1961).
1.
Систематическая номенклатура. Название фермента включает: химическое название субстрата; тип
химической реакции (в соответствии с международной классификацией ферментов); суффикс ≪-аза≫. Например: L-Лактат:НАД+ - оксидоредуктаза.2. Рабочая номенклатура. Название фермента образуется из химического названия субстрата с добавлением суффикса ≪-аза≫ либо из названия химического превращения субстрата с добавлением суффикса ≪-аза≫. Например: lipos (жир), фермент катализирующий его превращение называется ≪липаза≫. Лактатдегидрогеназа - это рабочее название фермента L-Лактат:НАД+-оксидоредуктазы.
3. Тривиальное (исторически сложившиеся) название. Не дает представления о субстрате или типе химического превращения. Пример - пепсин, тромбин, трипсин, ренин.
Согласно систематической номенклатуре каждому ферменту был дан код (шифр), состоящий из 4х цифр, которые обозначают: 1-класс, 2-подкласс, 3-подподкласс, 4-порядковый номер фермента в подподклассе. Например: 1.1.1.27 - лактатдегидрогеназа, которая относится к I классу – оксидоредуктазам.
Слайд 25
Классы ферментов
Класс 1. Оксидоредуктазы катализируют окислительно-восстановительные реакции, осуществляют
перенос 2H или О.
Класс 2. Трансферазы переносят ту
или иную функциональную группу, отличную от 2H или О , от одного субстрата на другой. Класс 3. Гидролазы также участвуют в переносе групп, однако акцептором здесь всегда является молекула воды.
Класс 4. Лиазы катализируют расщепление или образование химических соединений, при этом образуются или исчезают двойные связи.
Класс 5. Изомеразы перемещают группы в пределах молекулы без изменение общей формулы субстрата.
Класс 6. Лигазы катализируют энергозависимые реакции присоединения и поэтому их действие сопряжено с гидролизом нуклеозидтрифосфата (чаще всего АТФ).
Слайд 26 На основании разработанной системы, которая служит основой как
для классификации, так и для нумерации (индексации) ферментов, Международная
комиссия подготовила также Классификацию ферментов (КФ) с включением списка ферментов, первоначально состоявшего к 1961 г. примерно из 900 ферментов. В списке ферментов (см. Номенклатуру ферментов, 1978) насчитывалось уже 2142 индивидуальных фермента, к декабрю 1995 г. их идентифицировано более 3500. В списке для каждого фермента, помимо кодового номера (шифра), приводятся систематическое (рациональное) название, рекомендуемое (рабочее) название, химическая реакция, которую катализирует данный фермент, а также примечания о специфичности действия. Номер каждому ферменту рекомендуется присваивать по четырехзначному коду.Слайд 27 Код каждого фермента содержит четыре цифры, разделенные точками,
и составляется по определенному принципу.
Первая цифра указывает номер
одного из шести главных классов ферментов. Вторая цифра означает подкласс, характеризующий основные виды субстратов, участвующих в данном типе химических превращений. Например, у трансфераз вторая цифра указывает на природу той группы, которая подвергается переносу, у гидролаз – на тип гидролизуемой связи и т.д.
Слайд 28 Эти подклассы в свою очередь делятся на более
частные подгруппы (подпод-классы), отличающиеся природой химических соединений доноров или
акцепторов, участвующих в данной подгруппе реакций. Номер (цифра) подподкласса ставят на 3-е место в шифре фермента.У гидролаз, например, эта цифра уточняет тип гидролизуемой связи, а у лиаз – тип отщепляемой группы и т.д.
Первые 3 цифры кода точно определяют тип фермента. Наконец, все ферменты, относящиеся к данному подподклассу, получают порядковый номер в алфавитном порядке, который ставят на 4-е место в шифре.
http://www.brenda-enzymes.org/index.php
http://www.genome.jp/kegg/kegg2.html
Слайд 29
Клеточная организация ферментативной активности
Ферменты располагаются в субклеточных структурах
(органеллах) соответственно их функциям. Например:
а) в ядре содержатся
ферменты преобразования нуклеиновых кислот;б) во внутренней мембране митохондрий – ферменты дыхательной цепи;
в) в лизосомах – гидролазы; г) в цитоплазме – ферменты гликолиза, синтеза жирных кислот; д) в матриксе митохондрий – ферменты ЦТК, окислительного декарбоксилирования α-кетокислот, β–окисления жирных кислот; е) плазматическая мембрана содержит ферменты транслоказы, которые переносят через мембрану ионы Nа+, К+, глюкозу, аминокислоты и т.д.
Слайд 30
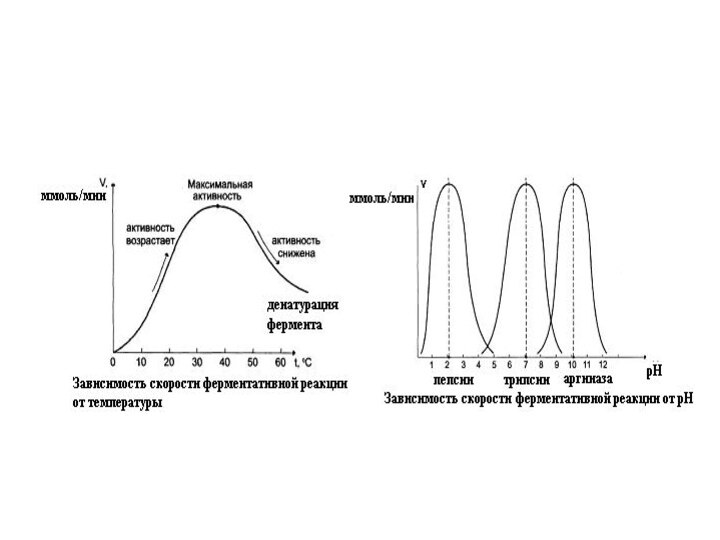
Зависимость скорости ферментативной реакции от температуры.
Ферментативные реакции,
как и все химические реакции, ускоряются при повышении температуры
(в 2-4 раза на каждые 10оС). Однако скорость ферментативной реакции имеет свой температурный оптимум, превышение которого приводит к понижению активности ферментов из-за тепловой денатурации их молекул.Для большинства ферментативных реакций температурный оптимум - 38-40оС, а при 50-60оС и выше скорость ферментативных реакций сильно уменьшается из-за разрушения молекул фермента (искл. - миокиназа не инактивируется даже при 100 оС).
Слайд 31
Зависимость активности ферментов от температуры называется термолабильностью.
Ферменты
лучше сохраняются при низких температурах – их активность снижается,
но денатурации не происходит.Это свойство используется в медицине для производства препаратов ферментов.
При некоторых операциях необходимо снизить скорость обмена веществ. Тогда используют охлаждение органов (например, при пересадке почек, сердца и др. органов).
Слайд 32
Зависимость ферментативной активности от рН среды.
Каждый фермент имеет
свой рН–оптимум - значение рН, при котором его активность
максимальна.Фермент, как и любой белок, имеет в своей структуре ионогенные группы (например, карбоксильные группы или аминогруппы в боковых цепях), а от концентрация ионов водорода зависит их диссоциация и соотношение между положительно и отрицательно заряженными группами.
Соотношение между этими группами определяет и пространственное строение молекулы фермента (его конформацию), а следовательно, и его активность.
Большинство ферментов наиболее активны при рН=6-8. Исключения - пепсин (рНопт=1,5-2), аргиназа (рНопт=10-11).
Слайд 34
Классы ферментов
Класс 1. Оксидоредуктазы катализируют окислительно-восстановительные реакции, осуществляют
перенос 2H или О.
Класс 2. Трансферазы переносят ту
или иную функциональную группу, отличную от 2H или О , от одного субстрата на другой. Класс 3. Гидролазы также участвуют в переносе групп, однако акцептором здесь всегда является молекула воды.
Класс 4. Лиазы катализируют расщепление или образование химических соединений, при этом образуются или исчезают двойные связи.
Класс 5. Изомеразы перемещают группы в пределах молекулы без изменение общей формулы субстрата.
Класс 6. Лигазы катализируют энергозависимые реакции присоединения и поэтому их действие сопряжено с гидролизом нуклеозидтрифосфата (чаще всего АТФ).





























