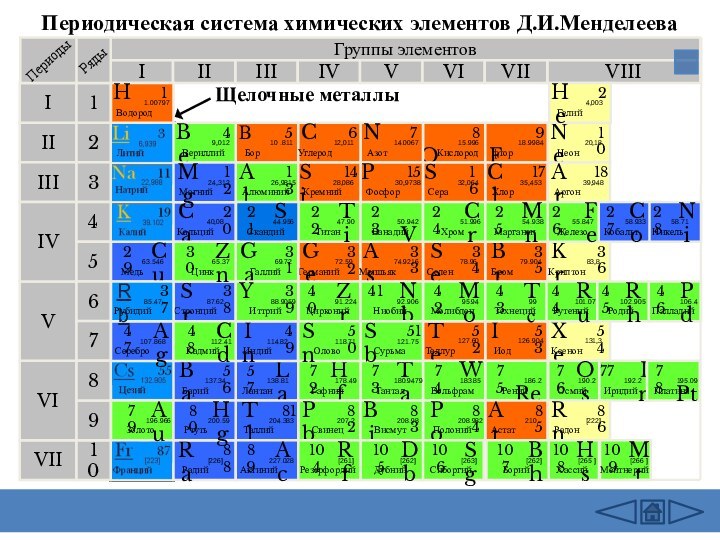
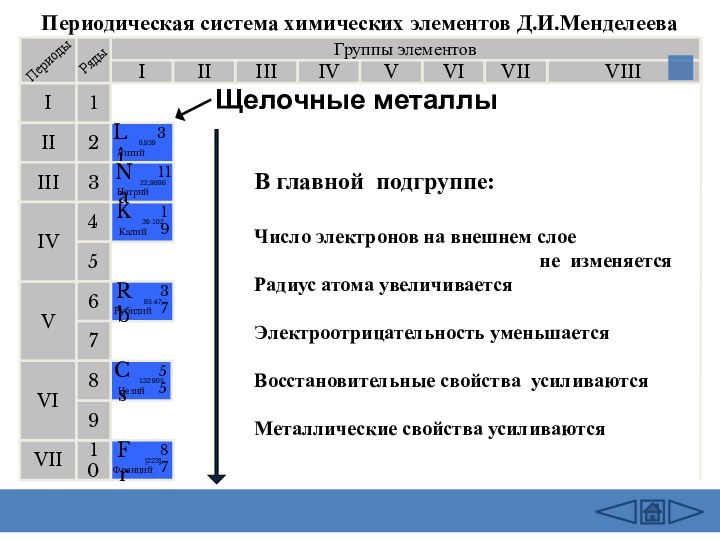
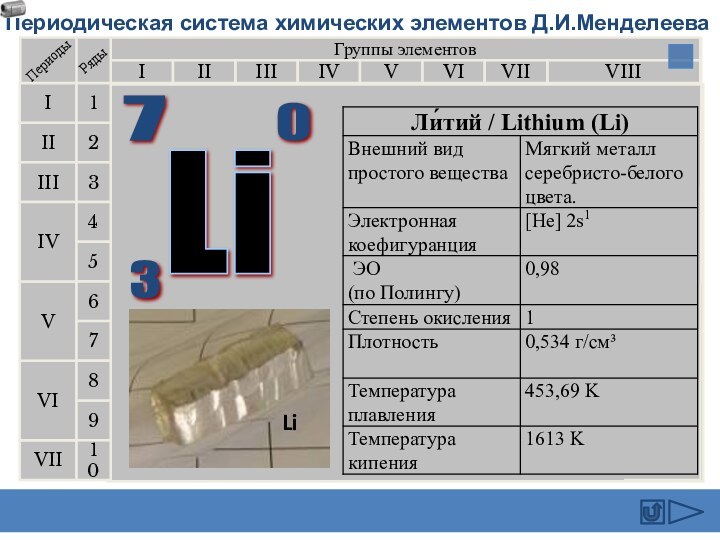
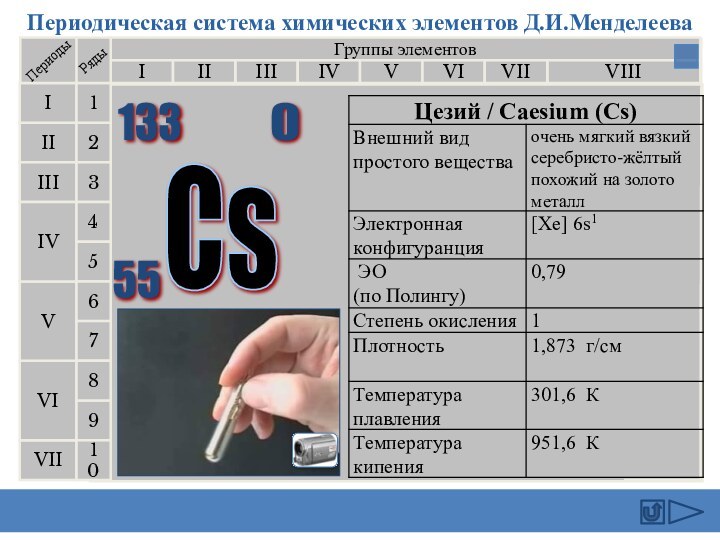
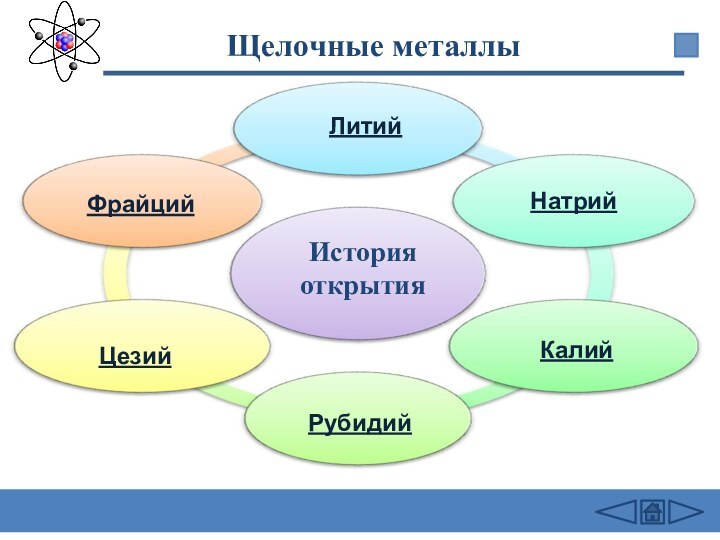
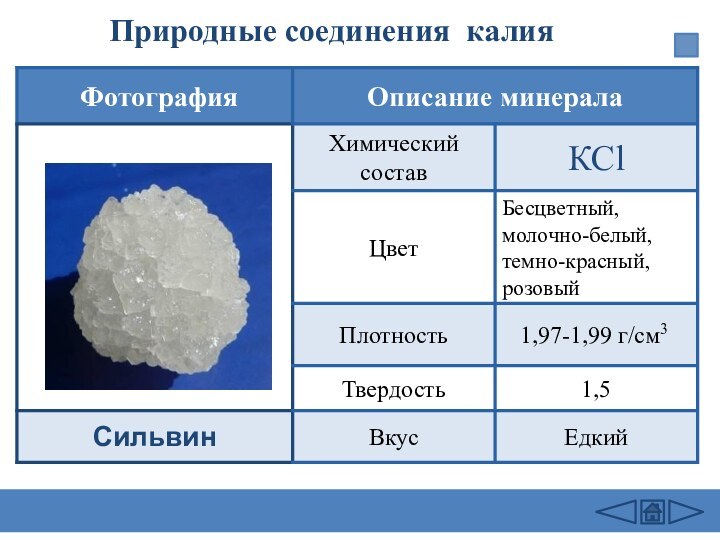
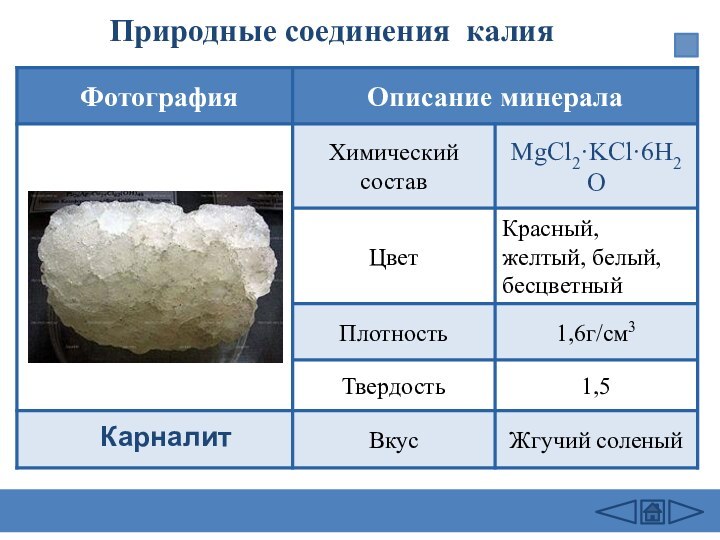
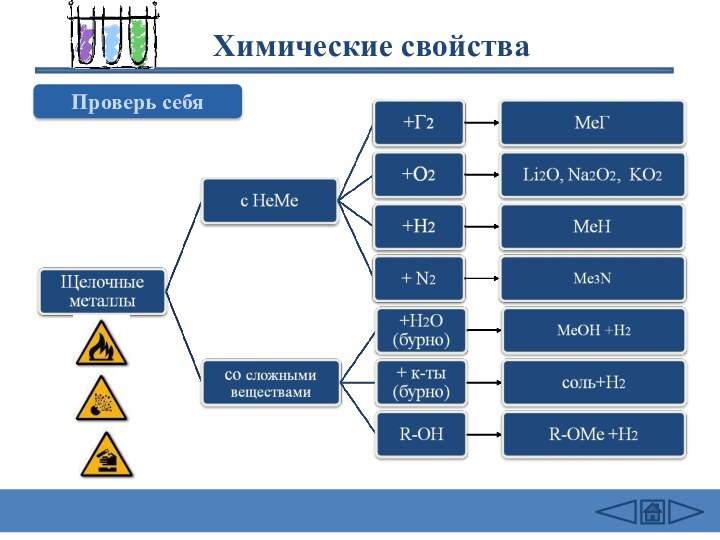
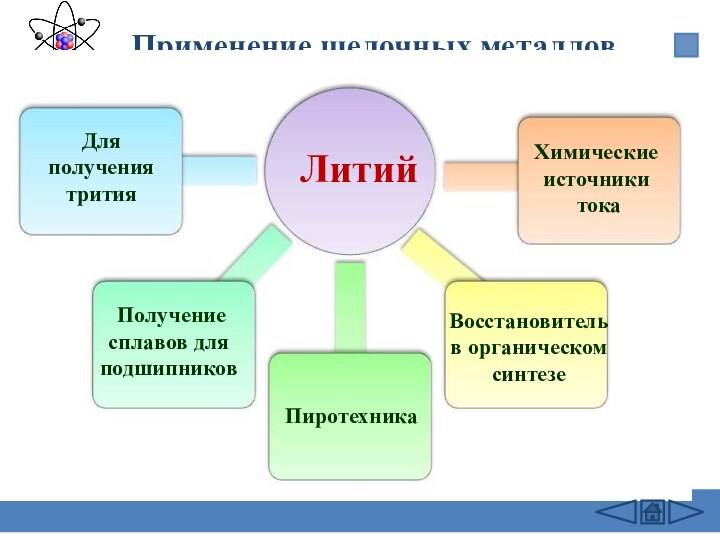
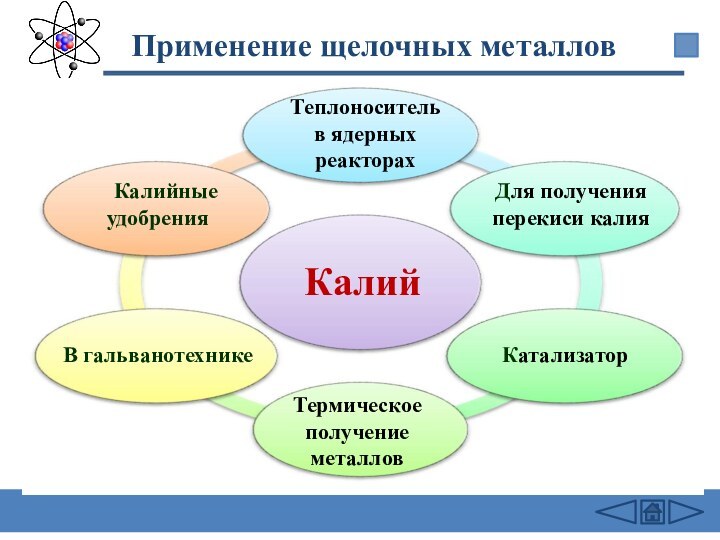
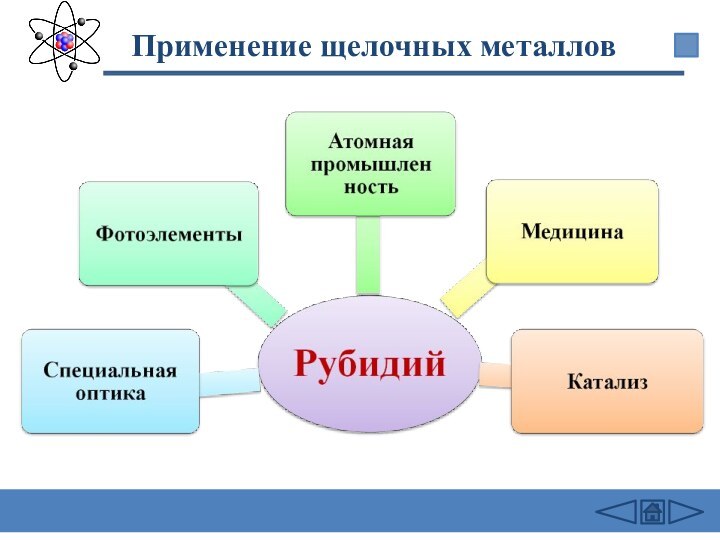
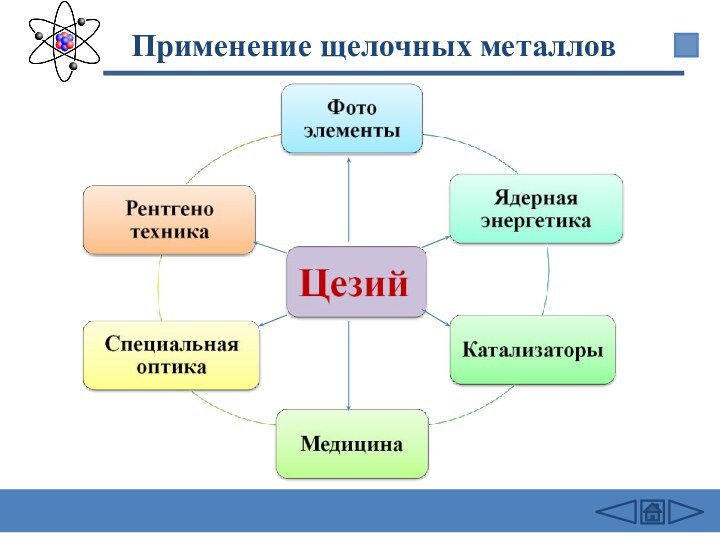
подгруппе:
Число электронов на внешнем слое
не изменяетсяРадиус атома увеличивается
Электроотрицательность уменьшается
Восстановительные свойства усиливаются
Металлические свойства усиливаются