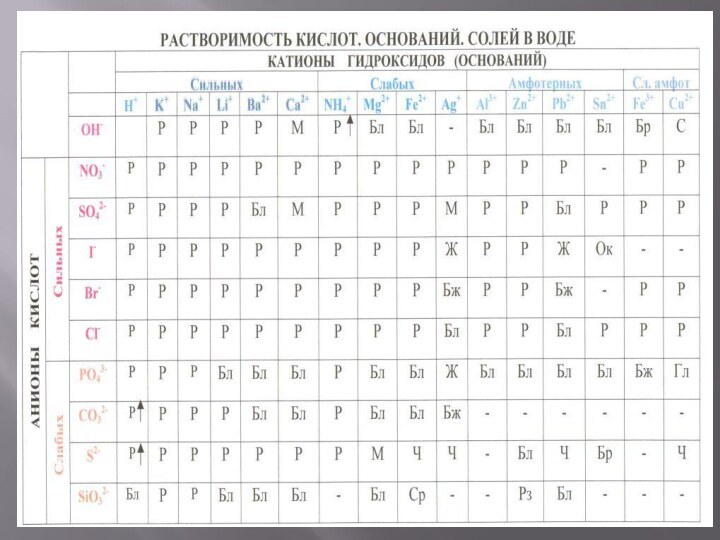
Слайд 3
ОКРАСКА ЛАКМУСОВОЙ БУМАГИ
В РАЗЛИЧНЫХ СРЕДАХ
Слайд 4
Тема: Гидролиз солей
Цель: изучить сущность гидролиза солей в
водных
растворах.
Задачи :
сформулировать
определение понятия «гидролиз»
научиться объяснять химические процессы, протекающие в водных растворах солей
записывать уравнения реакций гидролиза
предсказывать и объяснять изменение кислотности среды и образование кислых и основных солей в этом процессе
познакомиться с ролью гидролиза солей в природе, хозяйственной деятельности и повседневной жизни человека.
Слайд 5
«ГИДРОЛИЗ» -
от греческого
«гидро» - вода
«лизис» -
разложение
Слайд 6
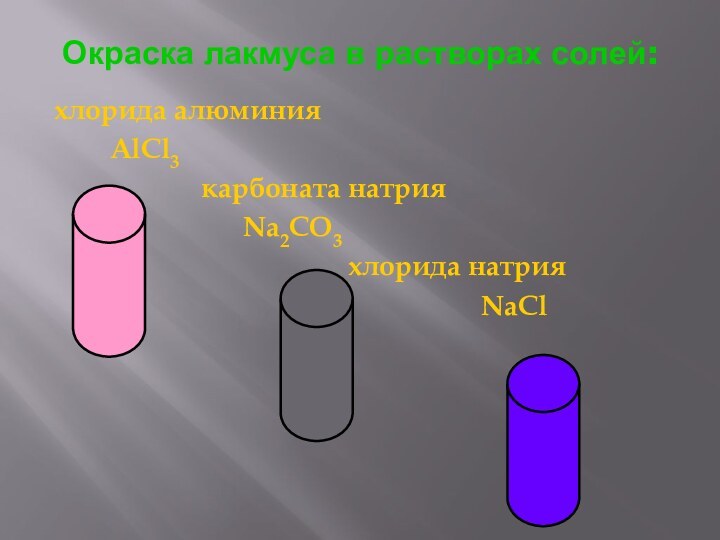
Окраска лакмуса в растворах солей:
хлорида алюминия
AlCl3
карбоната натрия
Na2CO3
хлорида натрия
NaCl
Слайд 7
ОКРАСКА ЛАКМУСА
В РАСТВОРАХ СОЛЕЙ
Слайд 8
Механизм гидролиза хлорида алюминия
H2O H+ + OH-
AlCl3
Al3+ + 3Cl-
Al3+ +3Cl-
+HOH Al OH2- +H+ + 3Cl-
Слайд 9
Схема гидролиза хлорида алюминия
AlCl3
Al(OH)3 HCl
слабое основание сильная кислота
[OH]- < [H]+
(что сильней того и больше!)
К и с л о т н а я среда
Слайд 10
АЛГОРИТМ
СОСТАВЛЕНИЯ УРАВНЕНИЙ РЕАКЦИЙ ГИДРОЛИЗА СОЛЕЙ
Определить состав соли,
то есть указать, каким по силе основанием и какой
по силе кислотой образована данная соль.
Взять ион слабого электролита и написать уравнение взаимодействия его с составными частями одной молекулы воды; в результате получить краткое ионное уравнение гидролиза.
Написать на основании краткого ионного уравнения молекулярное уравнение.
Исходные вещества известны – соль и вода. Продукты гидролиза составить, связывая образовавшиеся ионы с теми ионами соли, которые не участвуют в реакции гидролиза.
Слайд 11
Al3+ + HOH AlOH2+ + H+
AlCl3 +
H2O AlOHCl2 + HCl
Одним из продуктов данной обменной реакции
является основная соль.
Сформулируем вывод:
Раствор соли, образованной
________________, имеет _____________реакцию, так как в растворе избыток___________________.
Слайд 12
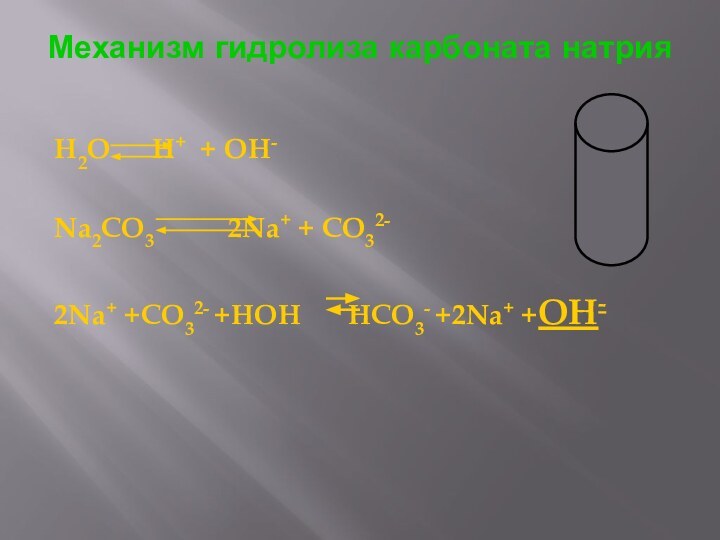
Механизм гидролиза карбоната натрия
H2O H+ + OH-
Na2CO3
2Na+ + CO32-
2Na+
+CO32- +HOH HCO3- +2Na+ +OH-
Слайд 13
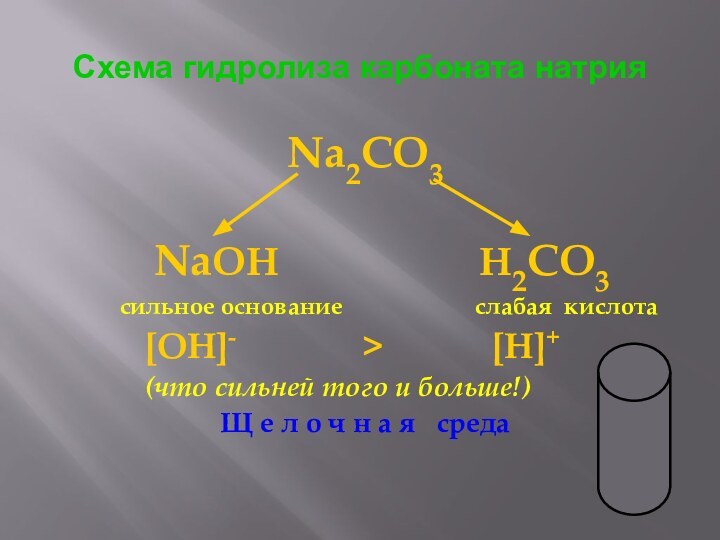
Схема гидролиза карбоната натрия
Na2CO3
NaOH
H2CO3
сильное основание слабая кислота
[OH]- > [H]+
(что сильней того и больше!)
Щ е л о ч н а я среда
Слайд 14
АЛГОРИТМ
СОСТАВЛЕНИЯ УРАВНЕНИЙ РЕАКЦИЙ ГИДРОЛИЗА СОЛЕЙ
Определить состав соли,
то есть указать, каким по силе основанием и какой
по силе кислотой образована данная соль.
Взять ион слабого электролита и написать уравнение взаимодействия его с составными частями одной молекулы воды; в результате получить краткое ионное уравнение гидролиза.
Написать на основании краткого ионного уравнения молекулярное уравнение.
Исходные вещества известны – соль и вода. Продукты гидролиза составить, связывая образовавшиеся ионы с теми ионами соли, которые не участвуют в реакции гидролиза.
Слайд 15
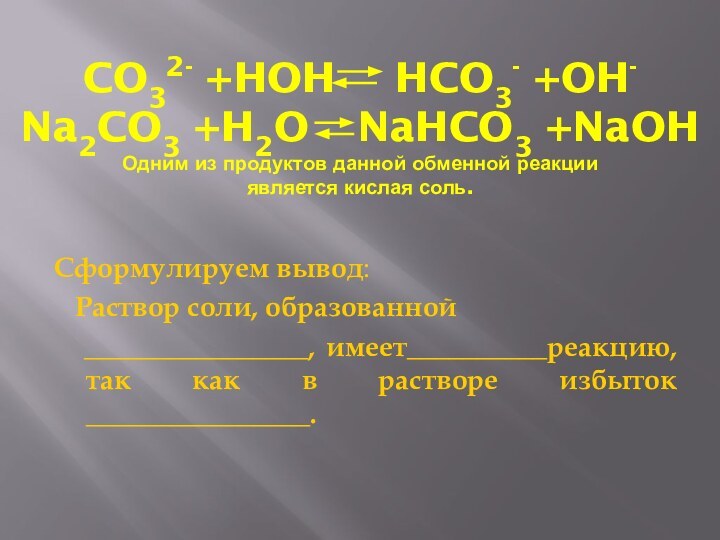
CO32- +HOH HCO3- +OH-
Na2CO3 +H2O NaHCO3
+NaOH
Одним из продуктов данной обменной реакции
является кислая соль.
Сформулируем
вывод:
Раствор соли, образованной
________________, имеет__________реакцию, так как в растворе избыток ________________.
Слайд 16
Механизм гидролиза хлорида натрия
H2O H+ + OH-
NaСl
Na+ + Cl-
Na+ +Cl- +HOH
Cl- + Na+ + HOH
Данная соль гидролизу не подвергается.
Слайд 17
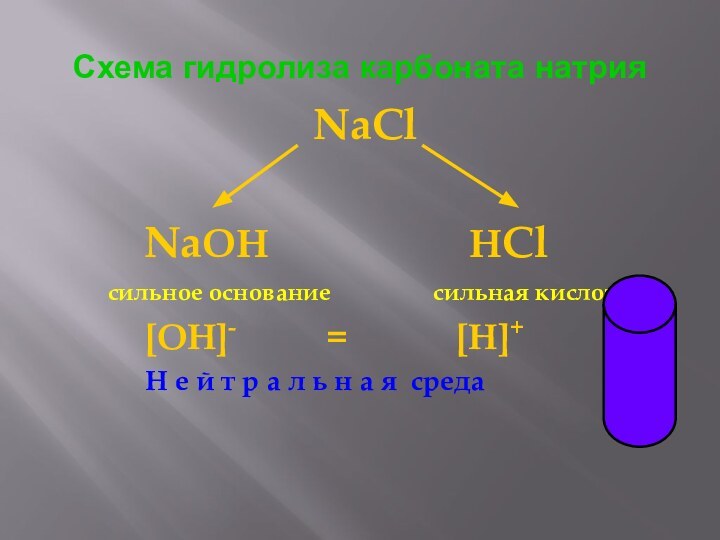
Схема гидролиза карбоната натрия
NaCl
NaOH
HCl
сильное основание сильная кислота
[OH]- = [H]+
Н е й т р а л ь н а я среда
Слайд 18
NaCl + Н2О =
Сформулируем вывод:
Раствор соли,
образованной__________________, имеет________________________реакцию, так как в растворе__________________________________.
Слайд 19
Сформулируем
определение понятия «гидролиз»:
К какому типу мы отнесем
данные реакции?
Какие вещества в них участвуют?
В чем заключается сущность
гидролиза? Какие продукты данных взаимодействий с точки зрения теории электролитической диссоциации мы получили
реакция обмена между некоторыми солями и водой приводящая к
образованию слабого электролита.
Слайд 22
Самостоятельно заполните таблицу
Слайд 23
Самостоятельно заполните таблицу
Слайд 24
Роль гидролиза в природе
Преобразование земной коры
Обеспечение слабощелочной
среды морской воды
Слайд 25
Роль гидролиза в народном хозяйстве
Порча производственного оборудования
Выработка из
непищевого сырья ценных продуктов (бумага, мыло, спирт, глюкоза, белковые
дрожжи)
Очистка промышленных стоков и питьевой воды
(сульфат алюминия + вода гидроксид алюминия)
Подготовка тканей к окрашиванию
Известкование почв основано на гидролизе
Слайд 26
Роль гидролиза
в повседневной жизни человека
Стирка
Мытье посуды
Умывание
с мылом
Процессы пищеварения