- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Количество вещества, моль
Содержание
- 2. Ведь он принесёт тебе ЗНАНИЯ!
- 3. Тема урока:Количественные измерения в химии.Количество вещества. Моль.
- 4. Цель урока:Научиться рассчитывать по формулам массу вещества, количество вещества
- 5. Задачи урока:Образовательная: сформировать понятие о количестве вещества,
- 6. Какие физические величины можно использовать для
- 7. кгЛЛМ
- 8. =158,988 л 1 карат = 0,2 г 1 баррель нефти
- 9. Порции
- 10. ?Можно ли найти число частиц в порции вещества?
- 11. Моль от французского слова «moles»- множество1 Моль
- 12. Число всех песчинок в пустыне Сахара = 3 моль!!!
- 14. Число частиц в одном моль веществаназывается числом Авогадро (NА)NА = 6,02 ∙1023 1/моль
- 15. Н2ОЧисло Авогадро больше числа всех капель воды на Земле
- 16. Обозначение: ν (ню), или nЕдиница измерения: мольКоличество вещества
- 18. 1 моль вещества – 6,02∙1023частицСколько частиц содержат
- 19. В общем виде:N = ν ∙ NAN – число частицν – количество веществаNA – число Авогадро
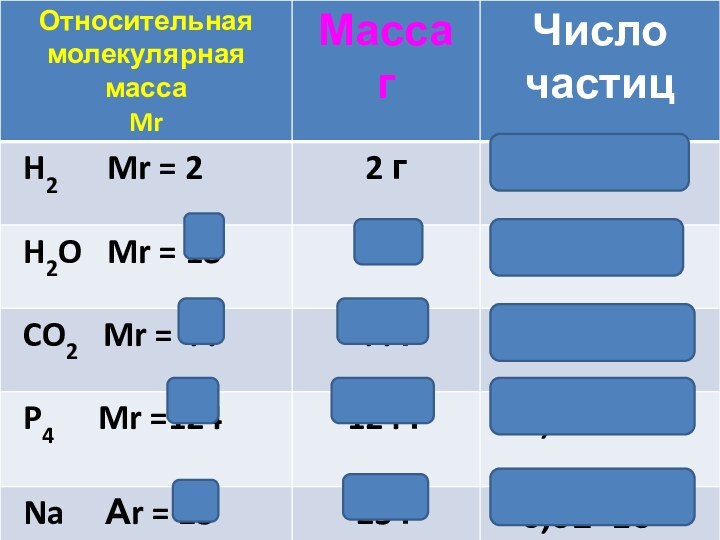
- 20. [ Mr = M ]Mr(H2O)= 18M(H2O)= 18
- 21. Можно ли
- 22. ν = m/Mm = ν ∙ M
- 23. Что тяжелее: 1
- 24. Задача. Найти массу 3 моль атомов серыДаноν
- 25. Равные массы, но разные объемы, потому что ....m = V∙ ρ
- 26. 1 моль любого газа (н.у.) занимает объем 22,4 лVM = 22,4л/моль
- 27. ν = V/VmV = ν ∙ Vm
- 28. m= ν ∙ MV = ν ∙ VmN = ν ∙ NAВыучить!!!
- 29. Сколько ложек сахарного песка вы кладете в
- 30. Цель достигнута? Спасибо за урок!
- 31. Скачать презентацию
- 32. Похожие презентации
Ведь он принесёт тебе ЗНАНИЯ!


















![Количество вещества, моль [ Mr = M ]Mr(H2O)= 18M(H2O)= 18 г/мольМолярная масса (М) – это](/img/tmb/12/1138042/5c26ce6fbf01309c6f70d96e1c48317b-720x.jpg)











Слайд 5
Задачи урока:
Образовательная: сформировать понятие о количестве вещества, единицах
его измерения, о взаимосвязи физико-химических величин (массы, количества вещества
и числа молекул).Развивающая: развить умение решения задач с использованием формул.
Воспитательная: прививать нормы социальной жизни, воспитывать умение работать в группе.
Слайд 6 Какие физические величины можно использовать для определения меры
веществ? В каких единицах измеряются эти физические
величины?
Слайд 11
Моль
от французского слова «moles»-
множество
1 Моль –
это количество вещества,
в котором содержится
6,02 ∙1023 частиц
Слайд 18
1 моль вещества – 6,02∙1023частиц
Сколько частиц содержат
3
моль вещества?
Сколько частиц содержат
0,5 моль вещества?
3 ∙ 6,02∙1023
= 18,06∙10230,5 ∙ 6,02∙1023 = 3,01∙1023
Слайд 20
[ Mr = M ]
Mr(H2O)= 18
M(H2O)= 18 г/моль
Молярная
масса (М) – это суммарная масса всех частиц, входящих
в 1 моль вещества.
Слайд 23
Что тяжелее:
1 моль
атомов кислорода
или 1
моль атомов фосфора? Почему?
M(O) = 16 г/моль
M(P) = 31 г/моль
Слайд 24
Задача.
Найти массу 3 моль атомов серы
Дано
ν (S)
= 3моль
M(S) = 32 г/моль
Найти m(S)
Решение
m = ν ∙
Mm = 3 ∙ 32 = 96 (г)
Ответ: m(S) = 96 г
Слайд 29
Сколько ложек сахарного песка
вы кладете в
чашку чая?
Рассчитайте:
какое количество сахарозы
вы выпиваете
с чаем;2) сколько молекул сахарозы (C12H22O11)
содержится в этом количестве, если
в 1 чайной ложке
примерно 5 г сахарозы.