- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Химия.Кислород
Содержание
- 2. ОТКРЫТИЕ КИСЛОРОДА
- 3. Антуан Лоран ЛАВУАЗЬЕ
- 4. Кислород – самый распространенный элемент на
- 5. Физические свойстваАгрегатное состояние - газ при обычных
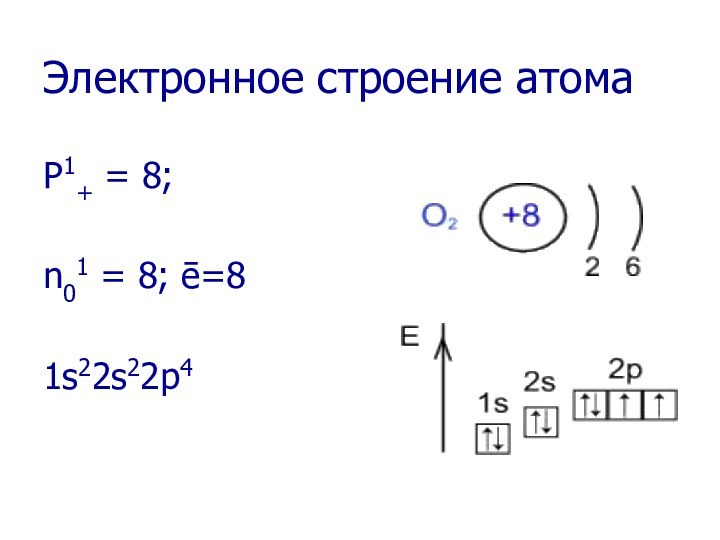
- 6. Электронное строение атомаP1+ = 8;n01 = 8; ē=81s22s22p4
- 7. Химические свойства Кислород — очень сильный
- 8. Реакции с металлами В результате реакции
- 9. Реакции с неметаллами Образуется оксид неметалла. Горение
- 10. Другие примеры реакций с неметалламиГорение серы в
- 11. Реакции с некоторыми сложными веществами В
- 12. Химическое взаимодействие вещества с кислородом называется
- 13. Получение кислорода (лабораторные способы)разложение воды электрическим током
- 14. Получение кислорода (промышленный способ) В промышленности
- 15. Применение кислорода в строительстве и машиностроении -
- 16. Применение кислорода в медицине -
- 17. Применение кислородав химической промышленности - при производстве
- 18. Применение кислорода в военной технике - в
- 19. ОЗОН Аллотропная модификация кислородаОзон О3 - газ
- 20. Озон - очень сильный окислитель, поэтому его
- 21. Скачать презентацию
- 22. Похожие презентации
ОТКРЫТИЕ КИСЛОРОДА К. Шееле Дж. Пристли Эти два великих химика независимо друг от друга во второй половине XVIII века открыли кислород.



















Слайд 2
ОТКРЫТИЕ КИСЛОРОДА
К.
Шееле Дж. Пристли
Эти два великих химика независимо друг от друга во второй половине XVIII века открыли кислород.
Слайд 3
Антуан Лоран ЛАВУАЗЬЕ
(1743-1794)
Исследовал кислород и создал кислородную теорию
горения, пришедшую на смену флогистонной теории.
Слайд 4
Кислород –
самый распространенный элемент на Земле
В воздухе 21% (по объему),
в земной коре 49% (по массе),в гидросфере 89% (по массе),
в живых организмах до 65% массы.
Слайд 5
Физические свойства
Агрегатное состояние - газ при обычных условиях.
При очень низких температурах (-183°С) переходит в жидкое агрегатное
состояние (голубая жидкость), а при еще более низких температурах (-219°С) становится твёрдым (синие снежные кристаллы).Цвет – бесцветный.
Запах - без запаха.
Растворимость в воде - плохо растворяется.
Тяжелее воздуха ( М воздуха = 29 г/моль, а МО2 = 32 г/моль.
Слайд 7
Химические свойства
Кислород — очень сильный окислитель!
Он окисляет многие вещества уже при комнатной температуре (медленное
окисление) и тем более при нагревании или при горении вещества (быстрое окисление).В реакциях со всеми элементами (кроме фтора) кислород всегда ОКИСЛИТЕЛЬ.
Слайд 8
Реакции с металлами
В результате реакции образуется
оксид этого металла. Например, алюминий окисляется кислородом согласно уравнению:
t°
4Al + 3O2 → 2Al2O3Другой пример. При опускании раскалённой железной проволоки в склянку с кислородом, проволока сгорает, разбрызгивая в стороны снопы искр - раскалённых частичек железной окалины Fe3O4:
t° 3Fe + 2O2 → Fe3O4
Слайд 9
Реакции с неметаллами
Образуется оксид неметалла.
Горение фосфора
с образованием оксида фосфора (V):
t°
4Р + 5О2 → 2Р2О5
Слайд 10
Другие примеры реакций с неметаллами
Горение серы в кислороде
с образованием сернистого газа SO2:
t°
S
+ O2 → SO2Горение угля в кислороде с образованием углекислого газа:
t° С + О2 → СО2
Слайд 11
Реакции с некоторыми сложными веществами
В этом
случае образуются оксиды элементов, из которых состоит молекула сложного
вещества.Например, при обжиге сульфида меди (II)
t° 2CuS + 3O2 → 2CuO + 2SO2
образуются два оксида — оксид меди (II) и оксид серы (IV).
При обжиге сульфидов образуется всегда оксид серы, валентность серы в котором равна IV.
Другой пример — горение метана СН4. Так как эта молекула состоит из атомов элементов углерода С и водорода Н, значит, образуется два оксида — оксид углерода (IV) СО2 и оксид водорода, то есть вода - Н2О:
t° СН4 + 2О2 → СО2 + 2Н2О
Слайд 12
Химическое взаимодействие вещества с кислородом называется реакцией окисления.
Реакции
окисления, сопровождающиеся выделением теплоты и света, называются реакциями горения.
Реакции горения веществ — это примеры быстрого окисления, а вот гниение, ржавление и т.п. — это примеры медленного окисления веществ кислородом
Слайд 13
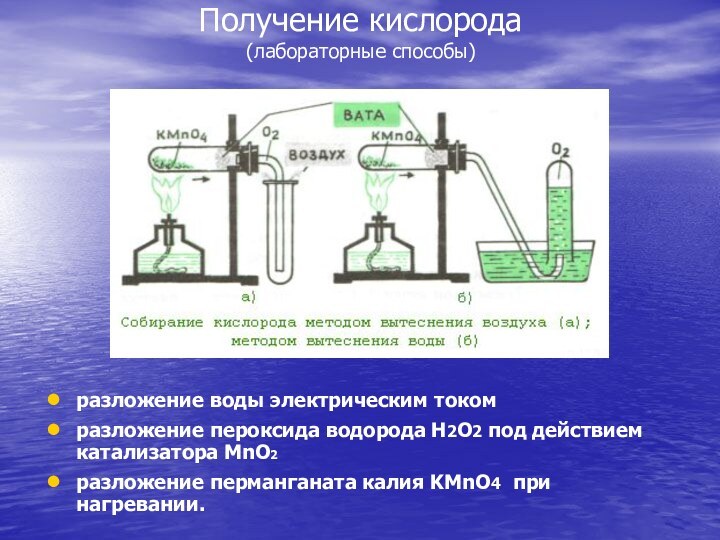
Получение кислорода
(лабораторные способы)
разложение воды электрическим током
разложение пероксида
водорода Н2О2 под действием катализатора MnO2
разложение перманганата калия
KMnO4 при нагревании.
Слайд 14
Получение кислорода
(промышленный способ)
В промышленности для получения
чистого кислорода используют перегонку жидкого воздуха, основанную на разных
температурах кипения компонентов воздуха. Воздух охлаждают примерно до -200°С и затем медленно нагревают. При достижении температуры -183°С из жидкого воздуха улетучивается кислород, остальные компоненты сжиженного воздуха при этой температуре остаются в жидком агрегатном состоянии.
Слайд 15
Применение кислорода
в строительстве и машиностроении
- для кислородно
- ацетиленовой газосварки и газорезки металлов
- для напыления и
наплавки металловв нефтедобыче
- при закачке в пласт для повышения энергии вытеснения
в металлургии и горнодобывающей промышленности
- при конвективном производстве стали, кислородном дутье в доменных печах, извлечение золота и руд, производстве ферросплавов, выплавке никеля, цинка свинца, циркония и др. цветных металлов
- при прямом восстановлении железа
- при огневой зачистке в литейном производстве
- при огневом бурении твердых пород
Слайд 16
Применение кислорода
в медицине
- в
оксибарокамерах
- при заправке кислородных масок, подушек и т.д.
- в палатах со специальным микроклиматом
- для изготовления кислородных коктейлей
- при выращивании микроорганизмов
в экологии
- при очистке питьевой воды
- при вторичной переработке металлов
- при продувке сточных вод кислородом
- при обезвреживании химически активных отходов в очистных установках в мусоросжигательных печах
Слайд 17
Применение кислорода
в химической промышленности
- при производстве ацетилена,
целлюлозы, метилового спирта, аммиака, азотной и серной кислоты
-
при каталитической конверсии природного газа (при производстве синтетического аммиака) - при высокотемпературной конверсии метана
в энергетике
- при газификации твердого топлива
- для обогащения воздуха для бытовых и промышленных котлов
- для сжатия водно-угольной смеси
Слайд 18
Применение кислорода
в военной технике
- в барокамерах
-
для работы дизельных двигателей под водой
- в качестве
окислителя топлива для ракетных двигателейв сельском хозяйстве
- для обогащения кислородом водной среды в рыболовстве
- при изготовлении кислородных коктейлей
- для прибавки животных в весе
Слайд 19
ОЗОН
Аллотропная модификация кислорода
Озон О3 - газ голубого цвета
с резким запахом. Каждый, кто обратил внимание на то,
как пахнет воздух после грозы или вблизи источника электрического разряда, знает запах этого газа очень хорошо.В природе озон образуется под действием ультрафиолетового излучения Солнца, а также получается при электрических разрядах в атмосфере:
Слайд 20 Озон - очень сильный окислитель, поэтому его используют
при обеззараживании питьевой воды. При контакте с большинством способных
окисляться веществ происходит взрыв.Озон образуется в атмосфере Земли на высоте 25 км под действием солнечной радиации, он поглощает опасное излучение Солнца.
Однако в озоновом "зонтике" Земли, толщиной всего около 30 метров, то и дело возникают "дыры". В воздух попадает все больше "вредных" для озона газов, вроде монооксида азота NO или тех веществ, которые используются для наполнения холодильных установок и аэрозольных баллончиков. Даже частичное исчезновение озонового слоя над Землей грозит всему живому гибелью...