- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему IIIB (d-элемент). Скандий
Содержание
- 2. Скандий — элемент побочной подгруппы третьей группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 21.
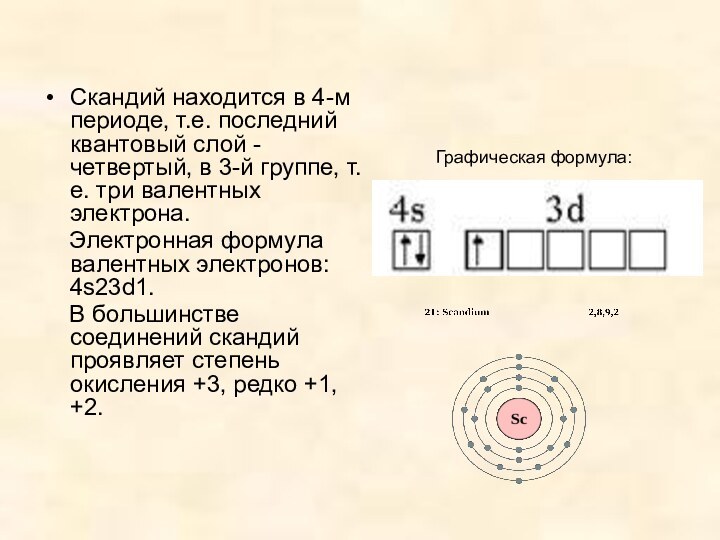
- 3. Графическая формула: Скандий находится в 4-м периоде,
- 4. Нахождение и распространение в природеСамые значительные месторождения тортвейтита (минерала, наиболее богатого скандием) расположены на Мадагаскаре и в Норвегии.
- 5. Физические свойстваСкандий — лёгкий металл серебристого цвета с характерным жёлтым отливом. Существует
- 6. Химические свойстваС водородом скандий реагирует при температуре 450 °С, образуя
- 7. При взаимодействии скандия и серы образуется сульфид
- 8. Способ получения лигатуры аллюминий-скандийЧаще всего скандий применяется в образовании алюминиево-скандиевых сплавов.
- 9. Скандий — моноизотопный элемент, в природе встречается только один стабильный изотоп скандий-45.
- 10. Скачать презентацию
- 11. Похожие презентации
Скандий — элемент побочной подгруппы третьей группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 21.









Слайд 2 Скандий — элемент побочной подгруппы третьей группы, четвёртого периода периодической системы химических
элементов Д. И. Менделеева, с атомным номером 21.
Слайд 3
Графическая формула:
Скандий находится в 4-м периоде, т.е.
последний квантовый слой - четвертый, в 3-й группе, т.е.
три валентных электрона.Электронная формула валентных электронов: 4s23d1.
В большинстве соединений скандий проявляет степень окисления +3, редко +1, +2.
Слайд 4
Нахождение и распространение в природе
Самые значительные месторождения тортвейтита (минерала, наиболее
богатого скандием) расположены на Мадагаскаре и в Норвегии.
Слайд 5
Физические свойства
Скандий — лёгкий металл серебристого цвета с характерным жёлтым отливом. Существует в
двух кристаллических модификациях: α-Sc с гексагальной решёткой типа магния, β-Sc с кубической
объёмноцентрированной решёткой. Скандий — мягкий металл. Температура плавления 1541 °C, температура кипения 2837 °C.
Слайд 6
Химические свойства
С водородом скандий реагирует при температуре 450 °С, образуя гидрид
ScH2 , имеющий кубическую решетку. При взаимодействии с галогенами при температуре 400—600
°С образует соединения типа ScCI3.С кислородом скандий реагирует уже при 200 °С, реакция протекает значительно быстрее в присутствии паров Н20, причем образуется оксид ( HI ) Sc 2 03, представляющий собой бесцветное кристаллическое тугоплавкое вещество.
Слайд 7 При взаимодействии скандия и серы образуется сульфид скандия(III).
Реакция протекает при температуре 600-800°C.
При взаимодействии
с азотом (600—800 °С) образуется нитрид ScN. Также при нагревании взаимодействует с фосфором.2Sc + 3S Sc2S3