- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему строение атома
Содержание
- 2. Электроны, обладая свойствами волны и свойствами
- 3. Ядра атомов состоят из протонов и нейтронов. Протон
- 4. Число протонов в ядре характеризует его заряд
- 5. Разновидности химического элемента, имеющие одинаковое число протонов,
- 6. Обозначение: верхний индекс – массовое число; нижний
- 7. КВАНТОВЫЕ ЧИСЛАГлавное квантовое число (n) Определяет возможные
- 8. Наименьшей энергией электрон обладает при n =1,
- 9. Определяет размер электронного облака (чем больше n,
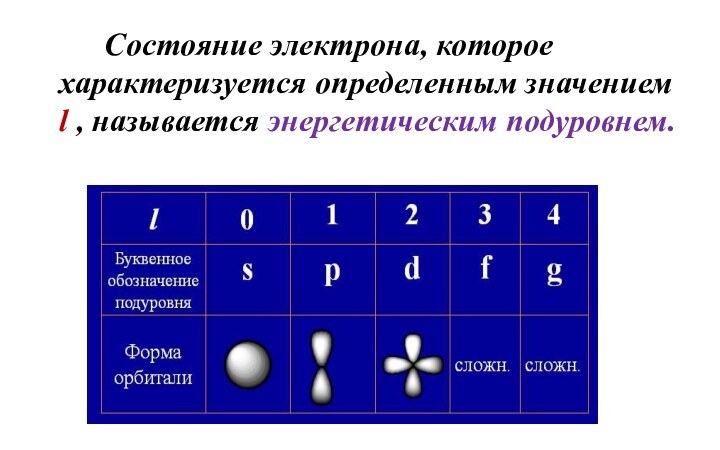
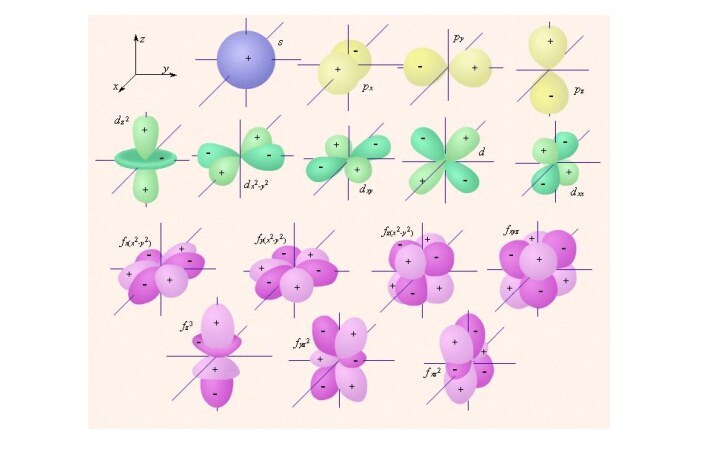
- 10. Орбитальное квантовое число (l) Форма электронного облака определяется
- 11. Состояние электрона, которое характеризуется определенным значением l , называется энергетическим подуровнем.
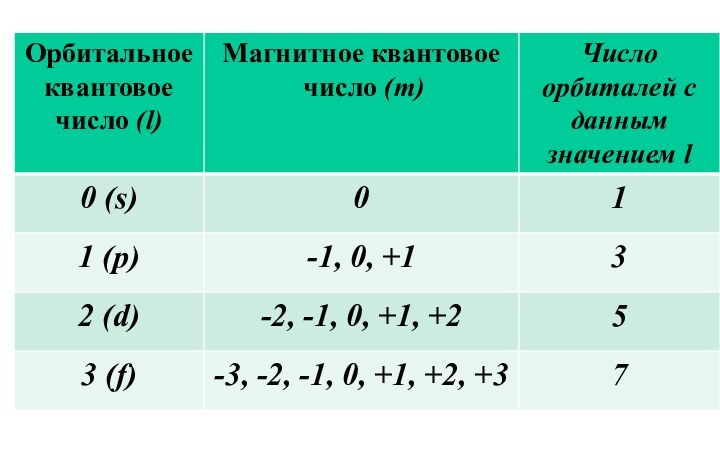
- 12. Магнитное квантовое число (m) Ориентация электронного облака в
- 13. Некоторому значение l соответствует (2l+1) возможных значений
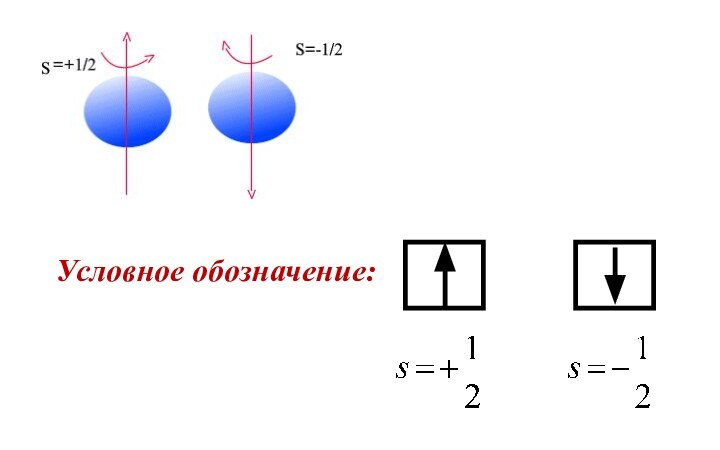
- 16. Спиновое квантовое число (s) Характеризует собственное вращательное движение
- 17. Условное обозначение:
- 18. Многоэлектронные атомы.Распределение электронов по уровням, подуровням и
- 19. Принцип наименьшей энергии (электрон, всегда стремится занять
- 20. 2. Принцип несовместимости (принцип Паули) – в
- 21. Число электронов в энергетическом слое определяется
- 22. Правило Хунда – по атомным орбиталям электроны
- 24. В соответствии с принципом наименьшей энергии и
- 25. Правило Клечковского – вначале электронами заполняется тот
- 26. 1
- 27. 7
- 28. В соответствии с правилом Клечковского формируется реальный
- 29. Электронные и электронно-структурные(графические) формулы Электронные формулы показывают распределение
- 30. Se (+34) 1s22s22p63s23p64s23d104p4
- 31. Число неспаренных электронов можно увеличить за
- 32. Se * (+34) 1s22s22p63s23p64s23d104p34d1
- 33. Se * * (+34) 1s22s22p63s23p64s13d104p34d2
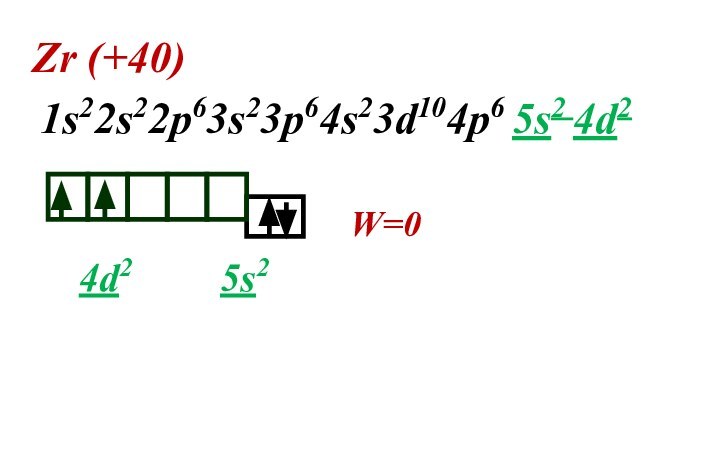
- 34. Zr (+40) 1s22s22p63s23p64s23d104p6 5s2 4d2
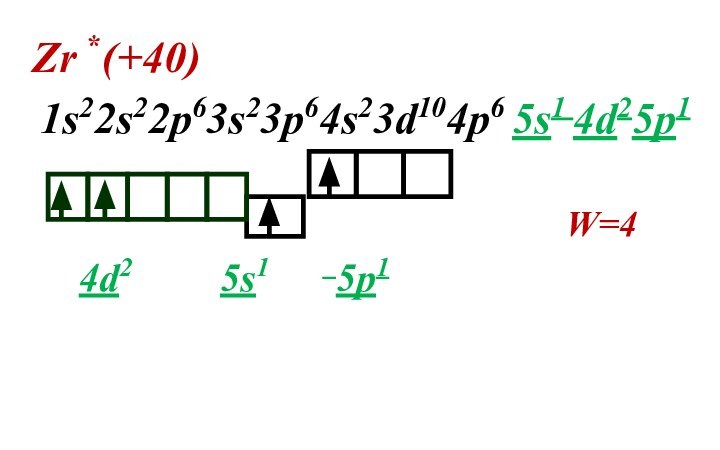
- 35. Zr *(+40) 1s22s22p63s23p64s23d104p6 5s1 4d25p1
- 36. Периодический закон Д.И. Менделеева (1869 г)И. Берцелиус
- 37. 3. В 1864 г. Дж. Ньюлендс (Англия)
- 38. Д.И. Менделеев в основу классификации положил атомный
- 39. Современная формулировка закона: Свойства элементов и их соединений находятся в периодической зависимости от положительного заряда ядра.
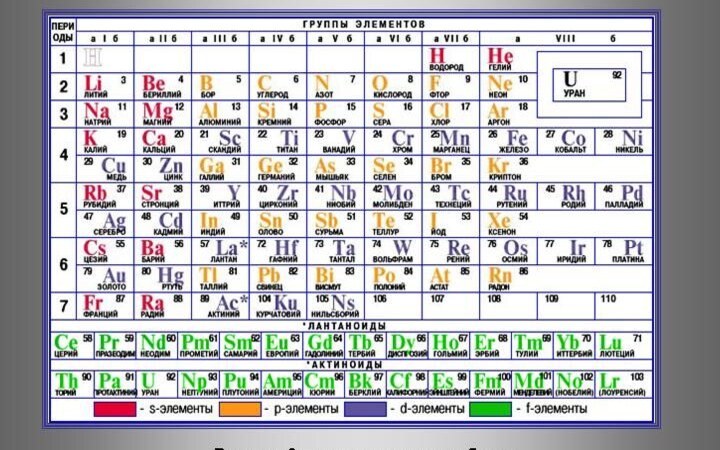
- 40. Структура периодической системы Система состоит из периодов и
- 42. Группу составляют элементы, имеющие одинаковое число валентных
- 43. Элементы каждой группы подразделяются на подгруппы: главную
- 44. Главную подгруппу 8 группы составляют инертные (благородные)
- 45. Свойства свободных атомов Зависимость атомных радиусов от заряда
- 46. При переходе к следующему периоду, радиусы атомов
- 47. Способность атомов легко отдавать внешние электроны и
- 48. В периодах энергия ионизации возрастает слева направо,
- 49. Неметаллы наоборот характеризуются способностью присоединять электроны с
- 50. Скачать презентацию
- 51. Похожие презентации
Электроны, обладая свойствами волны и свойствами частицы, могут находится в любой части пространства вокруг ядра. Область пространства, для которой вероятность обнаружения электрона составляет 95%, называется атомной орбиталью.





















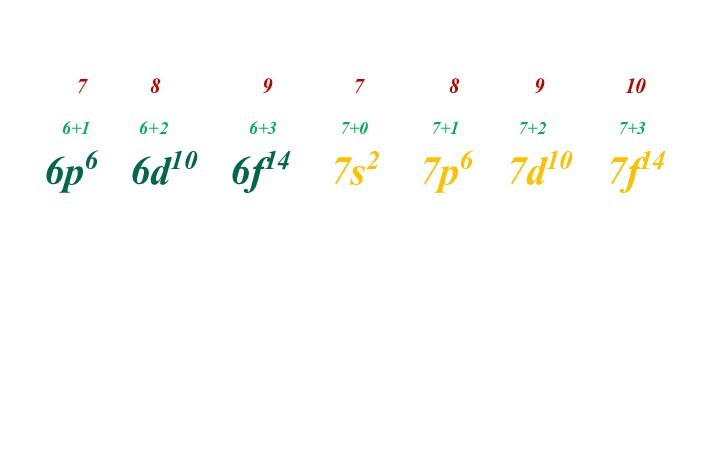


















Слайд 2 Электроны, обладая свойствами волны и свойствами частицы,
могут находится в любой части пространства вокруг ядра.
для которой вероятность обнаружения электрона составляет 95%, называется атомной орбиталью.
Слайд 3
Ядра атомов состоят из протонов и нейтронов.
Протон (р)
– элементарная частица, обладающая «+» зарядом, равным заряду электрона.
Нейтрон
(N) – элементарная частица, не обладающая зарядом. Протоны и нейтроны - 2 различных (заряженное и незаряженное) состояния элементарной ядерной частицы нуклона.
Слайд 4 Число протонов в ядре характеризует его заряд (Z).
Общее число протонов и нейтронов называют массовым числом (А):
А
= р + N Энергия связи ядра - характеризует устойчивость ядер, чем больше энергия связи ядра, тем оно устойчивей.
Слайд 5 Разновидности химического элемента, имеющие одинаковое число протонов, но
разное число нейтронов, называют изотопами (греч. «изос» -одинаковый, «топос»
- место).Изотопы имеют одинаковое строение электронных оболочек и одинаковые химические свойства, различаются они массовым числом.
Слайд 7
КВАНТОВЫЕ ЧИСЛА
Главное квантовое число (n)
Определяет возможные энергетические
состояния электрона в атоме.
n = 1 ÷ ∞
Для реальных
атомов: n =1, 2, 3, 4, 5, 6, 7
Слайд 8 Наименьшей энергией электрон обладает при n =1, с
увеличением n энергия электрона возрастает.
Состояние электрона, которое характеризуется
определенным значением главного квантового числа, называется энергетическим уровнем.
Слайд 9
Определяет размер электронного облака (чем больше n, тем
больше размер облака).
Электроны, с одинаковым значением n, образуют
в атоме электронные облака приблизительно одинакового размера.
Слайд 10
Орбитальное квантовое число (l)
Форма электронного облака определяется орбитальным
квантовым числом l, которое может принимать целочисленные значения:
l =
0 ÷ (n-1)Слайд 11 Состояние электрона, которое характеризуется определенным значением l ,
называется энергетическим подуровнем.
Слайд 12
Магнитное квантовое число (m)
Ориентация электронного облака в пространстве
определяется значением магнитного квантового числа m.
Принимает целочисленные значения:
m
= - l÷(0)÷ +lСлайд 13 Некоторому значение l соответствует (2l+1) возможных значений m,
т.е. возможных способов расположения электронных облаков в пространстве.
Состояние электрона
с определенными значениями квантовых чисел n, l и m (определенными размерами, формой и ориентацией облака в пространстве), называется атомной электронной орбиталью.
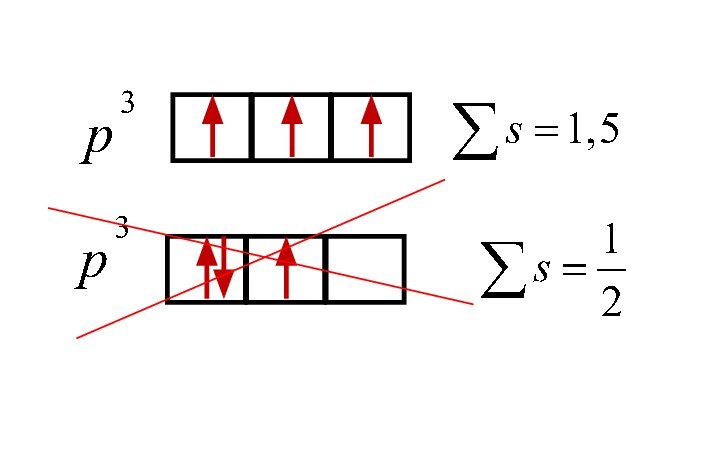
Слайд 16
Спиновое квантовое число (s)
Характеризует собственное вращательное движение электрона
вокруг своей оси (от англ.«spin» - вращение, волчок).
Принимает
значения:
Слайд 18
Многоэлектронные атомы.
Распределение электронов по уровням,
подуровням и атомным
орбиталям
Число электронов, вращающихся вокруг ядра, соответствует «+» заряду ядра.
Слайд 19 Принцип наименьшей энергии (электрон, всегда стремится занять самый
низкий энергетический уровень, т.е. вначале заполняются уровни с n
=1, затем n =2 и т.д.).Слайд 20 2. Принцип несовместимости (принцип Паули) – в атоме
не может быть 2 электронов, характеризующихся одинаковыми значениями всех
квантовых чисел, т.е. для каждого электрона характерен свой набор квантовых чисел.Вольфганг ПАУЛИ
(1900 г – 1958г)
Слайд 21 Число электронов в энергетическом слое определяется значением
гл. квантового числа по формуле:
N = 2n2
В соответствии с принципом Паули, максимальное число электронов на подуровнях:
s2, p6, d10, f14
Слайд 22
Правило Хунда –
по атомным орбиталям электроны распределяются
таким образом, чтобы обеспечить максимальное значение суммарного спинового числа
Фридрих
ХУНД(1891 - 1974)
Слайд 24 В соответствии с принципом наименьшей энергии и с
помощью квантовых чисел получают т.н. «идеальный» ряд распределения электронов.
1s2
2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f14 6s2 6p6 6d10 6f14
7s2 7p6 7d107f14
Слайд 25 Правило Клечковского – вначале электронами заполняется тот подуровень,
для которого минимальна сумма (n+l), при одинаковых значениях этой
суммы предпочтительней подуровень с меньшим значением n.Всеволод Маврикиевич Клечковский
(1900–1972)
Слайд 26 1
2 3
3 4 5 4 51+0 2+0 2+1 3+0 3+1 3+2 4+0 4+1
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6
6 7 5 6 7 8 6
4+2 4+3 5+0 5+1 5+2 5+3 6+0
4d10 4f14 5s2 5p6 5d10 5f14 6s2
Слайд 28 В соответствии с правилом Клечковского формируется реальный ряд
распределения электронов:
1s2 2s2 2p6 3s2 3p6
4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6
7s2 5f14 6d10 7p6 6f14 7d10 7f14
Слайд 29
Электронные и электронно-структурные
(графические) формулы
Электронные формулы показывают распределение электронов
по уровням и подуровням.
Электронно-структурные – по атомным орбиталям.
По
атомным орбиталям распределяют электроны внешнего слоя и d-подуровня предыдущего слоя (для d-элементов).
Слайд 30
Se (+34)
1s22s22p63s23p64s23d104p4
W=2
4s2 4p4
Валентность (W) определяется числом неспаренных электронов на внешнем уровне.
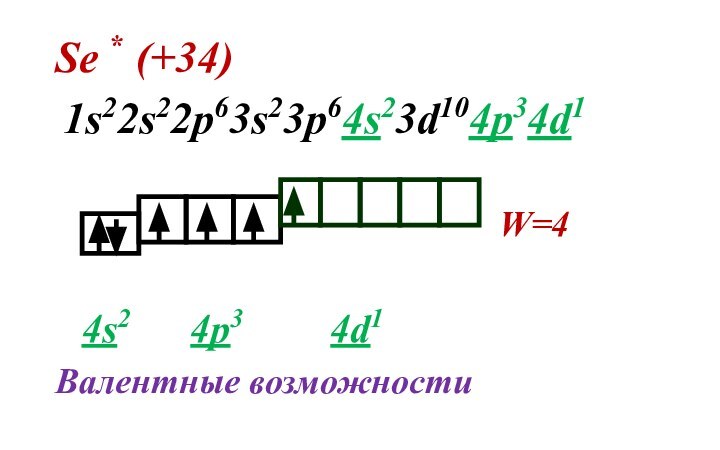
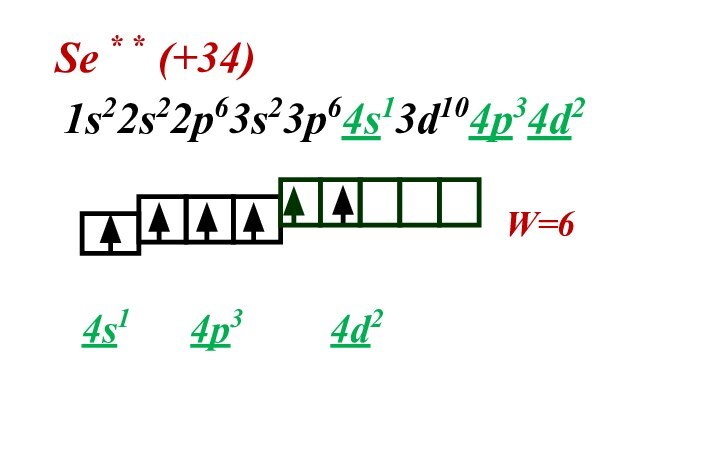
Слайд 31 Число неспаренных электронов можно увеличить за счет
дополнительной энергии и перевода атома в возбужденное состояние. Затраченная
энергия компенсируется энергией которая выделяется при образовании химической связи.Переходы электронов возможны только в пределах одного энергетического уровня или на подуровень ниже.
Слайд 36
Периодический закон Д.И. Менделеева (1869 г)
И. Берцелиус (Швеция)
в начале XIX века разделил все элементы на металлы
и неметаллы.В 1829 г. И. Доберейнер (Германия) предложил сгруппировать сходные по свойствам элементы в триады:
Cl, Br, I; K, Rb, Cs; Ca, Sr, Ba
Слайд 37 3. В 1864 г. Дж. Ньюлендс (Англия) распределил
все известные элементы в ряд, в порядке возрастания атомных
масс.4. В 1864 г. Ю. Майер (Германия) опубликовал таблицу элементов, из которой однако не вытекала периодичность изменения свойств элементов.
В основе всех этих классификаций лежали случайные сходства и случайные признаки элементов, они выявляли закономерности только в рядах близких по свойствам элементов.
Слайд 38 Д.И. Менделеев в основу классификации положил атомный вес
(атомную массу) элементов.
Расположив все известные тогда (63) элементы
в порядке возрастания их атомных масс и с учетом их свойств, он сформулировал в 1869 г. периодический закон: Д.И. Менделеев
1834 г. – 1907 г.
Слайд 39
Современная формулировка закона:
Свойства элементов и их соединений находятся
в периодической зависимости от положительного заряда ядра.
Слайд 40
Структура периодической системы
Система состоит из периодов и групп.
Период составляют элементы, у которых заполняется электронами одинаковое число
квантовых слоев. Номер периода совпадает со значением главного квантового числа внешнего электронного слоя.
Слайд 42 Группу составляют элементы, имеющие одинаковое число валентных электронов.
s и p –элементы помещены в группы по числу
электронов во внешнем энергетическом уровне.d–элементы помещают в группы по сумме s-электронов внешнего слоя и d-электронов предшествующего слоя.
Все f –элементы являются элементами 3 группы, образуют 2 семейства из 14 сходных по свойствам элементов (лантаноиды, актиноиды).
Слайд 43 Элементы каждой группы подразделяются на подгруппы: главную и
побочную. Подгруппа – это вертикальный ряд элементов, имеющих однотипное
электронное строение и являющихся электронными аналогами.s и p –элементы составляют главную подгруппу (А);
d–элементы – побочную (В).
Слайд 44 Главную подгруппу 8 группы составляют инертные (благородные) газы:
He, Ne, Ar, Kr, Xe, Rn, имеющие строение внешнего
электронного слоя ns2np6.
Слайд 45
Свойства свободных атомов
Зависимость атомных радиусов от заряда ядра
имеет периодический характер.
В пределах одного периода с увеличением
заряда размеры атомов уменьшаются. Это связано с увеличением притяжения электронов внешнего слоя к ядру по мере возрастания его заряда.
Слайд 46
При переходе к следующему периоду, радиусы атомов увеличиваются.
В пределах подгруппы с возрастанием заряда ядра размеры атомов
увеличиваются (в группах радиус возрастает сверху вниз).Слайд 47 Способность атомов легко отдавать внешние электроны и превращаться
в «+» -заряженные ионы является наиболее характерным химическим свойством
металлов.Для отрыва электрона от нейтрального атома необходимо затратить некоторую энергию, которая называется энергией ионизации (ЕI , эВ).
Слайд 48 В периодах энергия ионизации возрастает слева направо, что
вызвано сжатием электронных оболочек атома вследствие увеличения заряда ядра.
В группах сверху вниз энергия ионизации уменьшается вследствие увеличения радиуса атома и экранирующего действия электронов.





























