валентность по кислороду равна ………..
Низшая валентность по водороду равна
………Химическая формула – это …
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть















Определите заряды ядра и нарисуйте электронные конфигурации атомов 2 периода.
Be +4)2)2 B +5)2)3 C +6)2)4 N +7)2)5 O +8)2)6 F +9)2)7
Li +3 )2)1
Как связано проявление атомами элементов металлических и неметаллических свойств со значением электроотрицательности?
2.Расположите предложенные химические элементы в порядке возрастания их электроотрицательности.
Мg, B, O, K, P, Ca, S, Ag, Al, H.
K, Ca, Mg, Ag, Al, B, H, P, S, O
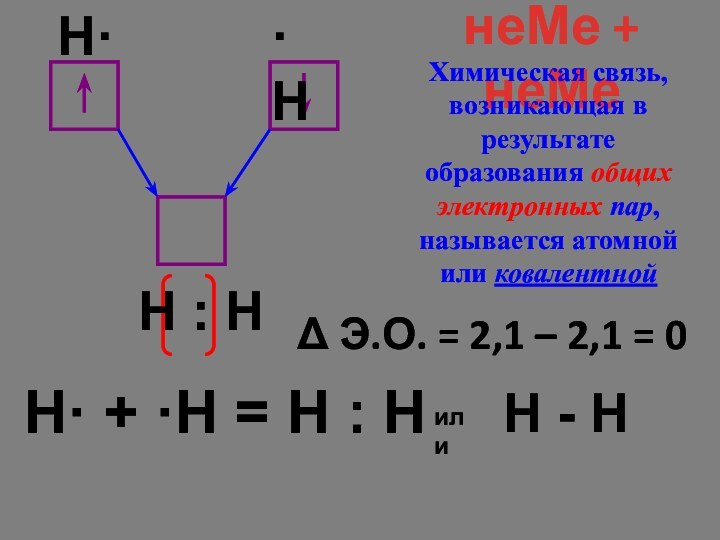
·H
Н : Н
или
Н - Н
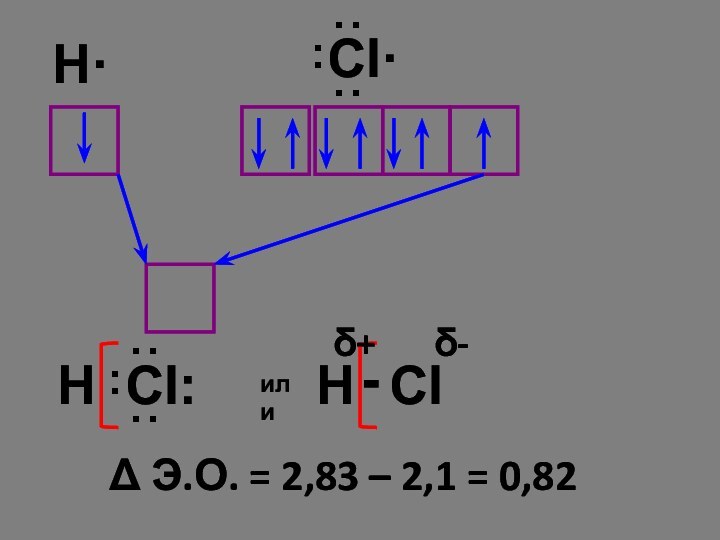
Химическая связь, возникающая в результате образования общих электронных пар, называется атомной или ковалентной