- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Лекция 8. Нуклеофильное присоединение к кратным связям углерод-гетероатом. Карбонильные соединения
Содержание
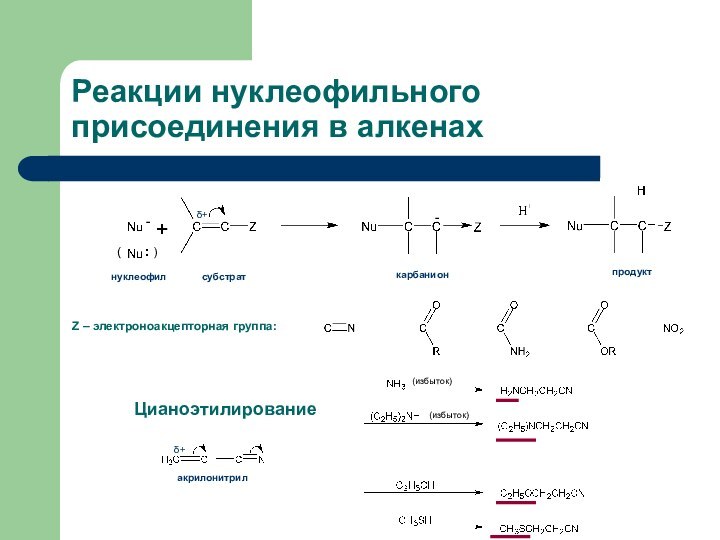
- 2. Реакции нуклеофильного присоединения в алкенахZ – электроноакцепторная группа:акрилонитрилδ+(избыток)(избыток)Цианоэтилирование
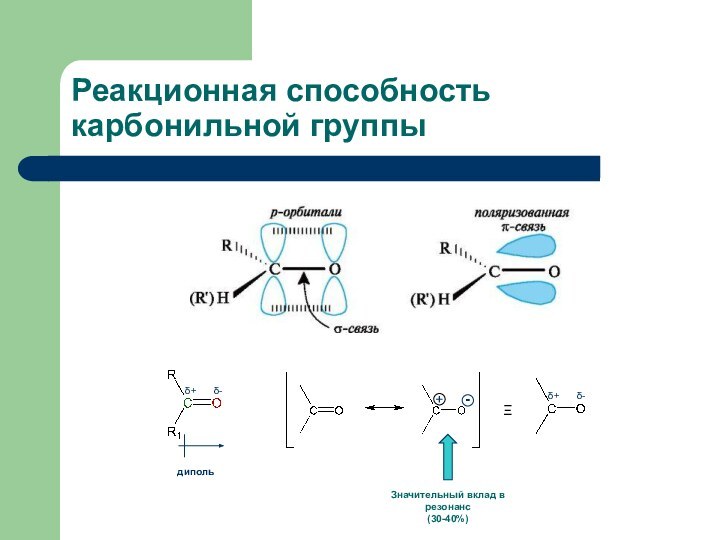
- 3. Реакционная способность карбонильной группы
- 4. Реакционная способность карбонильной группыРеакционная способность карбонильной группы как следствие сильной поляризации
- 5. Поляризация карбонильной группы в соединениях RCOXХКласссоединенийБолее электрофильныйБолее реакционноспособныйМенее электрофильныйМенее реакционноспособныйБолее электроноакцепторныеМенее электроноакцепторные
- 6. Реакционная способность карбонильной группыЛегкость нуклеофильной атаки по
- 7. Механизмы реакций: некатализируемое и кислотно-катализируемое ANТип I. Некатализируемое АNТип II. Кислотно-катализируемое АN
- 8. Роль основания: превращение атакующего агента в более
- 9. Промежуточные выводыЭлектронная плотность на карбонильном углероде выше
- 10. Влияние сопряжения на реакционную способность субстрата За счет
- 11. Влияние стерических факторов на реакционную способность субстратаУменьшение реакционной способности2,2,4,4-тетраметилпентанон-33,3-диметилбутанон-2ацетон
- 12. Влияние агента на скорость реакций АNУчастие нуклеофильного
- 13. Типичные реакции AN: реакции с кислородсодержащими нуклеофилами
- 14. Реакции с водой (гидратация)Катализируется и кислотами, и основаниямигидратная форма альдегида(гем-диол)
- 15. Реакция со спиртами, получение ацеталей1) АN2) SN1
- 16. Реакция со спиртами, получение ацеталей. Пример реакции1)
- 17. Промежуточные выводыВзаимодействие карбонильных соединений со спиртами в
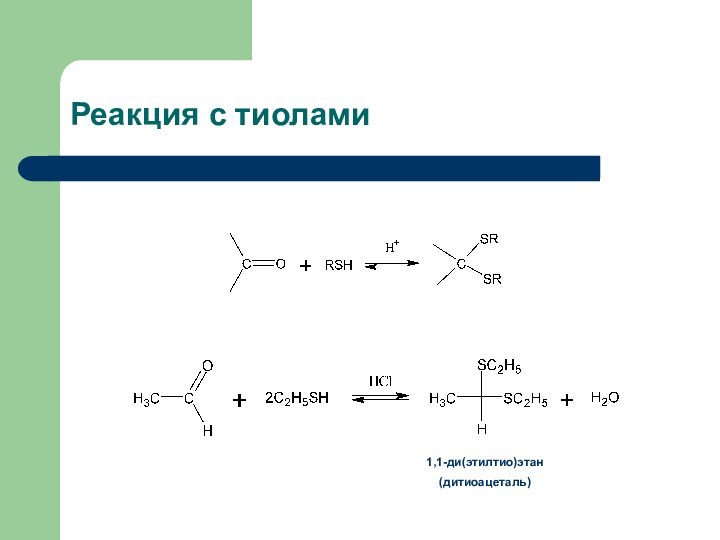
- 18. Реакция с тиолами1,1-ди(этилтио)этан(дитиоацеталь)
- 19. Реакции с азотосодержащими нуклеофилами IРеакция присоединения-отщепления:
- 20. Зависимость реакций присоединения-отщепления от рН средыОпределяется:1) Кислотным
- 21. 1) Реакция с аминами2) Реакция с гидроксиламиномРеакции с азотосодержащими нуклеофилами IIоксим ацетонагидрохлорид гидроксиламина
- 22. Реакции с азотосодержащими нуклеофилами III3) Реакция с гидразинами4) Реакция с семикарбазонамигидразингидразон ацетальдегидаазин ацетальдегидациклогексанонсемикарбазидсемикарбазон циклогексанона
- 23. Получение гидразоновЭту реакцию можно использовать для выделения
- 24. Типичные реакции AN: реакции с углеродсодержащими нуклеофилами
- 25. Реакции с углеродсодержащими нуклеофиламиОбразование углерод-углеродных связейНаращивание углеродного
- 26. Присоединение магнийорганических соединенийУниверсальный способ синтеза спиртов:Формальдегид → первичные спиртыДругие альдегиды → вторичные спиртыКетоны → третичные спиртыпропилмагнийбромидпентанол-2
- 27. Взаимодействие карбонильных соединений с карбанионамиПротекают в условиях
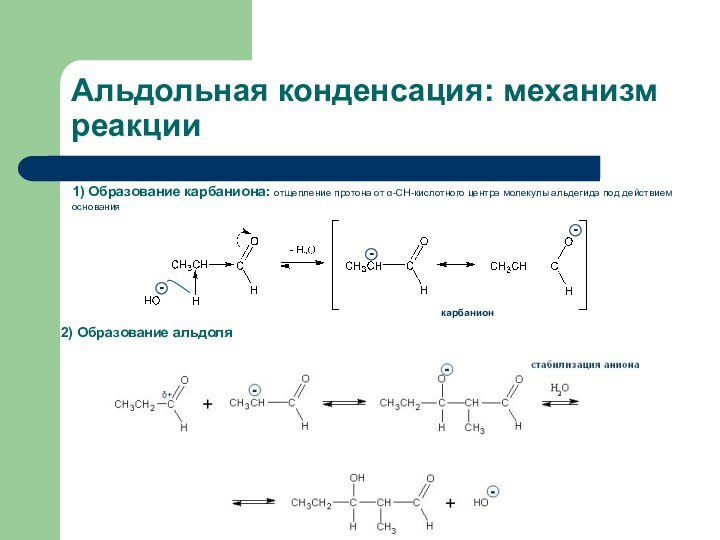
- 28. Альдольная конденсация Альдольная конденсация - взаимодействие двух молекул
- 29. Альдольная конденсация: механизм реакции1) Образование карбаниона: отщепление
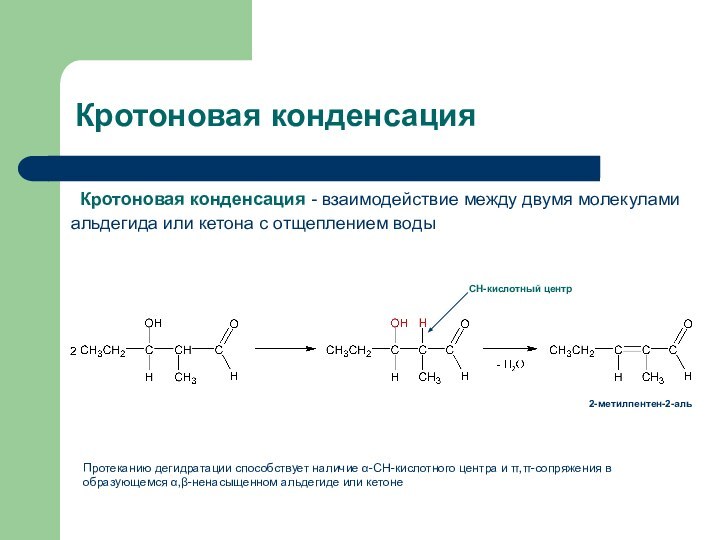
- 30. Кротоновая конденсация Кротоновая конденсация - взаимодействие между двумя
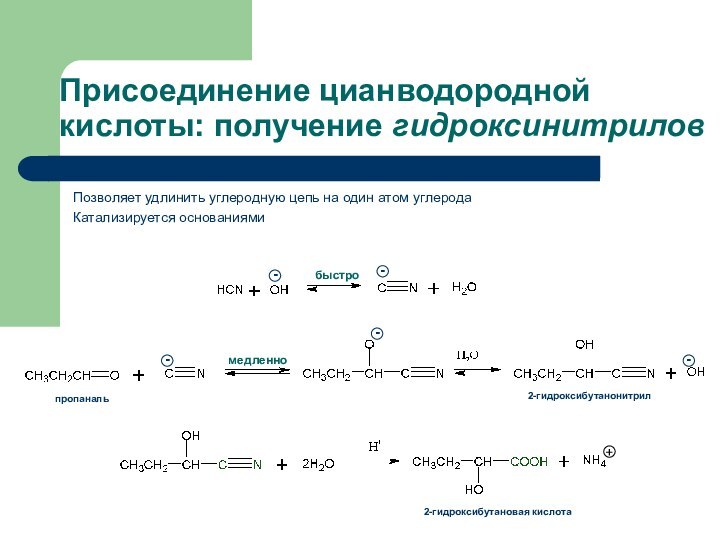
- 31. Присоединение цианводородной кислоты: получение гидроксинитриловПозволяет удлинить углеродную цепь на один атом углеродаКатализируется основаниями
- 32. Другие химические свойства альдегидов и кетонов
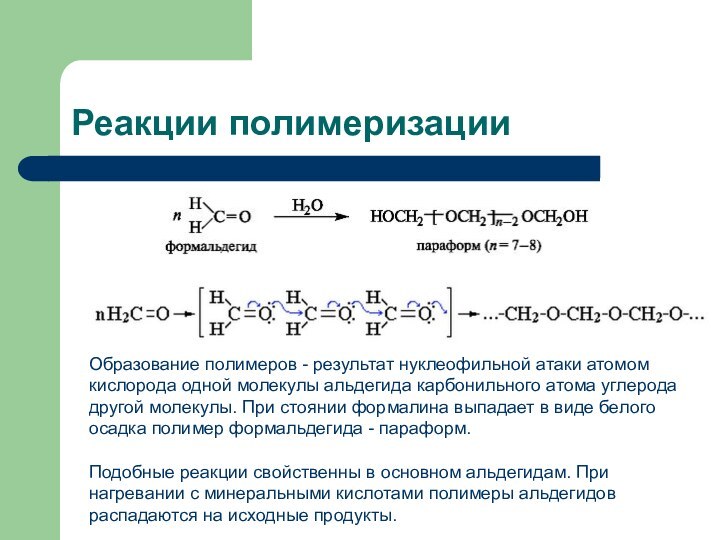
- 33. Реакции полимеризацииОбразование полимеров - результат нуклеофильной атаки
- 34. Окисление альдегидовРеакции окисления альдегидов протекают в мягких условиях
- 35. ВосстановлениеРеакции восстановления альдегидов приводят к образованию первичных спиртов,
- 36. Реакция Каниццаро (диспропорционирования)Реакции окисления-восстановления (диспропорционирования) -реакция Канниццаро, характерна
- 37. Реакция Каниццаро. МеханизмВ результате реакции окисляется та молекула альдегида, которая была атакована анионом -OH.
- 38. Перекрестная реакция КаниццароЕсли в реакции использовать смесь
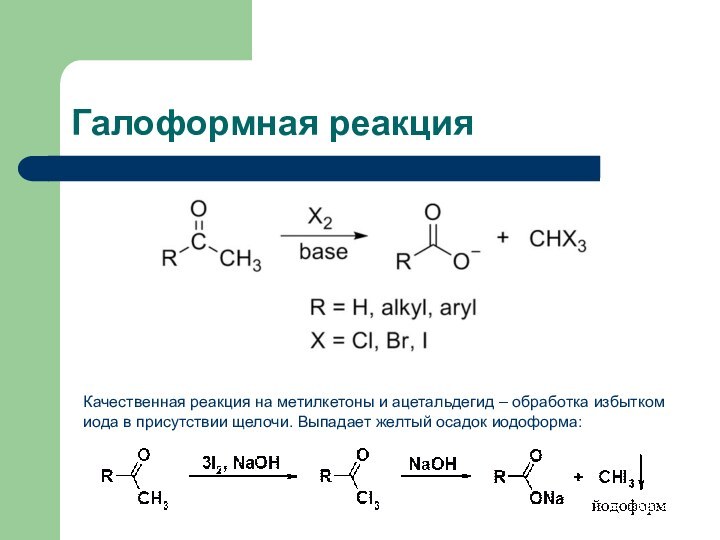
- 39. Галоформная реакцияКачественная реакция на метилкетоны и ацетальдегид
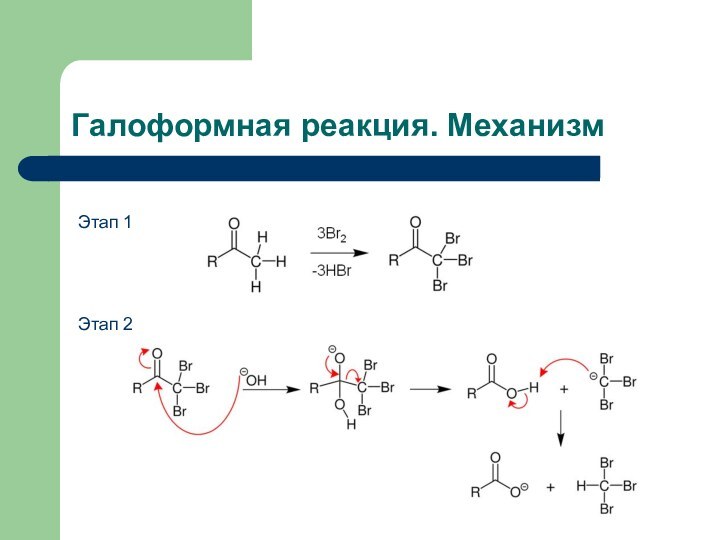
- 40. Галоформная реакция. МеханизмЭтап 1Этап 2
- 41. Скачать презентацию
- 42. Похожие презентации














Слайд 2
Реакции нуклеофильного присоединения в алкенах
Z – электроноакцепторная группа:
акрилонитрил
δ+
(избыток)
(избыток)
Цианоэтилирование
Слайд 4
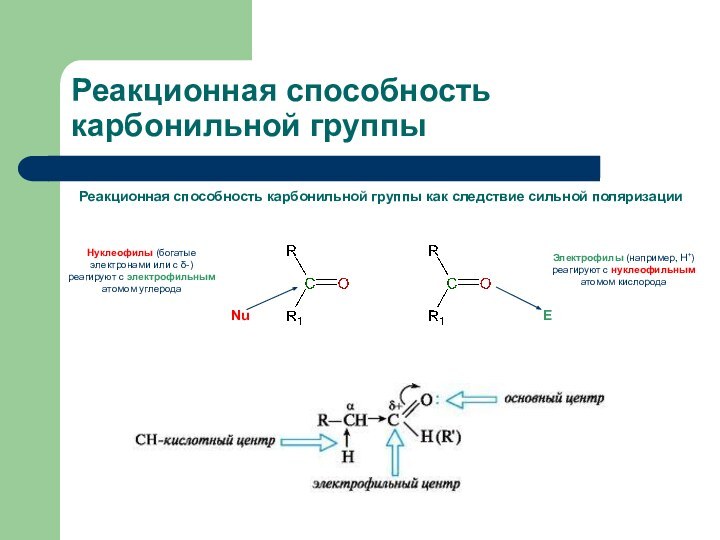
Реакционная способность карбонильной группы
Реакционная способность карбонильной группы как
следствие сильной поляризации
Слайд 5
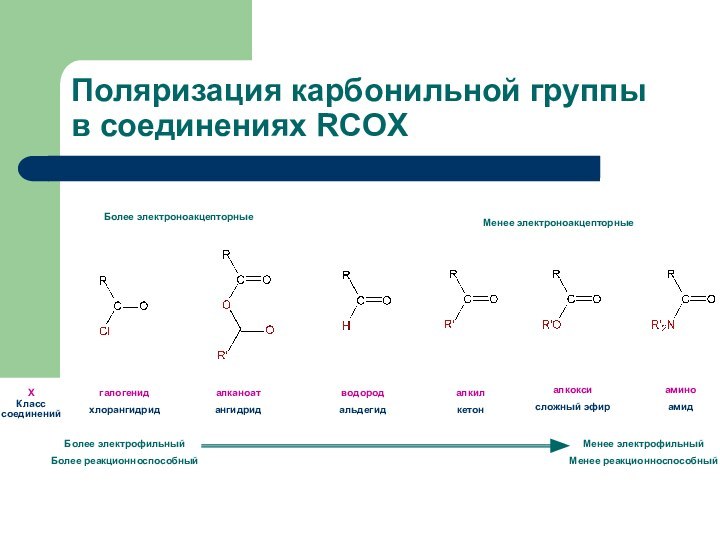
Поляризация карбонильной группы в соединениях RCOX
Х
Класс
соединений
Более электрофильный
Более реакционноспособный
Менее
электрофильный
Менее реакционноспособный
Более электроноакцепторные
Менее электроноакцепторные
Слайд 6
Реакционная способность карбонильной группы
Легкость нуклеофильной атаки по атому
углерода карбонильной группы альдегида или кетона зависит от: (1)
величины частичного положительного заряда на атоме углерода, (2) его пространственной доступности и (3) кислотно-основных свойств среды
Слайд 7
Механизмы реакций: некатализируемое и кислотно-катализируемое AN
Тип I. Некатализируемое
АN
Тип II. Кислотно-катализируемое АN
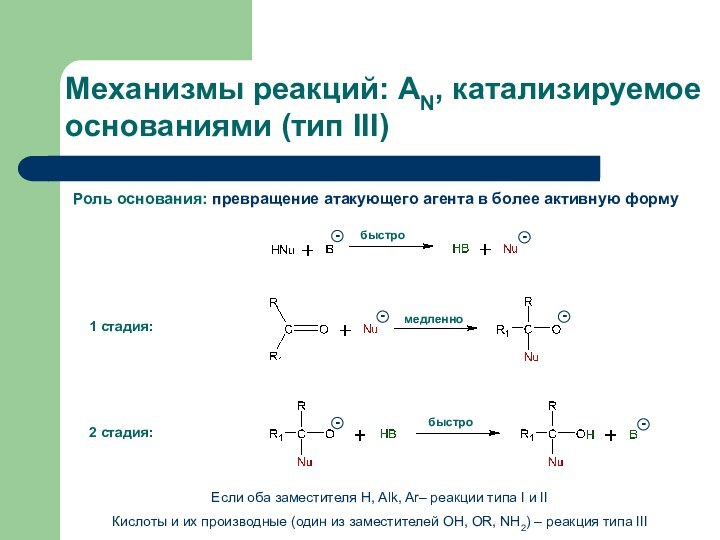
Слайд 8 Роль основания: превращение атакующего агента в более активную
форму
Механизмы реакций: AN, катализируемое основаниями (тип III)
Если оба заместителя
Н, Alk, Ar– реакции типа I и IIКислоты и их производные (один из заместителей OH, OR, NH2) – реакция типа III
Слайд 9
Промежуточные выводы
Электронная плотность на карбонильном углероде выше в
переходном состоянии, чем в исходном.
В исходном состоянии карбонильный углерод
окружен тремя лигандами, в переходном – четырьмя, т.е. переходное состояние более пространственно затруднено, чем исходное.Электронодонорные эффекты (+I, +M) – снижение реакционной способности субстрата. Электроноакцепторные эффекты (-I, -M) – повышение реакционной способности субстрата
Слайд 10
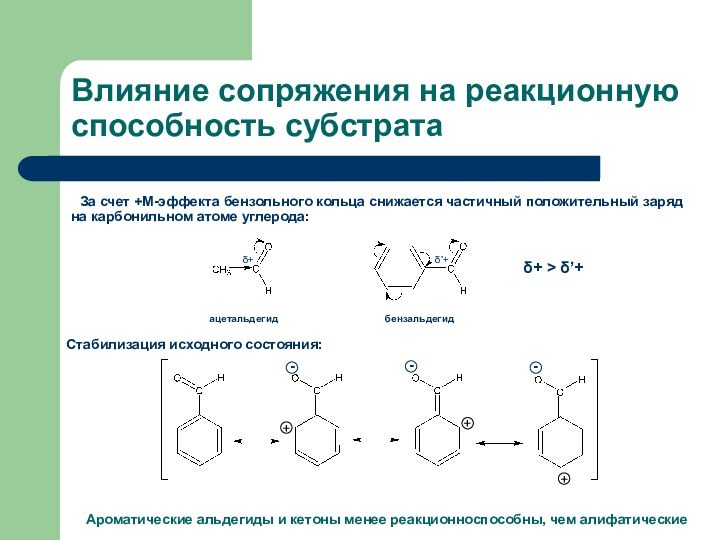
Влияние сопряжения на реакционную способность субстрата
За счет +М-эффекта
бензольного кольца снижается частичный положительный заряд на карбонильном атоме
углерода:ацетальдегид
бензальдегид
Стабилизация исходного состояния:
Ароматические альдегиды и кетоны менее реакционноспособны, чем алифатические
Слайд 11
Влияние стерических факторов на реакционную способность субстрата
Уменьшение реакционной
способности
2,2,4,4-тетраметилпентанон-3
3,3-диметилбутанон-2
ацетон
Слайд 12
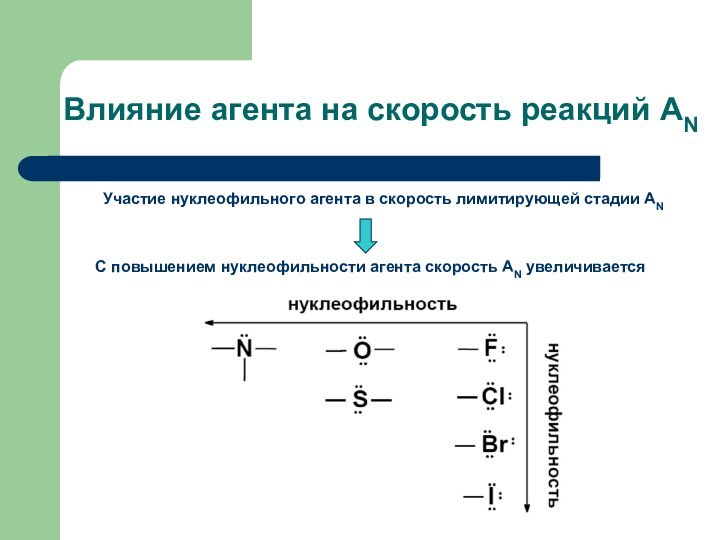
Влияние агента на скорость реакций АN
Участие нуклеофильного агента
в скорость лимитирующей стадии АN
С повышением нуклеофильности агента скорость
АN увеличивается
Слайд 14
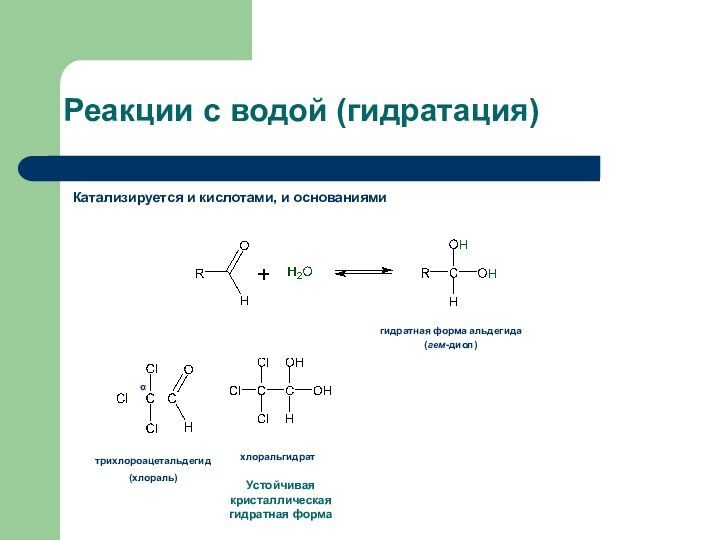
Реакции с водой (гидратация)
Катализируется и кислотами, и основаниями
гидратная
форма альдегида
(гем-диол)
Слайд 16
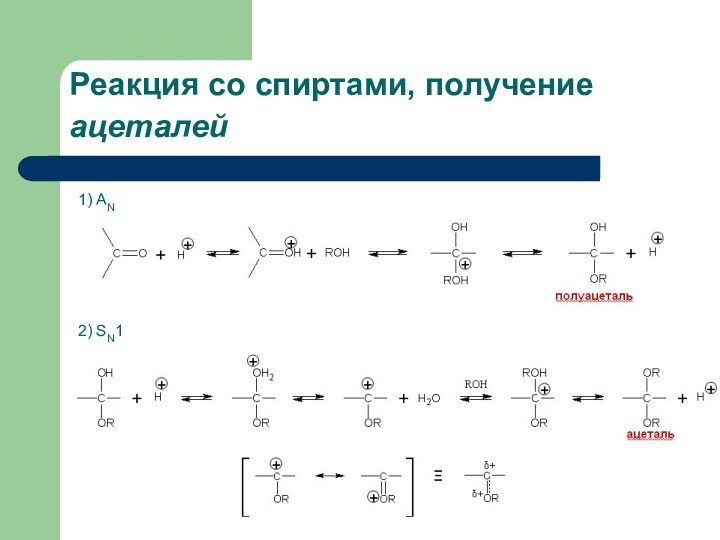
Реакция со спиртами, получение ацеталей. Пример реакции
1) АN
2)
SN1
1-этоксиэтанол
(полуацеталь)
1,1-диэтоксиэтан
(ацеталь)
Ацетали —простые эфиры типа R—CH(OR1)(OR2), где R1 и R2 — углеводородные
радикалы: CH3, C2H5 и др. Если один из R1 или R2 представляет собой просто атом водорода, то данное соединение называют полуацеталем
Слайд 17
Промежуточные выводы
Взаимодействие карбонильных соединений со спиртами в безводных
условиях в присутствии кислот и при удалении образующейся в
реакции воды приводит к образованию ацеталейВзаимодействие ацеталей с водными растворами кислот приводит к гидролизу ацеталей
Устойчивость ацеталей в щелочных средах
Слайд 20
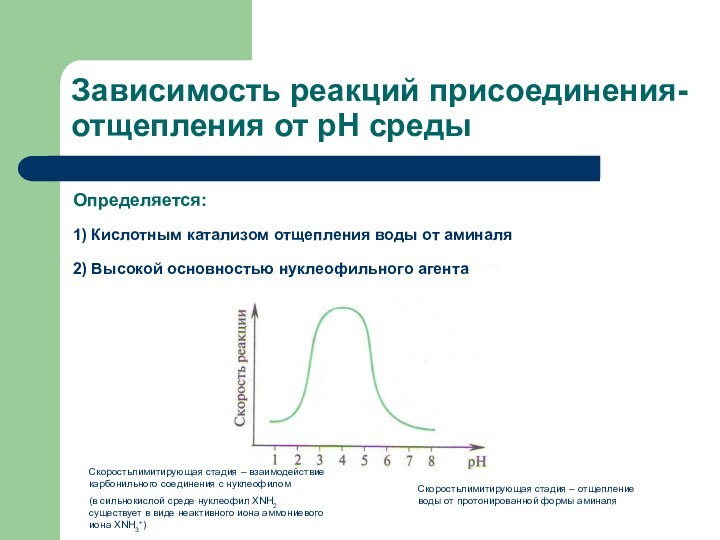
Зависимость реакций присоединения-отщепления от рН среды
Определяется:
1) Кислотным катализом
отщепления воды от аминаля
2) Высокой основностью нуклеофильного агента
Скоростьлимитирующая стадия
– отщепление воды от протонированной формы аминаляСкоростьлимитирующая стадия – взаимодействие карбонильного соединения с нуклеофилом
(в сильнокислой среде нуклеофил XNH2 существует в виде неактивного иона аммониевого иона ХNH3+)
Слайд 21
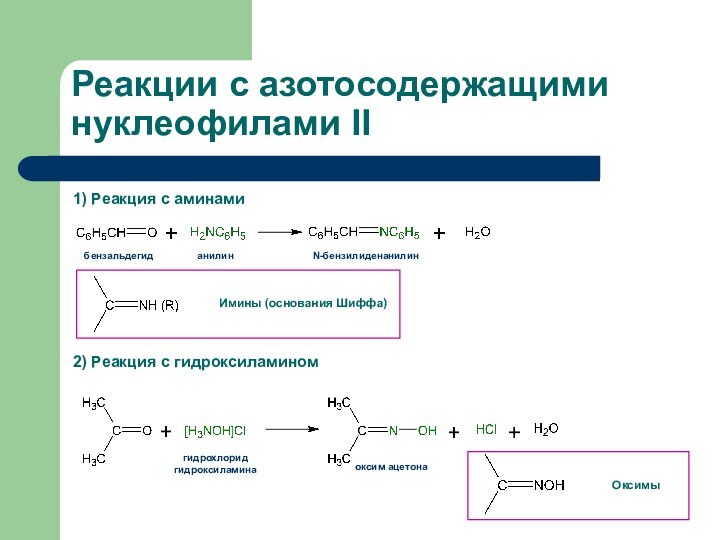
1) Реакция с аминами
2) Реакция с гидроксиламином
Реакции с
азотосодержащими нуклеофилами II
оксим ацетона
гидрохлорид гидроксиламина
Слайд 22
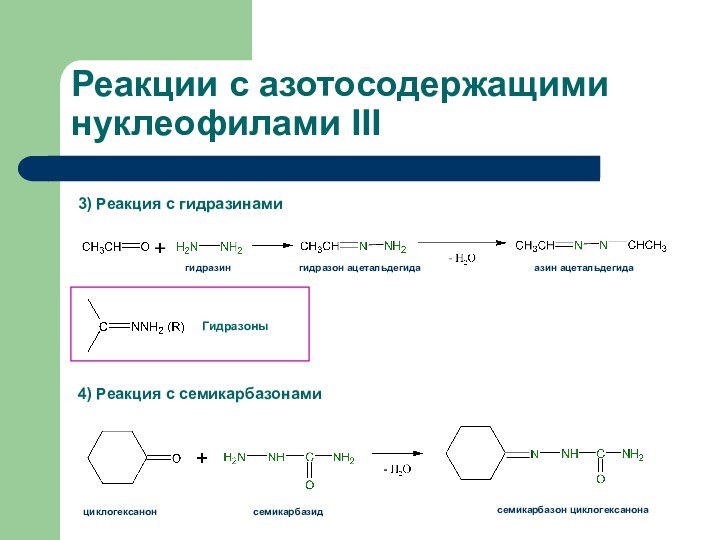
Реакции с азотосодержащими нуклеофилами III
3) Реакция с гидразинами
4)
Реакция с семикарбазонами
гидразин
гидразон ацетальдегида
азин ацетальдегида
циклогексанон
семикарбазид
семикарбазон циклогексанона
Слайд 23
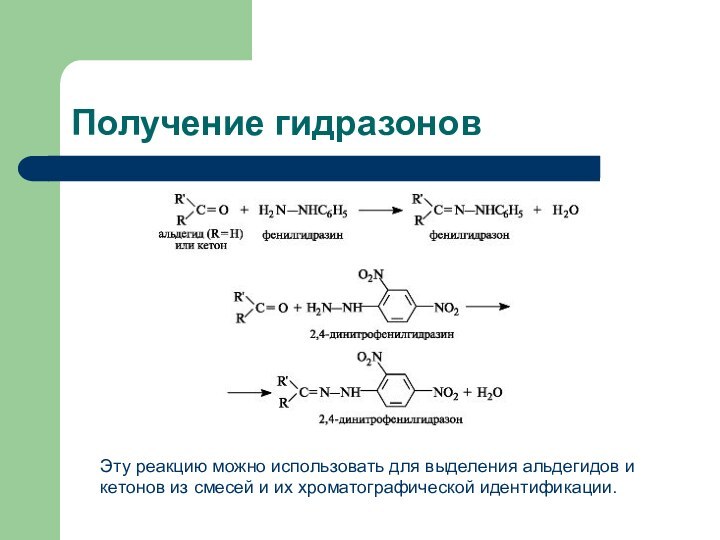
Получение гидразонов
Эту реакцию можно использовать для выделения альдегидов
и кетонов из смесей и их хроматографической идентификации.
Слайд 25
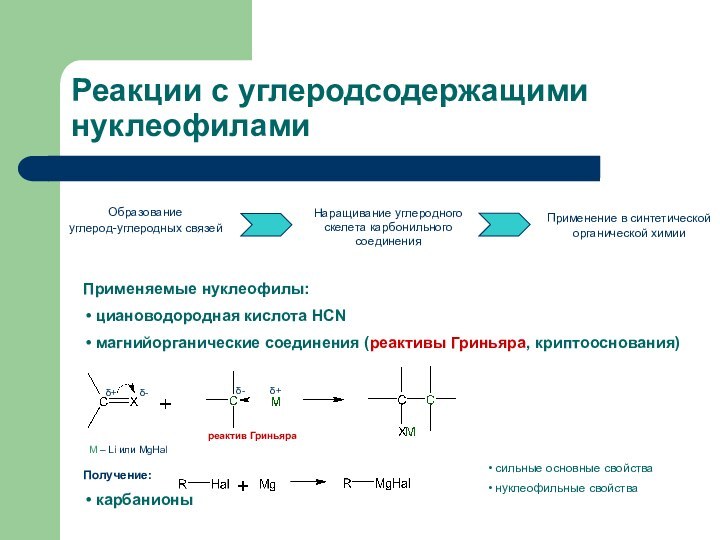
Реакции с углеродсодержащими нуклеофилами
Образование
углерод-углеродных связей
Наращивание углеродного скелета
карбонильного соединения
Применение в синтетической органической химии
Применяемые нуклеофилы:
циановодородная
кислота HCNмагнийорганические соединения (реактивы Гриньяра, криптооснования)
Получение:
карбанионы
сильные основные свойства
нуклеофильные свойства
реактив Гриньяра
Слайд 26
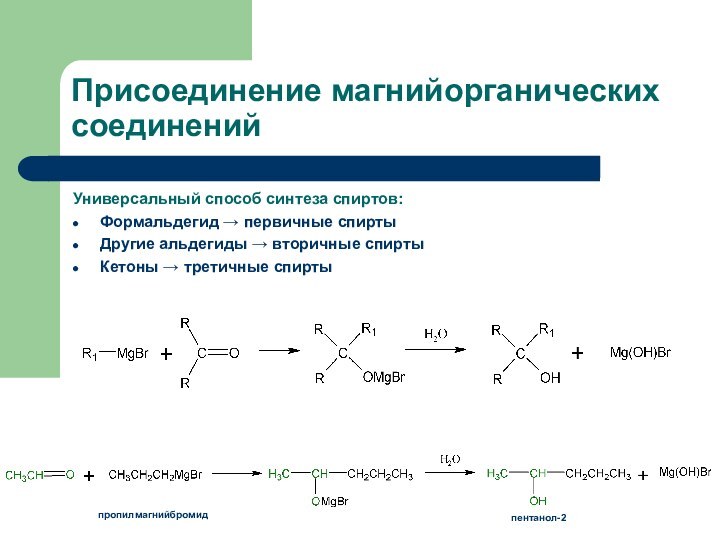
Присоединение магнийорганических соединений
Универсальный способ синтеза спиртов:
Формальдегид → первичные
спирты
Другие альдегиды → вторичные спирты
Кетоны → третичные спирты
пропилмагнийбромид
пентанол-2
Слайд 27
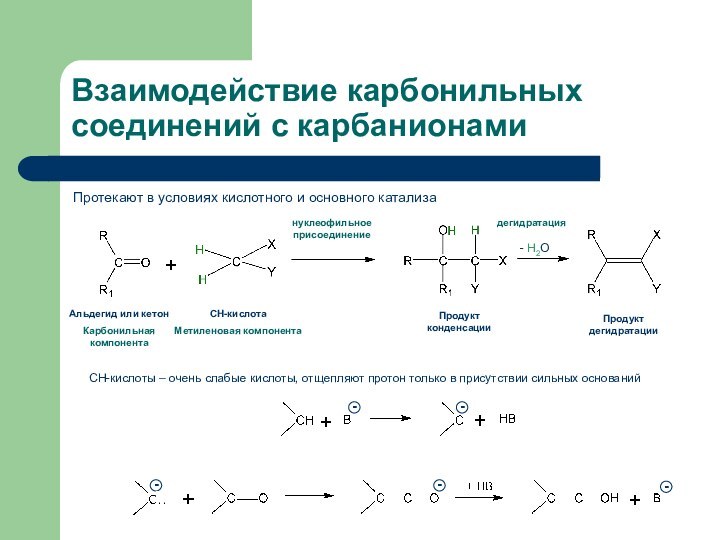
Взаимодействие карбонильных соединений с карбанионами
Протекают в условиях кислотного
и основного катализа
Альдегид или кетон
Карбонильная компонента
СН-кислота
Метиленовая компонента
Продукт конденсации
Продукт дегидратации
-
Н2Онуклеофильное присоединение
дегидратация
СН-кислоты – очень слабые кислоты, отщепляют протон только в присутствии сильных оснований
Слайд 28
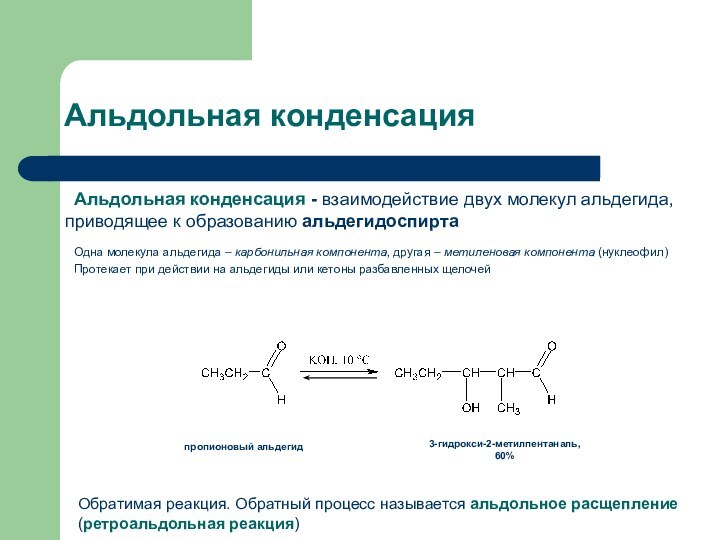
Альдольная конденсация
Альдольная конденсация - взаимодействие двух молекул альдегида,
приводящее к образованию альдегидоспирта
Одна молекула альдегида – карбонильная компонента,
другая – метиленовая компонента (нуклеофил)Протекает при действии на альдегиды или кетоны разбавленных щелочей
3-гидрокси-2-метилпентаналь, 60%
пропионовый альдегид
Обратимая реакция. Обратный процесс называется альдольное расщепление (ретроальдольная реакция)
Слайд 29
Альдольная конденсация: механизм реакции
1) Образование карбаниона: отщепление протона
от α-СН-кислотного центра молекулы альдегида под действием основания
2) Образование
альдолякарбанион
Слайд 30
Кротоновая конденсация
Кротоновая конденсация - взаимодействие между двумя молекулами
альдегида или кетона с отщеплением воды
СН-кислотный центр
2-метилпентен-2-аль
Протеканию дегидратации способствует
наличие α-СН-кислотного центра и π,π-сопряжения в образующемся α,β-ненасыщенном альдегиде или кетоне
Слайд 31
Присоединение цианводородной кислоты: получение гидроксинитрилов
Позволяет удлинить углеродную цепь
на один атом углерода
Катализируется основаниями
Слайд 33
Реакции полимеризации
Образование полимеров - результат нуклеофильной атаки атомом
кислорода одной молекулы альдегида карбонильного атома углерода другой молекулы.
При стоянии формалина выпадает в виде белого осадка полимер формальдегида - параформ.Подобные реакции свойственны в основном альдегидам. При нагревании с минеральными кислотами полимеры альдегидов распадаются на исходные продукты.
Слайд 34
Окисление альдегидов
Реакции окисления альдегидов протекают в мягких условиях с
образованием карбоновых кислот. Исключение составляют ароматические альдегиды, которые не
окисляются Cu(OH)2. Кетоны окисляются в жестких условиях, реакции идут с разрывом С-С связи.Окисление - превращение, протекающее с увеличением степени окисления атома. Различают: (1) окислительное замещение (замена одного или нескольких атомов на более электроотрицательные), (2) окислительное присоединение (разрыв кратных связей и образование простых связей с более электроотрицательным элементом), (3) окислительное элиминирование (дегидрирование).
Слайд 35
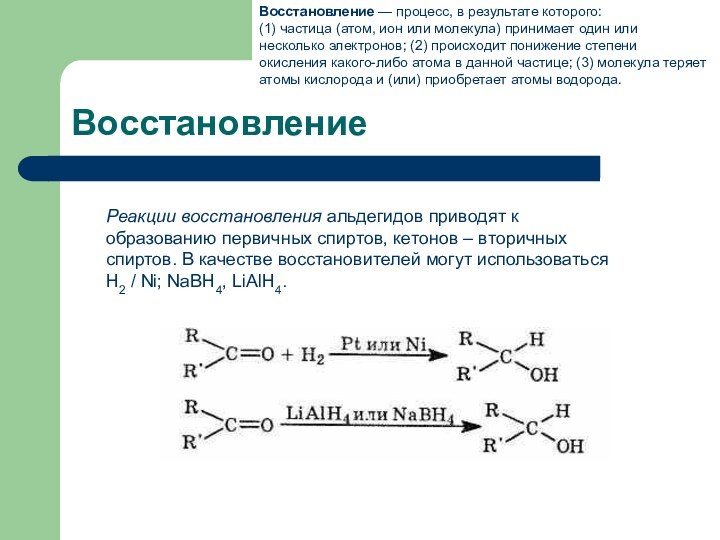
Восстановление
Реакции восстановления альдегидов приводят к образованию первичных спиртов, кетонов
– вторичных спиртов. В качестве восстановителей могут использоваться Н2 /
Ni; NaBH4, LiAlH4.Восстановление — процесс, в результате которого:
(1) частица (атом, ион или молекула) принимает один или несколько электронов; (2) происходит понижение степени окисления какого-либо атома в данной частице; (3) молекула теряет атомы кислорода и (или) приобретает атомы водорода.
Слайд 36
Реакция Каниццаро (диспропорционирования)
Реакции окисления-восстановления (диспропорционирования) -реакция Канниццаро, характерна для
альдегидов, не содержащих при α-атоме углерода водородных атомов. Одна
молекула альдегида восстанавливается в спирт за счет окисления второй молекулы в кислоту.
Слайд 37
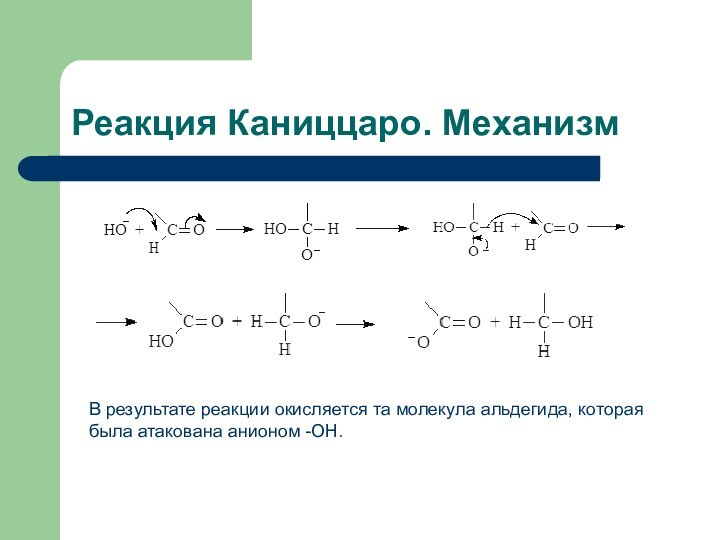
Реакция Каниццаро. Механизм
В результате реакции окисляется та молекула
альдегида, которая была атакована анионом -OH.
Слайд 38
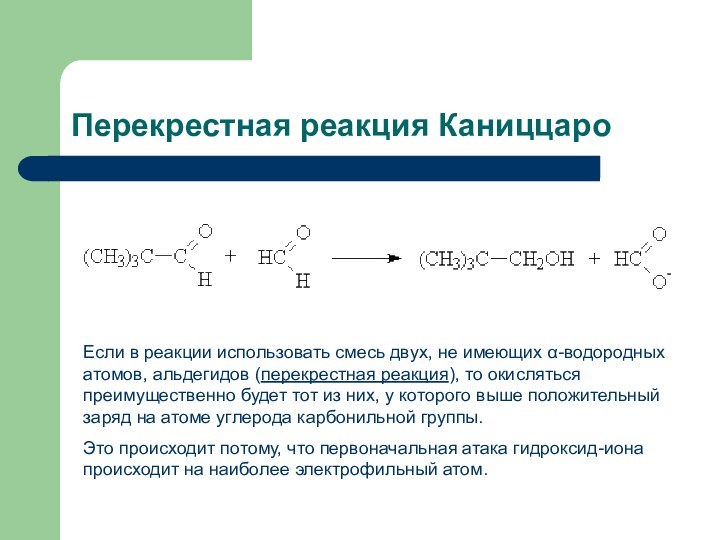
Перекрестная реакция Каниццаро
Если в реакции использовать смесь двух,
не имеющих α-водородных атомов, альдегидов (перекрестная реакция), то окисляться преимущественно
будет тот из них, у которого выше положительный заряд на атоме углерода карбонильной группы.Это происходит потому, что первоначальная атака гидроксид-иона происходит на наиболее электрофильный атом.