- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Марганец. Калий
Содержание
- 2. КАЛИЙ
- 3. Ка́лий — элемент главной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 19
- 4. Нахождение в природе В
- 5. Физические свойстваКалий — серебристое вещество с характерным блеском
- 6. Химические свойства Калий проявляет типичные
- 8. ПрименениеЖидкий при комнатной температуре сплав калия и натрия
- 9. Месторождения Крупнейшие месторождения калия находятся на
- 10. Калий- натриевый насосОбмен осуществляется при помощи
- 11. Он нормализует углеводный и солевой, а
- 12. Источник калия: шпинат, огурцы, морковь, лук,
- 13. МАРГАНЕЦ
- 14. Ма́рганец — элемент побочной подгруппы седьмой группы четвёртого периода периодической системы химических элементовД. И. Менделеева с атомным номером 25.
- 15. Химический символ MnАтомный номер 25Относительная атомная масса
- 16. ЭЛЕКТРОННОЕ СТРОЕНИЕ
- 17. ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ
- 19. Реагирует с соляной и серной кислотой:
- 20. С хлором, бромом и иодом марганец реагирует
- 21. Химические свойстваПри окислении на воздухе пассивируется. Порошкообразный
- 22. ТвёрдыйХрупкийСеребристо-белого цветаПроводит электрический токТемпература плавления 1245°С температура
- 23. пиролюзит MnO2 манганит MnO2·Mn(OH)2браунит Mn2O3 родохрозит MnCo3 псиломелан mMnO·MnO2·nH2Oи ряд других.МИНЕРАЛЫ МАРГАНЦА
- 24. 14-й элемент по распространённости на Земле, а
- 25. ПОЛУЧЕНИЕАлюминотермическим методом, восстанавливая оксид Mn2O3, образующийся при
- 26. Чёрная металлургия Производство ферритных материаловИзготовление реостатовТермоэлектрический материалПокрытия, обеспечивающие антикоррозионную защитуПРИМЕНЕНИЕ
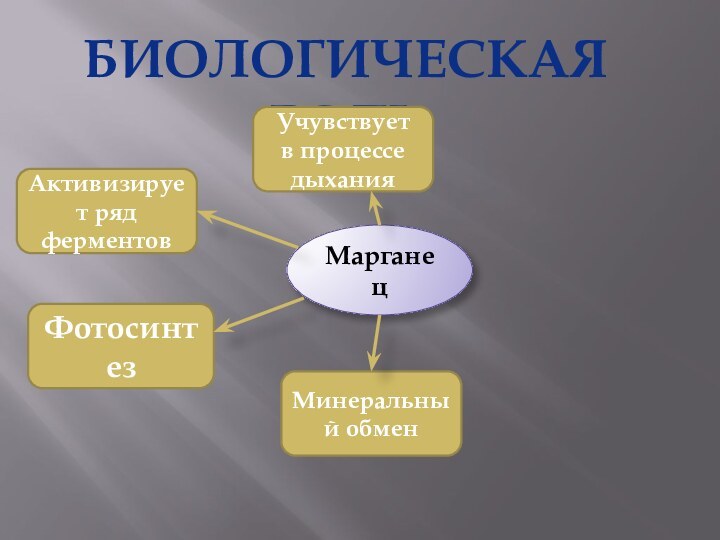
- 27. БИОЛОГИЧЕСКАЯ РОЛЬМарганецАктивизирует ряд ферментовФотосинтезМинеральный обменУчувствует в процессе дыхания
- 28. Скачать презентацию
- 29. Похожие презентации
КАЛИЙ


























Слайд 3
Ка́лий — элемент главной подгруппы первой группы, четвёртого периода периодической
системы химических элементов Д. И. Менделеева, с атомным номером 19
Слайд 4
Нахождение в природе
В свободном состоянии
не встречается. Породообразующий элемент входит в состав слюд, полевых
шпатов, сильвина KCl, сильвинита KCl·NaCl, карналлита KCl·MgCl2·6H2O, каинита KCl·MgSO4·6H2O, а также присутствует в золе некоторых растений в виде карбоната K2CO3 (поташ). Калий входит в состав всех клеток . Кларк калия в земной коре составляет 2,4 % (5-й по распространённости металл, 7-й по содержанию в коре элемент). Концентрация в морской воде 380 мг/л[3]
Слайд 5
Физические свойства
Калий — серебристое вещество с характерным блеском на
свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется
в ртути, образуя амальгамы.Калий активно взаимодействует с водой. Выделяющийся водород воспламеняется, а ионы калия придают пламени фиолетовый цвет. Раствор фенолфталеина в воде становится малиновым, демонстрируя щелочную реакцию образующегося KOH.
Калий образует кристаллы кубической сингонии, пространственная группа I m3m, параметры ячейки a = 0,5247 нм, Z = 2
Слайд 6
Химические свойства
Калий проявляет типичные металлические
свойства и очень химически активен, является сильным восстановителем. На
воздухе свежий срез быстро тускнеет из-за образования плёнок соединений (оксиды и карбонат). При длительном контакте с атмосферой способен полностью разрушиться. С водой реагирует со взрывом. Хранить его необходимо под слоем бензина, керосина или силикона, дабы исключить контакт воздуха и воды с его поверхностью. С Na, Tl, Sn, Pb, Bi калий образует интерметаллиды
Слайд 8
Применение
Жидкий при комнатной температуре сплав калия и натрия используется
в качестве теплоносителя в замкнутых системах, например, в атомных силовых установках
на быстрых нейтронах. Кроме того, широко применяются его жидкие сплавы с рубидием и цезием. Сплав состава: натрий 12 %, калий 47 %, цезий 41 % — обладает рекордно низкой температурой плавления −78 °C.Соединения калия — важнейший биогенный элемент и потому применяются в качестве удобрений.
Соли калия широко используются в гальванотехнике, так как, несмотря на относительно высокую стоимость, они часто более растворимы, чем соответствующие соли натрия, и потому обеспечивают интенсивную работу электролитов при повышенной плотности тока
Слайд 9
Месторождения
Крупнейшие месторождения калия находятся на территории Канады (производитель PotashCorp), России (ОАО
«Уралкалий», г.Березники, ОАО «Сильвинит», г. Соликамск, Пермский край, Верхнекамское месторождение калийных руд[4]), Белоруссии
(ПО «Беларуськалий», г. Солигорск, Старобинское месторождение калийных руд[5]).
Слайд 10
Калий- натриевый
насос
Обмен осуществляется при помощи специальных белков,
образующих в мембране так называемые каналы. На рисунке показана
работа такого канала (насоса), обеспечивающего движение ионов натрия и калия через клеточную мембрану.
Слайд 11
Он нормализует углеводный и солевой, а также
водно-солевой обмен в организме. Вот почему недостаток калия обязательно
скажется на вашей коже - появятся мешки под глазами, кожа начнет шелушиться и зудеть. Если чешутся ладони, не ломайте голову над тем, кому вы задолжали деньги. Причина, как утверждают специалисты, именно в недостатке калия. При этом возникают апатия, сонливость, потеря аппетита. Не доводите дело до аритмии, артериальной гипотонии или даже до сердечного приступа.
Слайд 12
Источник калия: шпинат, огурцы, морковь, лук, петрушка,
спаржа, хрен, одуванчик, чеснок, черная смородина, бананы, капуста, редис,
помидоры, курага, изюм, фасоль, бобы, ржаной хлеб, овсянка. Источник калия: шпинат, огурцы, морковь, лук, петрушка, спаржа, хрен, одуванчик, чеснок, черная смородина, бананы, капуста, редис, помидоры, курага, изюм, фасоль, бобы, ржаной хлеб, овсянка.Слайд 14 Ма́рганец — элемент побочной подгруппы седьмой группы четвёртого периода периодической системы химических
элементовД. И. Менделеева с атомным номером 25.
Слайд 15
Химический символ Mn
Атомный номер 25
Относительная атомная масса 54,9380
± 0,0001
Стабильный изотоп 55Mn
Электронное строение 1s2 2s2 2p6 3s2 3p6 3d5 4s2
Известно пять кристаллических модификаций марганца:
четыре с кубической решёткой (α-Mn, β-Mn, γ-Mn, δ-Mn) и одна с тетрагональной решёткойСлайд 19 Реагирует с соляной и серной кислотой: Mn+2HCl
-> MnCl2+H2
Mn+H2SO4 -> MnSO4+H2С концентрированной серной кислотой реакция идёт по уравнению:
С разбавленной азотной кислотой реакция идёт по уравнению:
В щелочном растворе марганец устойчив.
Слайд 20 С хлором, бромом и иодом марганец реагирует с
образованием дигалогенидов:
Mn + Cl2 = MnCl2При повышенных температурах марганец реагирует также с азотом, углеродом, бором, фосфором, кремнием. Например, при температуре 1200° С марганец сгорает в азоте:
3Mn + N2 = Mn3N2
Слайд 21
Химические свойства
При окислении на воздухе пассивируется. Порошкообразный марганец
сгорает в кислороде: Mn
+ O2 → MnO2Марганец при нагревании разлагает воду, вытесняя водород Mn + 2H2O →(t) Mn(OH)2 + H2↑
Слайд 22
Твёрдый
Хрупкий
Серебристо-белого цвета
Проводит электрический ток
Температура плавления 1245°С
температура кипения
2200°С
плотность 7,44 г/см3
На воздухе марганец покрыт
прочной оксидной
пленкой.ФИЗИЧЕСКИЕ СВОЙСТВА
Слайд 23
пиролюзит MnO2
манганит MnO2·Mn(OH)2
браунит Mn2O3
родохрозит MnCo3
псиломелан mMnO·MnO2·nH2O
и ряд
других.
МИНЕРАЛЫ МАРГАНЦА
Слайд 24 14-й элемент по распространённости на Земле, а после железа —
второй тяжёлый металл, содержащийся в земной коре.
В морской воде содержится около
1,0·10–8 % марганцаВ России является остродефицитным сырьём.
РАСПРОСТРАНЁННОСТЬ
В ПРИРОДЕ
Слайд 25
ПОЛУЧЕНИЕ
Алюминотермическим методом, восстанавливая оксид Mn2O3, образующийся при прокаливании
пиролюзита:
Восстановлением железосодержащих оксидных руд марганца коксом. Этим
способом в металлургии обычно получают ферромарганец (~80 % Mn).Чистый металлический марганец получают электролизом.
2Mn2(SO4)3 + 6H2O = 4Mn + 3O2 + 6H2SO4





























