условии, что массовая доля водорода в нем составляет 6,
316 %.
Составим формулу кристаллогидрата
фосфата натрия: Na3PO4 * n H2O
Пусть взяли 100 г кристаллогидрата.
Молярная масса кристаллогидрата:
(164 + 18n) г/ моль
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть

















Составим формулу кристаллогидрата
фосфата натрия: Na3PO4 * n H2O
Пусть взяли 100 г кристаллогидрата.
Молярная масса кристаллогидрата:
(164 + 18n) г/ моль
Запишем уравнение реакции:
K2CO3 + H2SO4=K2SO4 + CO2 + H2O
1 моль 1 моль 1 моль 1моль
Пусть смеси было 1 моль,
тогда n (HCOH) = х моль,
n (H2) = (1-х) моль.
М ср. смеси = 0,75 * 16 = 12 г/моль
CaO + H20 = Ca(OH)2
Пусть было n (CaO) = 1 моль
∆М = 74 – 56 = 18 (H20)
∆m = 56 * 0,3 = 16,8 г
∆m / ∆M = n(CaO) = 16,8 / 18 = 0, 93 моль
m (CaO) = 0,93 * 56 = 52,3 г
Ответ: не вся погасилась
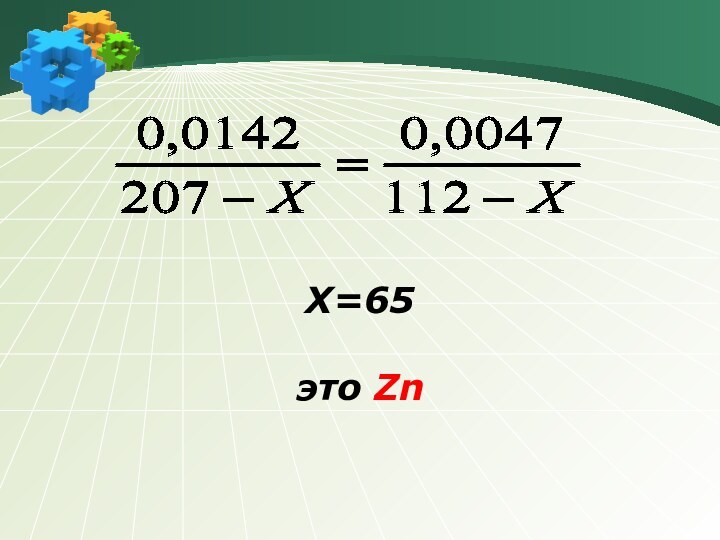
Пусть М (Ме) = х г/ моль
Напишем уравнения реакций