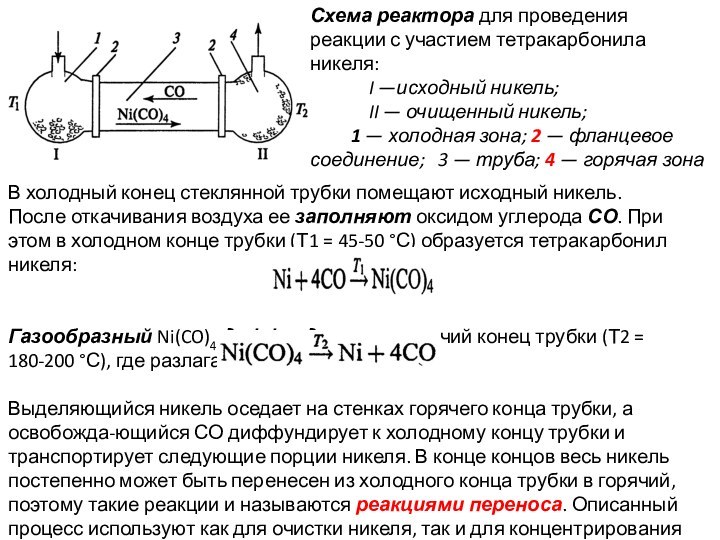
Слайд 2
Поэтому в большинстве случаев необходимо прибегать к отделению

мешающих элементов. При этом следует иметь в виду, что,
если какой-либо метод дает вполне удовлетворительные результаты при отделении того или иного элемента из некоторых смесей, то это вовсе не гарантирует получение правильных результатов этим же методом в других условиях. Невозможно испытать метод в каждой из тысяч возможных комбинаций, которые могут встретиться на практике; и совершенно невозможно разработать такой метод, который был бы применим во всех без исключения случаях.
При выборе метода разделения и последующего проведения самого процесса разделения выбранным методом необходимо соблюдать большую предусмотрительность не только с целью получения правильных результатов при определении компонентов исследуемого вещества, но и для того, чтобы вообще не «потерять» какой-либо из этих компонентов.
Методы разделения составляют основу методов концентрирования примесей («следов») элементов. При определениях следовых элементов используются высокочувствительные инструментальные методы, тем не менее, когда речь идет об определении одного атома примеси на миллиарды атомов элемента-основы. Например, в полупроводниковом кремнии или германии, нельзя проводить определение каким-либо одним методом, поскольку любой аналитический метод имеет предел, который достигнут для большинства элементов. -2-115-
Слайд 3
Прямые инструментальные методы часто не могут быть использованы

и при анализе многих сложных объектов либо вследствие негомогенного
(неравномерного) распределения компонентов в образце, либо в связи с трудностями градуировки, когда отсутствуют стандартные образцы известного состава. В таких случаях прибегают к концентрированию микрокомпонентов,
т. е. к отделению подходящим способом основной массы макрокомпонента либо элементов-примесей с последующим анализом полученного концентрата микрокомпонентов различными химическими и инструментальными методами.
Поэтому после получения лабораторной пробы и её разложения в большинстве случаев прибегают к концентрированию микрокомпонентов, то есть к отделению подходящим способом основной массы макрокомпонента, либо элементов-примесей с последующим анализом полученного концентрата на содержание микрокомпонентов различными химическими и инструментальными методами.
Таким образом, в основе операций разделения и концентрирования лежат одни и те же процессы, отличающиеся друг от друга лишь концентрациями разделяемых компонентов.
Разделение – это операция (процесс), в результате которой компоненты, составляющие исходную смесь, отделяются один от другого, причем их концентрации могут не отличаться, либо мало отличаться друг от друга (другими словами, разделяются компоненты с соизмеримыми концентрациями). -3-116-
Слайд 4
Концентрирование – это операция (процесс), в результате которой

повышается отношение концентрации или количества компонентов, содержащихся на уровне
примесей (микрокомпоненты), к концентрации или количеству основного компонента (макрокомпонент).
В последнем случае речь идет о разделении компонентов, резко различающихся по концентрации.
Для разделения и концентрирования используют чаще всего одни и те же методы, основанные на различии химических и физических свойств разделяемых компонентов (растворимости, сорбции, электрохимических характеристик, температур кипения, температур сублимации, агрегатного состояния и размера ионов, зарядов или масс и др).
В основу классификации методов концентрирования можно положить либо природу используемого процесса разделения, либо классифицировать их на основе числа и характера фаз, принимающих участие в процессе концентрирования. При первом подходе можно выделить в первую очередь две группы методов:
1) химические и физико-химические методы;
2) физические методы.
Однако деление это носит условный характер, поскольку между ними нет четких границ.
-4-117-
Слайд 5
Наиболее часто используют первую группу методов, к которой

относят отгонку после химических превращений, осаждение и соосаждение, пробирную
плавку, жидкостную экстракцию, ионный обмен, сорбцию, флотацию, химические транспортные реакции, частичное растворение матрицы, электрохимические методы (электролиз, вольтамперометрия).
Во вторую группу включают зонную плавку, испарение и сублимацию в вакууме, магнитную сепарацию ионов, дистилляцию, кристаллизацию, фильтрацию, гель-фильтрацию, ультрацентрифугирование.
Химические методы концентрирования имеют ряд недостатков. Во-первых, в связи с предельно низкими концентрациями и очень небольшими абсолютными количествами всегда имеется риск потери некоторого количества определяемого элемента. Во-вторых, при проведении химических операций основной опасностью является возможность внесения загрязнений. Источники загрязнений при химическом концентрировании весьма разнообразны: реагенты, посуда, аппаратура, воздух лабораторных помещений.
Большая величина поправки на холостой опыт, часто превышающая количество определяемого элемента, ограничивает чувствительность методов определения.
Однако благодаря постоянно растущему многообразию химических реакций, используемых в процессах концентрирования, новым температурным режимам, новой аппаратуре с применением таких перспективных материалов, как стеклоугаерод, фторопласт, высокотемпературная керамика и др., химические методы концентрирования не утрачивают своего значения. -5-118-
Слайд 6
Физические методы
концентрирования микропримесей характеризуются отсутствием или очень малой величиной поправки
на холостой опыт.
Но обычно методы разделения и концентрирования классифицируют на основе числа и характера фаз, участвующих в этих процессах.
Наибольшее значение имеют
методы, основанные на распределении вещества между двумя фазами
так, что одна из фаз становится концентратом микрокомпонентов
Вещество может существовать в трех фазах (состояниях): твердое вещество, жидкое и газообразное.
Поэтому различают три основные группы методов разделения и концентрирования:
выделение одного или нескольких компонентов в твердую фазу,
в жидкую и в газообразную.
1-я группа: Методы разделения, основанные
на равновесии между твердой и жидкой фазами.
Наиболее известны и чаще применяются:
– осаждение и соосаждение,
– адсорбционная и ионообменная хроматография,
– электролиз на твердых электродах,
– метод зонной плавки.
Слайд 7
2-я группа:
Методы разделения, основанные
на равновесии между двумя

жидкими фазами:
– экстракция органическими растворителями,
– распределительная хроматография и
– электролиз на ртутном катоде.
3-я группа:
Методы разделения, основанные
на удалении одного из компонентов в виде газа.
Эта группа методов имеет важное, хотя и ограниченное значение. Сюда относятся определения влаги в различных материалах, карбонатов отгонкой СО2, а также отделение кремния в виде фторида и др.
Каждая из названных групп методов может включать как химические, так и физические методы концентрирования.
Однако известны также методы, основанные на разделении компонентов в одной фазе: электродиализ, электрофорез, диффузионные и термодиффузионные методы. Эти методы не вполне подходят под данную классификацию. Однако если представить себе, что компоненты системы под воздействием приложенной извне энергии разделяются на две части, которые могут быть изолированы, например, с помощью полупроницаемой мембраны при диализе, то и здесь можно условно говорить о распределении компонентов между двумя фазами. -7-120-
Слайд 8
Рассмотрим специфические определения.
Индивидуальное и групповое концентрирование
Во многих случаях

при анализе необходимо проводить многоэлементные определения (определение примесей тяжелых
металлов в различных объектах; определение вредных примесей и легирующих микрокомпонентов в электронных материалах. Перед таким определением необходимо сконцентрировать сразу группу определяемых элементов.
Однако не всегда можно за один аналитический прием охарактеризовать состав вещества. К тому же очень нужны и одноэлементные определения (определение урана или золота в рудах и концентратах, ртути в воздухе помещений, дочернего элемента в материнском и др.). К сожалению, большинство одноэлементных методов, например спектрофотометрический и люминесцентный анализ, потому и являются одноэлементными, что присутствие нескольких компонентов в пробе искажает результаты определения или вообще не позволяет установить концентрацию нужного микрокомпонента.
Следовательно, возникает необходимость устранить помехи, связанные с многоэлементностью пробы, и повысить избирательность определения: маскировать матричные и другие мешающие компоненты, изменить степень окисления элемента матрицы или микрокомпонента, т. е. создать условия, в которых матрица и прочие микрокомпоненты не влияют на результаты. Такие условия обеспечиваются концентрированием.
-8-121-
Слайд 9
Таким образом, практика химического анализа требует от методов

концентрирования решения проблемы как группового, так и индивидуального выделения
микрокомпонентов.
Индивидуальное концентрирование – это процесс, в результате которого из образца выделяется один микрокомпонент или последовательно несколько микрокомпонентов.
Групповое концентрирование – это процесс, при котором за один прием выделяется несколько микрокомпонентов.
Групповое концентрирование удобно для всех многоэлементных методов определения (атомно-эмиссионный, рентгенофлуоресцентный, масс-спектрометрия и т.д.), индивидуальное же – для одноэлементных (фотометрия, флуориметрия, атомно-абсорбционная спектрофотометрия).
Индивидуальное концентрирование – это более тонкий и сложный процесс. Исследователю приходится оперировать не только с различиями свойств микрокомпонентов и матрицы; необходимо одновременно использовать различия в свойствах микрокомпонентов или создавать такие различия искусственно.
Избирательность концентрирования повышается, если оно является многоступенчатым. В этом отношении хорошо зарекомендовали себя различные хроматографические методы и зонная плавка. -9-122-
Слайд 10
Абсолютное и относительное концентрирование
Различают абсолютное и относительное концентрирование.

Абсолютное концентрирование –это
операция, в результате которой микрокомпоненты переходят из большой массы образца в малую; при этом повышается концентрация микрокомпонентов. Примером может служить упаривание матрицы при анализе вод, кислот и органических растворителей.
Относительное концентрирование, называемое также обогащением, – это операция, в результате которой увеличивается соотношение между микрокомпонентом и главными мешающими макрокомпонентами, т. е. между элементом-примесью в концентрате и элементом-основой. К последней в этом случае не относят растворитель.
Относительное концентрирование можно рассматривать как вариант разделения, с тем отличием, что исходные концентрации компонентов здесь резко различаются. Главная цель относительного концентрирования –замена матрицы, затрудняющей анализ, подходящим коллектором. Относительное концентрирование используют при анализе чистых веществ, а также металлов и сплавов, в ряде случаев при анализе минерального сырья.
На практике как абсолютное, так и относительное концентрирование в чистом виде встречается редко, обычно их комбинируют: заменяют матричные элементы на иную органическую или неорганическую матрицу и «сжимают» концентрат микрокомпонентов до небольшой массы дополнительным воздействием, например простым упариванием. -10-123-
Слайд 11
Так, упаривание кислоты приводит не только к уменьшению

объема анализируемой пробы, но и к повышению концентрации элемента-примеси
по отношению к концентрации кислоты; точно так же при концентрировании методом соосаждения решается задача не только разделения элемента-примеси и элемента-основы, но и переведения всех примесей в концентрат.
Удаление матрицы и выделение микрокомпонентов
Концентрирование может быть осуществлено двумя способами:
– удалением матрицы и
– выделением микрокомпонентов.
Под выделением понимают процесс, в котором нужные компоненты выделяют в самостоятельную фазу или часть фазы. Оба способа с успехом используют на практике. Трудно отдать предпочтение одному из этих вариантов вообще, безотносительно к объекту анализа и методу последующего определения.
Выбор приема работы в большой степени зависит от природы анализируемого объекта. Если матрица простая (содержит один-два элемента), легче удалить именно матрицу: в этом случае отделение матрицы удобно в сочетании с многоэлементными методами определения, например с атомно-эмиссионным спектроскопией. Особенно часто удаление матрицы используют в анализе металлов высокой чистоты. Если же основа многоэлементная (сложные минералы, сплавы, почвы), выделяют микрокомпоненты. -11-124-
Слайд 12
Выбор зависит также от используемого метода концентрирования. Например,

соосаждение удобнее для выделения микрокомпонентов, чем для удаления матрицы,
так как при этом микрокомпоненты могут частично соосаждаться с матрицей. Испарение удобно для отделения матрицы сравнительно простых и однородных легколетучих объектов: природных вод, летучих галогенидов, кислот, органических растворителей.
Для группового концентрирования используют как удаление матрицы, так и выделение микрокомпонентов; для избирательного концентрирования предпочтительно выделение микрокомпонентов. По сравнению с выделением микрокомпонентов удаление матрицы, как правило, связано с бóльшими расходами реактивов, времени, с потерями концентрируемых микрокомпонентов.
Количественные характеристики концентрирования
Каждый метод концентрирования имеет свои количественные характеристики. При описании любого метода концентрирования используют по крайней мере три величины: степень извлечения, коэффициент концентрирования, коэффициент разделения.
Степень извлечения R – это безразмерная величина, показывающая, какая доля от абсолютного количества микрокомпонента сосредоточена в концентрате:
(здесь qK и qпр — абсолютные количества микрокомпонента
в концентрате и пробе). -12-125
Слайд 13
Степень извлечения чаще выражают в процентах:
Степень извлечения обычно

составляет менее 100% (или менее 1, если не переводят
в проценты), поскольку микрокомпонент может теряться на стадиях разложения пробы и концентрирования вследствие испарения или неполного отделения, неполного разложения пробы, неаккуратных действий экспериментатора и значительной сорбции микрокомпонента стенками посуды и аппаратуры.
Как правило, при работе с низкими концентрациями опасность потерь возрастает. В неорганическом анализе в большинстве случаев необходимо достигать степени извлечения микрокомпонентов более чем 95% или, по крайней мере, 90%.
Коэффициент концентрирования, или фактор обогащения, К показывает, во сколько раз изменилось отношение абсолютных количеств микрокомпонента и матрицы в концентрате и в исходной пробе:
где Qк и Qпр – абсолютные количества матрицы в
концентрате и пробе,
qк и qпр — абсолютные количества
микрокомпонента там же,
Rмикр и Rматр — степень извлечения
микрокомпонента и матрицы.
-13-126-
Слайд 14
Таким образом, коэффициент концентрирования можно выразить через отношение
степеней извлечения микрокомпонента и матрицы. При любом практически полезном
концентрировании Rмикр = 1, так что
Если степень извлечения равна 1 (R = 100%), формула упрощается:
Коэффициент разделения S есть величина, обратная коэффициенту концентрирования:
Наряду с разделением компонентов и концентрированием микрокомпонентов важное значение имеет очистка – операция, при которой нужно сохранить основу (макрокомпонент), отбросив примеси.
Рассмотрим 1-ю группу методов:
-14-127-
Слайд 15
Методы разделения, основанные на равновесии
между твердой и

жидкой фазами
1) Метод осаждения
Метод осаждения – наиболее простой классический
метод разделения, основанный на равновесии между твердой и жидкой фазами.
Он сводится к тому, что в определенных условиях искомый компонент выделяется в осадок и таким образом отделяется от сопутствующих компонентов.
Метод имеет два явных недостатка:
1) вследствие частичной растворимости осадков искомый компонент теряется;
2) происходит соосаждение других («ненужных») элементов, присутствующих в анализируемом объекте.
При осаждении элементы только перераспределяются между раствором и осадком, причем каждая фаза (раствор и осадок) всегда содержит смесь всех присутствующих в пробе элементов. Поэтому этот метод применяют для более грубого (по сравнению с другими методами) разделения элементов.
Выделение в осадок того либо иного компонента разделяемой смеси осуществляется действием реагента-осадителя, при выборе которого предъявляется, прежде всего, требование об избирательности действия, т. е. он должен образовывать осадок только с определяемым ионом.
-14-128-
Слайд 16
Однако вследствие недостаточной избирательности большинства осадителей для достижения

необходимого эффекта разделения обращают внимание на соблюдение определенных условий,
регулирующих процесс осаждения, из которых наиболее важными являются произведение растворимости (ПР), рН среды и использование комплексообразующих реагентов.
Большинство катионов металлов осаждают в виде труднорастворимых солей слабых кислот и гидроксидов. Для разделения и определения многих цветных металлов при анализе руд, сплавов и других объектов широко используют осаждение в виде сульфидов из-за их крайне малой растворимости.
Наряду с осаждением сульфидов для отделения многих катионов металлов используют осаждение в виде карбонатов (таким образом достигается отделение почти всех катионов металлов от катионов щелочных металлов), фосфатов, фторидов, оксалатов и др.
Для разделения элементов широко применяют осаждение гидроксидов. При этом используется либо амфотерность некоторых гидроксидов, либо различие в растворимости. Так, железо отделяют от V, Мо и Аl, обрабатывая раствор избытком едкой щелочи. При этом Fe(OH)3 выпадает в осадок, а остальные элементы вследствие амфотерного или кислотного характера их гидроксидов остаются в растворе в виде ионов VO3–, MоO42–, АlO2–. Различие в растворимости гидроксидов дает возможность осуществить разделение соответствующих катионов регулированием рН раствора. -15-129-
Слайд 17
Специфичность действия реагентов-осадителей может быть повышена введением в
раствор комплексантов, связывающих в комплекс мешающие ионы (маскировка).
Очень удобны
для переведения в осадок различных элементов органические реагенты-осадители, которые обладают рядом преимуществ перед неорганическими осадителями:
1) низкая растворимость в воде образующихся осадков, что
позволяет выделять элементы из весьма разбавленных растворов;
2) меньшая степень соосаждения посторонних элементов;
3) легкая фильтруемость осадков;
4) большая специфичность, обусловленная наличием в молекуле
реагента особых реакционных групп.
-16-130-
Слайд 18
2) Метод соосаждения
При выделении определяемого элемента в виде

труднорастворимого соединения в осадок обычно также переходят в большем
или меньшем количестве компоненты, которые в данных условиях сами по себе не осаждаются. Это явление называется соосаждением.
Например, если на раствор, содержащий смесь ВаСl2 с FeCl3, подействовать серной кислотой, то следовало бы ожидать, что будет осаждаться только BaSO4, так как соль Fe2(SO4)3 растворима в воде. Однако в действительности вместе с BaSO4 частично осаждается и Fe(III), в чем можно убедиться, прокалив отфильтрованный осадок: остаток оказывается не чисто белым (BaSO4), а окрашенным в коричневатый цвет из-за присутствия оксида железа, образовавшегося при прокаливании:
Fe2(S04)3 = Fe2O3 + 3SO3.
Увлечение осадком посторонней растворимой примеси может быть обусловлено различными причинами. При этом наиболее важное значение имеют явления адсорбции и окклюзии.
При адсорбции загрязняющее вещество находится на поверхности твердой фазы, которая называется в этом случае адсорбентом. Количество адсорбированного вещества зависит от величины поверхности адсорбента, температуры, природы адсорбируемых ионов и ряда других факторов.
-17-131-
Слайд 19
При окклюзии соосажденные примеси находятся внутри частиц осадка

вследствие образования химических соединений между осадком и соосаждаемой примесью,
или вследствие явления внутренней адсорбции в процессе формирования осадка, или же вследствие изоморфизма (образование смешанных кристаллов ионами с одинаковым координационным числом и близкими радиусами).
В приведенном примере соосаждение играет отрицательную роль и приводит к погрешностям анализа, т. е. к получению неправильных результатов. Однако соосаждение может быть также полезным как метод концентрирования микрокомпонентов.
В аналитической практике нередки случаи, когда концентрация определяемого компонента в растворе настолько мала, что осаждение в его простой форме обычно нельзя применить, даже если осадок имеет очень низкую растворимость (так как при такой концентрации не достигается ПР соответствующего осадка); может также образоваться коллоидный раствор, из которого выделить твердую фазу (осадок) затруднительно. Именно в таких случаях полезно применять соосаждение определяемого микрокомпонента пробы с каким-либо подходящим коллектором (коллектор, или носитель, - малорастворимое соединение, с которым соосаждаются концентрируемые вещества). Таким образом,
соосаждение – это процесс, в котором микрокомпонент увлекается из
раствора осаждающимся макрокомпонентом-носителем. -18-132-
Слайд 20
Эти процессы имеют очень важное значение в химии

и технологии радиоактивных элементов, когда они находятся в растворах
в столь малых концентрациях (менее 10–10 моль/л), что не могут осаждаться с образованием собственной твердой фазы, т.к. не достигается величина произведения растворимости (ПР) даже для самых труднорастворимых соединений. В этом случае микрокомпонент выделяют из раствора соосаждением с носителем, концентрация которого в растворе достаточна для образования твердой фазы. Чаще всего в качестве носителя служит элемент, химические свойства которого аналогичны, но не тождественны таковым для изучаемого микрокомпонента.
Основной целью применения носителей-аналогов (т.е. специфических неизотопных носителей) является установление химической формы и выделение исследуемого микрокомпонента (часто с последующим отделением от носителя). Применяются также соединения элементов, свойства которых значительно отличаются от свойств соответствующих соединений изучаемого микрокомпонента (т.е. неспецифические неизотопные носители).
В первом случае соосаждение является результатом объемного распределения микрокомпонента между осадком и раствором, т.е. происходит сокристаллизация.
Во втором случае происходит поверхностно-объемное распределение, так называемое адсорбционное соосаждение. -19-133-
Слайд 21
Сокристаллизация – это процесс соосаждения микрокомпонента с кристаллическими

осадками, при котором микрокомпонент распределяется по всему объему твердой
фазы, участвуя в построении кристаллической решетки макро-компонента. При этом образуются смешанные кристаллы (твердые растворы). Это не хаотичная смесь ионов, атомов, молекул, а все они являются равноправными участниками в построении кристаллических решеток. Сокристаллизация имеет большое значение для отделения и концентрирования радиоактивных элементов, которые, как правило, присутствуют в качестве микрокомпонентов. Методом соосаждения были впервые выделены Ra и Po, продукты деления урана – «осколки» и плутоний Pu (атомный проект).
Адсорбционное соосаждение заключается в переносе вещества (ионов, молекул, коллоидных частиц) из раствора на поверхность твердой фазы, называемой адсорбентом или неспецифическим неизотопным носителем, в то время как при сокристаллизации микро- и макрокомпоненты должны находиться в ионной форме. Если при сокристаллизации микрокомпонент распределяется между раствором и объемом осадка-носителя, участвуя в построении кристаллической решетки, то при адсорбционном соосаждении имеет место поверхностно-объемное распределение за счет адсорбции.
Для выделения микропримесей необязательно вводить в раствор посторонний элемент. Коллектором может служить осадок, образующийся при частичном выделении элемента-матрицы. Этот прием особенно удобен при использовании гидроксидов в качестве коллекторов. -20-134-
Слайд 22
Коллекторами обычно служат различные осадки с хорошо развитой

поверхностью (гидроксиды алюминия и железа, диоксид марганца, фосфат титана
и др.).
Особенно удобны в качестве коллекторов для выделения следов металлов органические соосадители, с которыми микрокомпоненты соосаждаются в виде различных соединений (ионных ассоциатов, хелатов и др.). Применение органических коллекторов позволяет практически полностью извлекать следы элементов из чрезвычайно разбавленных растворов. Извлечение может быть как групповым, так и высокоизбирательным в зависимости от выбранных условий и природы органического соосадителя.
Органические соосадители выгодно отличаются от неорганических тем, что коллектор легко может быть удален озолением осадка или кислотной минерализацией («мокрое сожжение»). Последний метод нельзя использовать в случае соосаждения летучих элементов, таких как В, Ge, Re, Si, Se, Os и др., во избежание потерь при озолении.
Метод соосаждения микрокомпонентов с коллектором используют очень часто при анализе пресных, морских и сточных вод, металлов высокой чистоты и неорганических соединений. Особенно важное значение имеет метод соосаждения для определения малых количеств различных рассеянных и редких элементов в минералах и горных породах. -21-135-
Слайд 23
По степени абсолютного концентрирования, простоте и аппаратурному оформлению
соосаждение является одним из лучших методов.
Коэффициент концентрирования тяжелых
металлов при содержании в пробе 10–9-10–6 г/л достигает 103, степень извлечения составляет >90%. При этом методы осаждения и соосаждения используются только для получения аналитического концентрата, а само определение микрокомпонента выполняется другими методами, чаще всего фотометрическим, вольтамперометрическим или атомно-эмиссионным. В последние годы соосаждение применяется, как правило, в комбинации с такими методами количественного анализа, в основу которых положено получение аналитического сигнала от твердых образцов, например с атомно-эмиссионным, рентгенофлуоресцентным или масс-спектральным.
Недостатком метода соосаждения является длительность процесса.
В радиохимии методы соосаждения часто используют для выделения радионуклидов.
-22-136-
Слайд 24
3) Сорбционные методы
Сорбционные методы концентрирования основаны на различном

поглощении растворенных веществ, газов и паров твердыми или жидкими
поглотителями (сорбентами). В отличие от соосаждения здесь поглощение происходит уже на готовом сорбенте.
В процессе сорбции вещество распределяется между двумя несмешивающимися фазами: твердое тело – жидкость, твердое тело – газ, жидкость – газ. Чаще всего сорбцию проводят в системе твердое тело –жидкость.
По различию в механизме взаимодействия вещества с сорбентом выделяют физическую (или молекулярную) сорбцию и хемосорбцию.
При физической сорбции взаимодействие между сорбентом и сорбируемым веществом (сорбатом) обусловлено межмолекулярными силами, причем различают адсорбцию (поглощение вещества поверхностью сорбента) и абсорбцию (поглощение вещества всей массой сорбента).
Хемосорбция — это поглощение, основанное на протекании химических реакций между сорбентом и сорбируемым веществом с образованием химических соединений (ионный обмен, комплексообразование, окисление-восстановление и др.). Однако на практике трудно встретить в чистом виде любой из механизмов сорбции: обычно они действуют в сочетании. Так, адсорбция обычно предшествует хемосорбции. При концентрировании микрокомпонетов наибольшее распространение получили адсорбционные и хемосорбционные методы, причем среди последних – ионный обмен. -23-137-
Слайд 25
Процесс сорбции можно осуществлять различными способами. С этих

позиций различают статический, динамический и хроматографический способы, причем в
каждом из них используются оба механизма сорбции.
Статический (или одноступенчатый) способ — это однократное распределение компонентов между фазами. При концентрировании в статических условиях сорбцию микрокомпонентов выполняют обычным погружением сорбента в раствор пробы. Для ускорения достижения равновесия раствор перемешивают механически или с помощью ультразвука. Механизм концентрирования – молекулярный или хемосорбционный, в частности ионообменный, основанный на обмене ионов раствора на ионы того же знака заряда, входящие в состав ионообменника (ионита).
Для разделения компонентов смеси статическим способом необходимо, чтобы они сильно различались по способности распределяться между фазами и при установлении равновесия одни компоненты преимущественно находились в одной фазе, а другие – в другой, т. е. разница в коэффициентах распределения разделяемых компонентов должна быть большой.
Коэффициент распределения определяется как отношение равновесной концентрации компонента в одной фазе (например, в твердой) к равновесной концентрации того же компонента в другой фазе (например, в жидкости):
D = C1 / C2 где D – коэффициент распределения, С1 –равновесная концентрация компонента в одной фазе (1), С2 —равновесная концентрация того же компонента в другой фазе (2). -24-138-
Слайд 26
Методами сорбции можно извлекать как микрокомпоненты, так и

матрицу. Для конечного определения сорбируемых микрокомпонентов сорбент отделяют от
раствора декантацией или фильтрованием и после промывания (для удаления посторонних элементов) десорбируют микрокомпоненты.
Динамический и хроматографический способы основаны на многократном распределении компонентов системы между фазами.
Динамический вариант селективного концентрирования микрокомпонентов с использованием механизмов молекулярной сорбции и хемосорбции осуществляют фильтрованием раствора анализируемой пробы через тонкий слой мелкозернистого сорбента, нанесенный на какую-либо подложку, слой бумаги, обладающей сорбционными свойствами, или специально изготовленную мембрану. Это очень простой прием концентрирования, но его использование возможно только в случае существенно различающихся коэффициентов распределения разделяемых компонентов и быстрого протекания самого процесса сорбции.
Хроматографические методы, также являющиеся многоступенчатыми, используют в случаях, когда коэффициенты распределения компонентов смеси между двумя фазами различаются мало, и поэтому разделить их одноступенчатым способом не удается.
-25-139-
Слайд 27
Хроматография — это очень распространенный способ разделения и

концентрирования веществ, основанный на различии в их коэффициентах распределения
между двумя фазами, одна из которых неподвижна, а другая направленно движется относительно первой (вдоль колонки или тонкого слоя неподвижной фазы).
Для концентрирования микрокомпонентов используют различные сорбенты, которые наряду с хорошей поглотительной способностью и избирательностью должны легко регенерироваться и быть химически и механически устойчивыми. Из неорганических сорбентов применяются гидратированные оксиды, сульфиды, фосфаты поливалентных металлов, например гидратированные диоксиды и фосфаты титана, циркония, олова и кремния, сульфид меди, соли гетерополикислот. Механизм действия этих веществ различен, но наиболее часто сорбция обусловлена ионным обменом и комплексообразованием.
Достоинствами неорганических сорбентов являются устойчивость к нагреванию, действию ионизирующих излучений, органическим растворителям, нередко высокая избирательность.
Из их недостатков можно отметить не всегда достаточно высокую емкость и плохую воспроизводимость сорбционных свойств от партии к партии. -26-140-
Слайд 28
Неорганические сорбенты используют, например, при выделении микроколичеств Ga,

In, Ge, Mo, V, W и U из морской
воды (сорбция на гидратированном оксиде титана с последующим анализом концентрата атомно-эмиссионным методом) и микроколичеств Р, As и W при анализе вод и донных отложений (сорбция на оксид алюминия с последующим определением нейтронно-активационным методом), а также для извлечения из воздуха паров ртути (сорбция на сульфиде свинца и определение ртути атомно-эмиссионным методом с полым железным катодом).
Из органических сорбентов широкое применение нашли активные угли, обычная и модифицированная целлюлоза, хелатообразующие сорбенты, и, конечно же, синтетические иониты.
Активные угли имеют чрезвычайно развитую микро- и макропористость; их получают выжиганием древесины или костей животных без доступа воздуха. На активных углях преобладают процессы молекулярной адсорбции (хотя играет роль и сорбция по другим механизмам, например ионный обмен). Система включает адсорбент — вещество с развитой удельной поверхностью и адсорбат — вещество, молекулы которого поглощаются. При адсорбции вещество концентрируется на поверхности раздела фаз под действием молекулярных сил поверхности адсорбента. Физическая адсорбция обычно легко обратима. Активный уголь используют для концентрирования серебра и золота при их определении в горных породах и рудах и т.д.
-27-141-
Слайд 29
В практике разделения и концентрирования элементов широко используются

в качестве сорбентов природные и синтетические полимеры — высокомолекулярные
органические (или неорганические) соединения. Из подходящих для этих целей природных полимеров следует назвать полисахарид целлюлозу (или растительную клетчатку). Хлопок представляет собой почти чистую целлюлозу. Целлюлозу применяют для концентрирования Pt-металлов из разбавленных растворов.
В хроматографическом способе сорбции в качестве сорбентов наиболее широко применяют синтетические полимеры органической природы (смолы), работающие по ионообменному механизму (иониты), т. е. причиной сорбции здесь является хемосорбция.
Ионообменная хроматография основана на разделении ионов с помощью природных и синтетических ионообменников (ионитов). Эти иониты являются не только как физические адсорбенты, но и как химические реагенты.
Ионный обмен – это процесс стехиометрического обмена ионов
одного знака между ионитом и раствором.
Ионитами (ионообменными смолами) называют органические или неорганические вещества, практически нерастворимые в воде и других растворителях, содержащие активные (ионогенные) группы с подвижными ионами и способными обменивать эти ионы в эквивалентном количестве на ионы других электролитов (поглощаемые ионы). -28-142-
Слайд 30
В зависимости от характера введенных ионообменных (ионогенных) групп
все иониты делятся на 3 группы:
– катиониты – сорбенты, содержащие в своей структуре кислотные группы, т.е. сорбенты, обладающие свойствами кислот и способные к обмену катионов;
– аниониты – сорбенты, содержащие в своей структуре оснóвные группы, т.е. сорбенты, обладающие свойствами оснований и способные к обмену анионов;
– амфотерные иониты (амфолиты) – в зависимости от рН раствора диссоциируют как кислотные или основные иониты.
Химические формулы катионита и анионита обычно записывают как RH и ROH; тогда уравнение катионного обмена в общем виде можно представить в виде реакции:
где R – сложный органический радикал (матрица или каркас полимера),
Мn+ – катион металла в степени окисления п+.
Для анионита процесс обмена схематически можно записать как
где Аn– – анион n-основной кислоты.
-29-143-
Слайд 31
Обратимый стехиометрический эквивалентный обмен ионов из раствора на

ионы того же знака, входящие в состав ионита, происходит
при пропускании анализируемого раствора электролита через ионит, помещенный в длинную цилиндрическую трубку (колонку). Разделение ионов достигается за счет их различного сродства к иониту, из-за чего они перемещаются по колонке с различной скоростью. Одни компоненты остаются в верхнем слое сорбента, другие, имеющие меньшую степень взаимодействия с сорбентом, оказываются в нижней части колонки; третьи же покидают колонку вместе с подвижной фазой. В результате получается хроматограмма – закономерное распределение веществ по зонам в соответствии с их сорбируемостью.
Поглощенные вещества извлекают из сорбента при пропускании через него какого-либо подходящего растворителя (элюента). При этом происходит обратный процесс – десорбция, а поглощенные компоненты вновь переходят в жидкую фазу (элюат). Элюент должен обладать селективностью к тому или иному иону в разделяемой смеси. Подбирая состав и кислотность элюента, можно последовательно удалить с колонки все сорбированные ионы. Для этого часто используют способность разделяемых ионов при определенном рН образовывать комплексы различной устойчивости.
Динамичность процесса сорбции, обеспечиваемая многократностью актов сорбции-десорбции разделяемых компонентов в потоке подвижной фазы, обусловливает более высокую эффективность хроматографического способа по сравнению со способами сорбции в статических условиях и позволяет без особых затруднений достичь тонкого разделения сложных смесей. -30-144-
Слайд 32
Вместе с тем сорбцией веществ из большого объема

раствора и десорбцией их в меньший объем растворителя достигается
концентрирование сорбированных веществ.
Эффективность разделения двух ионов характеризуется коэффициентом разделения, определяемым как отношение коэффициентов распределения для одинаковых условий этих двух ионов
S = D1/D2.
Если S = 1, то разделение ионов невозможно. Для разделения необходимо, чтобы коэффициенты распределения D1 и D2 достаточно сильно различались.
Увеличить различие в сорбционном поведении разделяемых элементов часто позволяет перевод одного из разделяемых элементов в анионный комплекс, в то время как второй элемент должен остаться в форме простого катиона. Особенно часто для этих целей используют органические комплексанты.
На коэффициент разделения влияют как химические (рН раствора, природа разделяемых ионов и их концентрация в растворе, химический состав ионита и др.), так и чисто физические факторы (скорость протекания раствора через колонку, размер зерен ионита, высота колонки, температура и т. д.).
Ионообменная хроматография используется преимущественно для целей разделения, однако этот метод находит полезное применение и для абсолютного концентрирования следов ионов из очень разбавленных растворов, особенно из водно-органических.
-31-145-
Слайд 33
При пропускании больших объемов разбавленных растворов через слои

ионита и последующем извлечении поглощенного вещества малым объемом растворителя
(элюента) возможно повышение концентрации вещества в 200-500 раз. В аналитическом контроле этот прием часто используют для концентрирования примесей перед их определением в сверхчистых материалах (например, для извлечения урана и радиоактивных изотопов, а также для извлечения цветных металлов при промышленном получении редкоземельных элементов (РЗЭ), в том числе при переработке руд лантаноидов.
Аналитическое и технологическое использование ионообменной хроматографии многообразно. Этим методом разделяют очень близкие по свойствам элементы, такие как РЗЭ, трансурановые, элементы-двойники (например, Zr-Hf), удаляют мешающие ионы (очистка воды), проводят концентрирование ценных микрокомпонентов из природных и промышленных вод. Ионообменную хроматографию широко используют при анализе сплавов, руд редких и цветных металлов и продуктов их переработки, отходов, содержащих рассеянные элементы, а также сточных вод предприятий.
Ограничением использования ионнообменного метода является необходимость проведения большой подготовительной работы с применением довольно больших количеств кислот, щелочей и других реагентов, в результате чего в растворе накапливается много посторонних веществ, взаимодействующих с ионитами и, кроме того, влияющих на кислотность раствора и на условия комплексообразования. -32-146-
Слайд 34
Тем не менее метод ионообменной хроматографии интенсивно развивается

и постоянно расширяет границы применения благодаря созданию новых, избирательно
действующих ионитов и разработке автоматизированных способов разделения и концентрирования элементов.
В методе осадочной хроматографии для разделения веществ используют различную растворимость осадков, получаемых в результате реакции между разделяемыми ионами и осадителем. Твердый осадитель смешивают с мелко истертым носителем, либо последний пропитывают раствором осадителя, после чего смесь помещают в колонку. При пропускании через колонку раствора смеси разделяемых ионов они осаждаются на носителе в виде труднорастворимых осадков в порядке возрастания их растворимости (сверху вниз) . В первую очередь (вверху колонки) осаждается наименее растворимое из соединений, за ним – следующее по растворимости и т. д. Успешное разделение смеси достигается многократным повторением в ходе хроматографирования процесса образования осадка и его растворения. По механизму сорбции осадочная хроматография относится к хемосорбционной хроматографии. Процессы, протекающие при пропускании через колонку раствора, содержащего смесь двух веществ АХ и ВХ, реагирующих с осадителем CY с образованием осадков AY и BY, можно выразить схемой:
-33-147-
Слайд 35
Если осадки AY и BY окрашены, то расположение

осадков в колонке можно определить визуально и таким образом
оценить качественный состав анализируемого раствора.
При промывании осадочной хроматограммы подходящим растворителем, который хорошо растворяет одни осадки и не растворяет другие, отдельные зоны последовательно вымываются из колонки, в результате чего достигается четкое разделение компонентов смеси. При сорбции компонентов из большого объема анализируемого раствора и десорбции их в меньший объем растворителя достигается концентрирование сорбированных веществ.
В качестве носителей в осадочной хроматографии используют чистые высокодисперсные вещества, обладающие хорошей фильтрующей способностью и индифферентные к осадителю и хроматографируемому раствору: оксид и гидрооксид алюминия, силикагель, сульфат бария, крахмал, песок (диоксид кремния) и др. Осадителями являются реагенты, образующие с разделяемыми ионами осадки (характеризуемые различной растворимостью) и индифферентные к носителю; причем необходимым условием является сорбируемость осадителей на носителе.
Помимо разделения метод осадочной хроматографии применяют для очистки веществ и их концентрирования.
-34-148-
Слайд 36
Физическая адсорбция разделяемых компонентов смеси на адсорбентах лежит

в основе адсорбционной (молекулярной) хроматографии.
Здесь неподвижной фазой является твердый
адсорбент, а подвижной – жидкость (твердо-жидкостная хроматография, ТЖХ) или газ (газоадсорбционная или газотвердая хроматография, ГАХ или ГТХ). Характер поглощения зависит от способа обработки адсорбента и структуры его активной поверхности, но более всего – от природы адсорбируемого вещества.
При пропускании через колонку анализируемого раствора элементы вследствие их различной адсорбируемости распределяются в колонке ступенчато. В верхних слоях сорбента задерживаются сильнее сорбируемые, а в нижних — менее сорбируемые.
Разделение достигается элюированием (промыванием) колонки подходящим растворителем (элюентом), при этом отдельные компоненты смеси продвигаются вдоль колонки неравномерно. В первую очередь с колонки вымывается менее адсорбируемый компонент, затем более адсорбируемый и т. д. Собирая вытекающую из колонки жидкость (элюат) отдельными порциями, получают так называемую жидкостную хроматограмму.
В результате исследуемая сложная смесь будет разделена на ряд фракций, содержащих индивидуальные компоненты, дальнейшее количественное определение которых во фракциях осуществляется обычно каким-либо физико-химическим методом (фотометрическим, полярографическим и др.). -35-149-
Слайд 37
Различие в распределении разделяемых веществ между двумя несмешивающимися

растворителями лежит в основе распределительной хроматографии (жидкость-жидкостная хроматография).
Распределительная
хроматография может быть проведена на колонке, на бумаге или в тонком слое адсорбента. В колоночном варианте колонку, заполненную носителем – твердым тонкоизмельченым пористым веществом, пропитывают неподвижным растворителем, который, адсорбируясь на поверхности носителя, образует на нем поверхностную жидкую пленку. Разделяемую смесь веществ, растворенную в подвижном растворителе, вводят в колонку и, после того как раствор впитается в верхней части колонки, начинают промывание ее чистым подвижным растворителем. В процессе промывания происходит непрерывное перераспределение веществ смеси между двумя несмешивающимися жидкими фазами. Если компоненты смеси имеют хотя бы небольшое различие в коэффициентах распределения между подвижной и неподвижной фазами, то продвигаться вдоль колонки они будут с неодинаковой скоростью. Наибольшей скоростью обладает компонент, который имеет наибольший коэффициент распределения
(где Сподв и Снеподв – концентрации растворенного вещества соответственно в подвижной и неподвижной фазах). -36-150-
Слайд 38
Поэтому этот компонент раньше других будет вымываться с

колонки и попадает в первые порции элюата. Компонент с
наименьшим D движется в колонке с наименьшей скоростью и оказывается в последних порциях элюата. При достаточной длине колонки происходит полное разделение компонентов смеси.
Требования к носителям неподвижной фазы такие же, как и в случае адсорбционной хроматографии. Подвижный и неподвижный растворители подбирают в зависимости от природы носителя и его полярности. Если носителем служит гидрофильное вещество (силикагель, целлюлоза, крахмал, оксид алюминия и т. д.), то неподвижным растворителем является вода или другие полярные жидкости (серная кислота, метиловый спирт, нитрометан), а подвижным — менее полярный органический растворитель или смесь растворителей (например, смесь бутилового спирта с хлороформом).
Например, уран(VI) отделяют от многих элементов на силикагеле, обработанном 6 М HNO3. Соли урана(VI) элюируют из колонки метилизобутилкетоном (МИБК). Ионы металлов, которые не взаимодействуют с МИБК, остаются на колонке, с которой затем удаляются водным раствором.
Если носитель – гидрофобное вещество (фторопласт-4, или тефлон), полистирол и другие полимеры), то в качестве неподвижных сред применяют неполярные органические растворители (бензол, хлороформ, керосин и др.), а в качестве подвижных – полярные органические соединения и воду.
-37-151-
Слайд 39
В этом случае метод называют
распределительной хроматографией с

обращенной фазой,
или
экстракционной хроматографией.
Такой вид хроматографии дает хорошие результаты при
разделении веществ, хорошо растворимых в органических растворителях.
Этим методом отделяют, например, следы железа от алюминия на колонке, заполненной порошком фторопласта-4 в виде взвеси в трибутилфосфате (ТБФ). При пропускании через колонку исследуемого раствора 7 М по НСl и последующем промывании колонки раствором НСl той же концентрации железо полностью задерживается органической фазой, а алюминий в этих условиях количественно смывается с колонки. Железо затем вымывается 0,1 М НСl и определяется фотометрически.
Методом экстракционной хроматографии успешно разделяют неорганические ионы в виде комплексов с органическими лигандами. Распределительная хроматография, сочетающая экстракционный химизм процесса с хроматографической техникой его осуществления, является одним из наиболее эффективных методов жидкостной хроматографии. Она позволяет разделять практически любые смеси близких по химическим свойствам веществ, поскольку неограниченно велико число сочетаний пар разделяющих жидкостей.
-38-152-
Слайд 40
Специфическими видами распределительной хроматографии, позволяющими обходиться без колонки,

являются бумажная и тонкослойная хроматография, используемые для разделения очень
малых количеств веществ. В первом случае инертным носителем служит специально обработанная хроматографическая бумага. При разделении водорастворимых веществ неподвижной фазой является адсорбированная носителем вода, а подвижной – органический растворитель. Если же вещества растворимы в органическом растворителе, то вода используется уже в качестве подвижной фазы, а органический растворитель – неподвижной.
Обобщая все вышесказанное о хроматографических методах, следует отметить их особенную ценность как эффективного инструмента при разделении соединений с близкими химическими свойствами, даже изотопов, поскольку незначительных отличий в составе или строении оказывается обычно достаточно для того, чтобы вызвать заметное различие в способности компонентов удерживаться на тех или иных сорбентах. Важным является также то, что при разделении вещества не претерпевают химических изменений и выделяются в том виде, в каком они присутствовали в исходной смеси.
Хроматографические методы характеризуются простотой эксперимента, селективностью и универсальностью, т. е. возможностью использования для разделения и определения жидких и газообразных неорганических и органических соединений в широком интервале концентраций.
-39-153-
Слайд 41
Основной недостаток этих методов – большие временные затраты,

особенно при разделении веществ с близкими свойствами. Однако создание
специальных приборов –жидкостных хроматографов высокого давления, в которых элюент подается в колонку со скоростью в 100 раз большей, чем в обычной колоночной хроматографии, и под давлением до 0,5-40 МПа —позволяет в благоприятных случаях полностью разделить 20 или 30 компонентов пробы в течение нескольких минут. Предел обнаружения, определяемый обычно чувствительностью детектора, составляет 10–3-10–6%, при массе пробы 1-10 мг, погрешность равна 0,2-2%. Такой вариант получил название высокоэффективной жидкостной хроматографии (ВЭЖХ).
Возможность автоматизации процесса разделения компонентов в сочетании с физическими методами их определения (в частности, масс-спектральным) обусловили использование хроматографии для контроля и автоматического регулирования технологических процессов. Благодаря отмеченным особенностям хроматографические методы получили наибольшее распространение как методы разделения сложных смесей веществ и как методы концентрирования микропримесей.
-40-154-
Слайд 42
4) Электрохимические методы
К электрохимическим методам относятся:
– электролитическое выделение,
–

внутренний электролиз и цементация,
– электродиализ и др.
Основным электролитическим методом
выделения матрицы, разделения компонентов раствора, индивидуального или группового концентрирования микрокомпонентов является элетроосаждение, т. е. осаждение вещества из жидкой фазы на электроде в результате протекания окислительно-восстановительных реакций.
Материалами для рабочих электродов служат Pt, сплавы Pt-Ir, Ag, Cu, W, Hg, графит, стеклоуглерод. Наиболее пригодны как материал для вспомогательных электродов Pt и ее сплавы с иридием, графит, Ag, Pb. При электроосаждении предпочтительны платиновые катоды и аноды.
На Pt-катоде осаждаются металлы Au, Ag, Bi, Cd, Со, Сu, Fe, Hg, Ni, Pb, Pd, Sn, Zn;
на Pt-аноде – оксиды Со, Mn, Ni, Pb;
на Ag-аноде – галогениды и сульфиды металлов
Выделяемые на графитовом электроде микропримеси можно подразделить на три группы:
1) Ag, Bi, Cd, Cu, Pb – выделяются в элементном состоянии;
2) Со, Cr, Fe, Mn – выделяются в виде оксидов;
3) Са, Mg, Mo, Ti, V – выделяются в виде оксидов, гидрооксидов и сплавов.
-41-155-
Слайд 43
В ряде случаев, в первую очередь для избирательного

или группового электроосаждения микрокомпонентов, используют Hg-катод из-за высокого перенапряжения
на нем водорода (~1,1В относительно нормального водородного электрода (НВЭ)).
В зависимости от движущей силы процесса в методе электроосаждения выделяют четыре варианта:
1) электролитическое выделение под воздействием разности потенциалов, задаваемой от внешнего источника тока;
2) химическое осаждение продуктов окислительно-восстановительных реакций, происходящих на электродах под воздействием приложенной разности потенциалов;
3) электролитическое выделение на одном из электродов гальванического элемента {внутренний электролиз);
4) самопроизвольное осаждение на поверхности более электроотрицательного металла (цементация).
В двух последних случаях процесс выделения происходит за счет внутренней энергии системы.
Поведение элемента при электролизе определяется величиной его электрохимического потенциала, который зависит от природы элемента, его химической формы и концентрации, общего состава электролита, а также от плотности тока, материала и конструкции электрода, конструктивных особенностей электрохимической ячейки. -42-156-
Слайд 44
Равновесный потенциал окислительно-восстановительных систем рассчитывается по уравнению Нернста:

где Е° — стандартный окислительно-
восстановительный потенциал полуреакции
Е° —характеристическая величина для каждого металла.
С помощью уравнения Нернста можно оценить потенциалы выделения металла Me для конкретных условий проведения процесса разделения.
Из-за поляризации электродов (смещения потенциалов на электродах от равновесного значения) протекают процессы, которые могут сопровождаться выделением одного или нескольких компонентов на поверхности или в объеме электрода. Реальные потенциалы выделения элемента отличаются от расчетных на величину перенапряжения электродной реакции. Перенапряжение существенно зависит от плотности тока и достигает больших величин при выделении газов, причем при прочих равных условиях минимальные перенапряжения наблюдаются, если электродные процессы идут на поверхности благородных металлов (Pd, Pt, Au).
Электроосаждение под воздействием разности потенциалов, от внешнего источника тока, представляет собой процесс электролитического выделения катионных форм элемента, т. е. это катодный процесс, который применяют как для отделения макрокомпонентов, так и для концентрирования микрокомпонентов. В последнем случае целью электролиза является как индивидуальное, так и групповое концентрирование. Здесь следует руководствоваться, прежде всего, величинами электродных потенциалов концентрируемых элементов. -43-157-
Слайд 45
Электролитическое выделение может быть осуществлено в различных режимах:

- - при постоянном приложенном внешнем напряжении Евн ,
-
при постоянной силе тока I;
- при контролируемом потенциале рабочего электрода, например потенциала катода Ек.
Величину приложенного внешнего напряжения для любого реального процесса электролиза можно найти по формуле:
где Еразл – истинный потенциал разложения (выделения) компонента; R - общее сопротивление электрохимического элемента в омах; Ea – потенциал анода; η – перенапряжение на катоде и аноде.
Ограничением применения метода электроосаждения как при постоянном внешнем напряжении Еш, так и при постоянной силе тока является потеря специфичности, поскольку с уменьшением концентрации выделяемого компонента в процессе электролиза потенциал катода Ек смещается в область более отрицательных значений; это создает условия для выделения на катоде посторонних элементов, восстанавливающихся при более отрицательных потенциалах (в частности, водорода), что приводит к загрязнению осадка.
Применение же электролиза с контролируемым потенциалом рабочего электрода обеспечивает не только селективность, но и наибольший возможный в условиях данного эксперимента ток электролиза. - - 44-158-
Слайд 46
Для предотвращения смещения потенциала катода в отрицательную область

разность потенциалов на электродах электролитической ячейки снижают путем уменьшения
величины IR с помощью реостата. Стабилизация катодного потенциала достигается автоматически с помощью потенциостатов – приборов, поддерживающих строго заданные потенциалы катода или анода.
Метод электролиза при контролируемом потенциале эффективен для прямого анализа растворов, содержащих смесь ионов металлов с близкими потенциалами разложения. Для обеспечения степени извлечения 99,9% потенциал катода Ек должен превышать потенциал выделения компонента приблизительно на 0,2 В.
Минимальное численное значение различия потенциалов разложения (или стандартных потенциалов) разделяемых металлов (при условии равенства их исходных концентраций) должно составлять 0,4 В для однозарядных ионов и 0,2 В – для двух-зарядных.
При электролизе металлы выделяются в порядке убывания величин их электродных потенциалов. Поскольку величина потенциала зависит не только от природы металла, но и от его концентрации в растворе, удается, изменяя концентрацию металлов путем связывания соответствующих ионов в те или иные комплексы, не только увеличить различие потенциалов выделения между элементами для данной смеси (особенно при достаточно близких их значениях), но повлиять на порядок выделения этих элементов. В качестве комплексантов чаще всего применяют аммиак, цианид калия, щавелевую и фосфорную кислоты, фторид-ионы и др. -45-159-
Слайд 47
На чистоту выделяемых на электродах осадков существенное влияние

оказывают условия проведения процесса электролиза. Отсутствие механических включений обеспечивается
получением плотных, хорошо сцепленных с поверхностью электрода осадков. Образованию таких осадков помимо материала электродов способствуют форма рабочего и вспомогательного электродов, перемешивание, низкая плотность тока, добавление деполяризаторов, введение в раствор комплексантов.
По форме рабочие и вспомогательные электроды весьма разнообразны: прямые проволока или стержень, спираль, сетка, пластина, трубка, чашка, тигель и т. д. Обычно конструкцию катода выбирают с учетом требований метода последующего определения. Так, при электроосаждении (метод электрогравиметрии) наиболее предпочтительны платиновые катоды и аноды, выполненные в виде сетки или сетчатого цилиндра, обеспечивающие максимальную площадь электрода и возможность интенсивной циркуляции раствора относительно его поверхности;
На эффективность концентрирования влияет и скорость перемешивания раствора в процессе электролиза. Перемешивание (наряду с нагреванием) необходимо для более эффективного подвода к поверхности электрода веществ, подлежащих выделению.
-46-160-
Слайд 48
При выборе плотности тока исходят из разумного компромисса

между проигрышем по времени выделения при уменьшении плотности тока
и ухудшением качества осадка при ее увеличении. Чем меньше плотность тока, тем лучше условия для формирования осадка. Уменьшение плотности тока достигается электролизом растворов комплексных соединений металлов, а также увеличением поверхности катода (желательно более глубокое погружение катода в анализируемый раствор). В то же время, чем больше плотность тока, тем быстрее протекает процесс электролиза. Однако при увеличении плотности тока может быть достигнут потенциал выделения водорода, что приводит к образованию рыхлых губчатых осадков, склонных к механическому захвату примесей. Обычно рабочие значения плотности тока находятся в интервале 0,005-0,05 А/см2.
Из кислого раствора электролизом можно выделить только те металлы, которые расположены в ряду напряжений правее водорода. При попытке выделить в этих условиях какой-нибудь из электроотрицательных металлов на катоде происходило бы обильное выделение водорода, а требуемый металл совершенно не выделился бы. Чтобы получить возможность осадить на катоде электроотрицательные металлы, необходимо искусственно изменить потенциал выделения водорода на катоде, т. е. сделать его более отрицательным по сравнению с потенциалом осаждаемого металла. Это может быть достигнуто как уменьшением концентрации водородных ионов (проведение электролиза из щелочных растворов), так и заменой Pt-катода на ртутный катод. -47-161-
Слайд 49
Электролиз на ртутном катоде
Вследствие большого перенапряжения водорода

на ртути (~1,1 В) и образования амальгамы (растворы металлов
в ртути) выделяемого при электролизе металла возможно количественное выделение многих из тех металлов, которые нельзя осадить на платине и других твердых электродах из-за происходящего выделения вместо них водорода (Zn, Cd, Bi и других электроотрицательные металлы).
На практике Hg-катод используют для удаления из раствора в виде амальгамы или осадка тех элементов, которые восстанавливаются до металлического состояния при потенциале, меньшем необходимого для выделения водорода. Образующиеся амальгамы легко разлагаются водой с образованием гидрооксидов соответствующих металлов. Hg-катод используют для отделения Fe, Cr, Zn, Ni, Pb, Co, Sn, Mo, Cu, Bi, Ag, Cd, осаждаемых на катоде, от Al, Ti, U, Mg, Be, V, Zr, As и ?, не осаждаемых на нем.
Метод предварительного группового разделения с Hg-катодом, облегчающего ход анализа, широко применяется в практике аналитического контроля при анализе сталей и А1-сплавов для отделения железа, осаждаемого на Hg-катоде, от Al, Ti, V и других элементов, остающихся в сернокислом растворе взятой навески образца. Этот метод используют при анализе цинковых сплавов для предварительного сброса основы (матрицы), после чего в растворе определяют А1 и Mg. Подобным образом можно отделить Fe и Сг от U, Be, Zr и Ti; Mo от V; Cd от Mg; Cu от Al и т. д. Возможности метода значительно возрастают при использовании регулируемого катодного потенциала. -48-162-
Слайд 50
Для электролиза с Hg-катодом предложены различные конструкции электролитических
ячеек, наиболее простая из которых показана на рисунке:
Hg-катод для
электролитического выделения
металлов из раствора:
1 — Hg-катод;
2 — проволока;
3 — раствор;
4 — Pt-проволочный анод;
5 — мешалка
В качестве электролита чаще всего используют растворы серной и хлорной кислот и реже некоторые органические кислоты, а также буферные растворы.
Недостатком Hg-катода является необходимость последующего отделения выделенных компонентов от ртути. В том случае, если Hg-катод используют для концентрирования следов определяемых компонентов, после проведения электролиза последние могут быть отделены от ртути двумя способами. Один из них заключается в отгонке ртути при ~350°С в токе азота в лодочке из плавленого SiO2, для чего Hg-катод включают в цепь как нагреватель. Остаток растворяют в небольшом количестве минеральных кислот и определяют примеси различными физико-химическими и физическими методами.
-49-163-
Слайд 51
Второй способ отделения от ртути выделенных микрокомпонентов —

анодное растворение {инверсионная волътамперометрия): амальгаму используют в качестве анода
при контролируемом потенциале. При анодном растворении в первую очередь растворяется наиболее электроотрицательный металл, а затем менее электроотрицательный и т. д. в соответствии с их равновес- ными электродными потенциалами.
Степень извлечения обычно составляет > 95%, коэффициент концентрирования превышает 104.
Электролитическое выделение может быть основано не только на осаждении матрицы или микрокомпонентов, но и на растворении электрохимически активной матрицы. Можно провести частичное растворение матрицы с оставлением примесей в остатке матрицы. Такой прием удобно использовать при анализе металлов высокой чистоты для группового концентрирования микрокомпонентов, электрохимически менее активных, чем матрица.
Электрохимические методы являются одними из эффективных методов разделения и очистки металлов при анализе разнообразных природных и промышленных объектов Их используют как для выделения микрокомпонентов, так и для выделения матрицы. При помощи электрохимических методов можно осуществлять как групповое, так и индивидуальное концентрирование благодаря возможности контроля и регулирования самого процесса разделения и концентрирования. Достигаемые при этом коэффициенты концентрирования довольно высоки. -50-164-
Слайд 52
К недостаткам электрохимических методов следует отнести ограниченную сферу
практического применения всех разновидностей электроосаждения, а также жесткие требования,
накладываемые на содержание выделяемых примесей в металлах-цементаторах при осуществлении процесса выделения следов металлов методом цементации.
Другие электрохимические методы
К электрохимическим методам анализа примыкает ряд методов, где для азделения концентрирования и очистки металлов в той или иной степени применяется электрический ток. К этим методам относятся:
* диализ и высоковольтный электродиализ,
* электрокинетические методы (электроосмос, электрофорез),
* электродиффузия,
* методы разделения в электростатическом и магнитном полях.
В аналитической практике урана эти методы применяются редко.
-51-165-
Слайд 53
5) Метод экстракции
Экстракция – это метод выделения, разделения

и концентрирования веществ, основанный на распределении растворенного вещества между
двумя несмешивающимися жидкими фазами (растворителями).
Наиболее часто используют системы, где одна фаза – водный раствор, а другая – не смешивающийся с водой органический растворитель, называемый экстрагентом.
Экстракция позволяет осуществлять как абсолютное, так и относительное концентрирование, индивидуальное и групповое выделение микрокомпонентов. Она пригодна как для сброса матрицы, так и для отделения микрокомпонентов. После абсолютного концентрирования концентрация определяемых элементов в органической фазе увеличивается, поскольку объем экстрагента всегда меньше объема водной фазы.
Причиной экстракции является различная растворимость вещества в водной и органической фазах. Поэтому при контакте последних вещество распределяется между ними таким образом, что концентрация его в одной фазе увеличивается, а в другой уменьшается до равновесной величины, определяемой природой системы.
Принципиальная схема экстракционного извлечения металла из раствора показана на рисунке: -52-166-
Слайд 55
В этой схеме введены новые понятия:
* экстрагент – это органическое вещество, образующее с извлекаемым
металлом соединение, способное растворяться в органической фазе;
* экстракт и рафинат – соответственно органическая и водная фазы после
экстракции;
* реэкстракт – водная фаза, полученная после реэкстракции, т.е. после
извлечения металла из экстракта в новый водный раствор уже в
концентрированном состоянии.
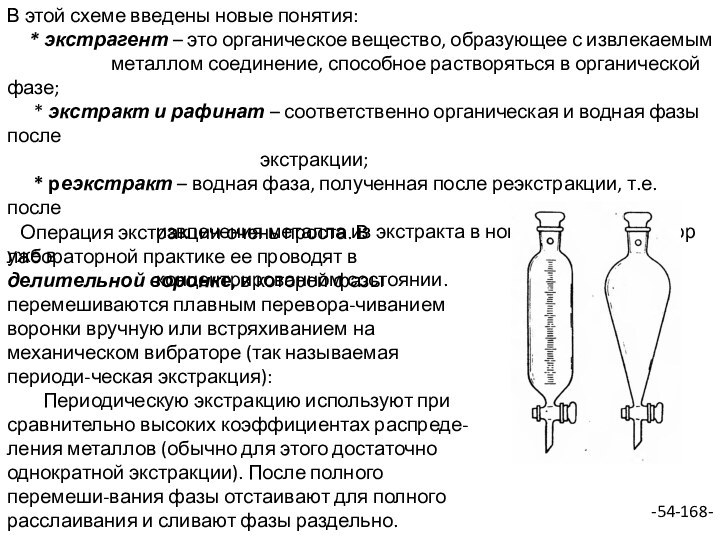
Операция экстракции очень проста. В лабораторной практике ее проводят в делительной воронке, в которой фазы перемешиваются плавным перевора-чиванием воронки вручную или встряхиванием на механическом вибраторе (так называемая периоди-ческая экстракция):
Периодическую экстракцию используют при сравнительно высоких коэффициентах распреде-ления металлов (обычно для этого достаточно однократной экстракции). После полного перемеши-вания фазы отстаивают для полного расслаивания и сливают фазы раздельно.
-54-168-
Слайд 56
В случае необходимости извлечения компонента из органической фазы

в водную используют реэкстракцию, которую осуществляют взбалтыванием органической фазы
с растворами кислот или реагентов, разрушающих комплексное соединение, в виде которого данный элемент был выделен в органическую фазу.
Для систем с небольшими коэффициентами распределения используют многоступенчатую (непрерывную) экстракцию, которую осуществляют в специальных аппаратах – автоматических экстракторах, при которой через водный раствор постоянно пропускают (путем пробулькивания) свежие порции экстрагента. Непрерывность процесса, несмотря на малое значение коэффициента распределения в этой экстракционной системе, позволяет полностью извлечь отделяемый компонент.
По типу применяемых экстрагентов экстракционные процессы можно классифицировать на три основные группы:
*** экстракция нейтральными экстрагентами;
*** экстракция кислыми экстрагентами (катионообменная экстракция);
*** экстракция оснóвными экстрагентами (анионообменная экстракция). -55-169-
Слайд 57
Первая группа – нейтральные экстрагенты: органические вещества, молекулы
которых способны к образованию координационных связей (донорно-акцепторного типа) с
извлекаемым ионом. Это наиболее многочисленная группа экстрагентов, используемых в радиохимии и гидрометаллургии, включающая спирты (R–O–H); простые эфиры (R–O–R), кетоны (RRC=O); фосфорорганические соединения, из которых самым распространенным является трибутиловый эфир фосфорной кислоты (трибутилфосфат, ТБФ): (RO)3P=O, где R – бутиловый радикал C4H9:
образующий сольваты с нитратами металлов (механизм присоединения):
(UO22+)водн. + (2NO3–)водн. + (2ТБФ)орг. ↔ {UO2(NO3)2×2ТБФ}орг.
ТБФ обладает высокой селективностью по отношению к многозарядным катионам типа Ме4+ и оксокатионам МеО22+ (т.е. к U4+, Pu4+, Th4+, UO22+, PuO22+), меньшей – к Ме3+ и практически не экстрагирует катионы Ме2+ и однозарядные катионы Ме+.
-56-170-

– кислые (катионообменные) экстрагенты: органические кислоты и их соли,
способные при контакте с водным раствором к обмену неорганического катиона, входящего в состав экстрагента, на одноименный катион, находящийся в растворе. Распространенными катионообменными экстрагентами являются кислоты жирного ряда и их соли RCOOH(Na), а также алкилфосфорные кислоты, которые димеризованы посредством водородной связи (показана точками ∙∙∙∙):
Из кислых экстрагентов часто применяются фосфорорганические кислоты, например, ди-2-этил-гесил-фосфорная кислота:
Эти экстрагенты диссоциируют по первой ступени:
H2R2 ⇄ H+ + (HR2)–.
Эти экстрагенты называют жидкими катионообменниками, т.е. происходит замещение катиона в органической фазе катионом из водной фазы:
{UO22+}водн. + {2H2R2}орг.⇄ {UO2(HR2)2}орг. + {2H+}водн.,
но в сильнокислых растворах, когда подавляется диссоциация фосфорорганической кислоты-экстрагента, экстракция протекает по механизму присоединения подобно нейтральным экстрагентам:
{UO22+}водн + {2NO3–}водн. + {H2R2}орг. ⇄ {UO2(NO3)2×H2R2}орг.. -57-171-
Слайд 59
Поэтому изменением кислотности можно изменять избирательность экстракции по
отношению к разным элементам.
Наряду с собственно экстрагентами (т.е.
растворителями, не смешивающимися с водой) на практике используют экстрагенты, растворимые в воде, но образующиеся экстракты нерастворимы в воде.
В качестве таких реагентов в аналитической практике урана, плутония и тория широко применяется теноилтрифторацетон (НТТА), образующий с катионом металла наряду с химической связью дополнительную внутрикомплексную (донорно-акцепторную) связь, которая тем прочнее, чем больше заряд катиона металла.
Ионы U4+, Pu4+, Th4+ образуют очень прочные комплексы с НТТА; эти и другие подобные комплексы называют хелатами.
Реакция взаимодействия НТТА с катионом Меn+ описывается схемой:
т.е. происходит обмен протона на катион металла, при этом образуется очень прочное комплексное соединение вследствие образования дополнительной внутрикомплексной связи (показана стрелкой).
-58-172-
Слайд 60
Третья группа – оснόвные экстрагенты–

органические основания и их соли – это амины, т.е.
соединения, содержащие донорный атом азота, способный отдавать неподеленную электронную пару для образования донорно-акцепторной связи.
Амины – алкильные производные аммиака. В зависимости от числа протонов, замещенных в аммиаке алкильными радикалами (–СnH(2n+1)), различают первичные, вторичные и третичные амины RNH2, R2NH и R3N, а также четвертичные аммониевые основания R4N+:
аммиак ; первичный амин; вторичный амин; третичный амин
По аналогии с образованием иона аммония NH4+ происходит образование катиона четвертичного аммониевого основания (ЧАО):
при этом атом азота становится положительно заряженным. Здесь неподеленная пара электронов атомов азота (донора) занимает вакансию в незаполненной орбитали органического радикала R. Вследствие высокой электроно-донорной способности атома азота амины легко насыщаются кислотами, образуя соли (подобно солям аммония), способные обменивать анион кислоты на металл-содержащие анионы в водных растворах. Поэтому амины обычно относят к классу анионообменных экстрагентов. -59-173-
Слайд 61
При этом металл может переходить из водной фазы

в органическую лишь в том случае, когда он находится
в анионной форме (является простым или комплексным анионом).
Уран, плутоний и торий являются очень сильными комплексообразователями и образуют прочные анионные комплексные ионы типа [UO2(CO3)3]4; [Th(CO3)4]4–; [Pu(SO4)3]2– и т.д. Например, при экстракции урана из карбонатных растворов в форме уранил-трикарбонатного комплексного аниона происходит его обмен на простой анион СО32– из амина:
{[UO2(CO3)3]4–}водн.+ {2(R4N)2CO3}орг. ↔ {(R4N)4[UO2(CO3)3]}орг. + {2СО32–}водн.
Высокие экстракционные свойства аминов в сочетании с их высокой устойчивостью к радиационному воздействию позволяют эффективно использовать этот класс экстрагентов для переработки высокорадиоактивных материалов, например, облученного ядерного топлива (ОЯТ).
Причиной экстракции является различная растворимость вещества в водной и органической фазах. Поэтому при контакте последних вещество распределяется между ними таким образом, что концентрация его в одной фазе увеличивается, а в другой уменьшается до тех пор, пока при некотором отношении концентраций Со/Св
(здесь Со и Св – концентрации вещества в органической и водной фазах)
не установится динамическое равновесие (при постоянных температуре и давлении): Св Со. -60-174-
Слайд 62
Это отношение является важной количественной характеристикой процесса и

называется коэффициентом распределения:
Коэффициент распределения зависит от температуры, свойств вещества
и свойств фаз, т. е. его значение изменяется с изменением экспериментальных условий. При постоянной температуре зависимость равновесной концентрации Со от равновесной концентрации Св может быть прямо пропорциональной или более сложной. В случае прямой пропорциональности (большинство процессов при малых концентрациях) коэффициент распределения D – постоянная, не зависящая от общей концентрации растворенного вещества. Зная D можно по концентрации вещества в одной фазе рассчитать его концентрацию в другой фазе.
Другой количественной характеристикой процесса экстракции является степень извлечения R — доля (или процент) от общего количества вещества, экстрагируемая в фазу органического растворителя при данных условиях:
где q0 и qB — количество вещества в органической и водной фазах.
Принимая во внимание, что q = CV (здесь V — объем фазы),
можно найти зависимость между D и R:
-61-175-

равенстве объемов водной и органической фаз
При D >> 1 наблюдается практически полное извлечение, т. е. R ≈ 100%.
В случае разделения двух компонентов А и В используют иногда такую количественную характеристику как фактор (коэффициент) разделения :
Хорошие результаты разделения достигаются при KA/B > 104.
После краткой характеристики процесса экстракции, рассмотрим вопросы экстракционного концентрирования и разделения.
Экстракция позволяет осуществлять как абсолютное, так и относительное концентрирование, индивидуальное и групповое выделение микрокомпонентов. Она пригодна как для сброса матрицы, так и для отделения микрокомпонентов.
После абсолютного концентрирования концентрация определяемых элементов в органической фазе увеличивается, поскольку объем экстрагента всегда меньше объема водной фазы. Естественно, что в этом случае коэффициенты распределения экстрагируемых микрокомпонентов должны быть большими (D >> 500). Но обычно абсолютное концентрирование сочетают с относительным: при экстракции микрокомпонента в малый объем экстрагента (абсолютное концентрирование) он одновременно отделяется от элемента-основы (относительное концентрирование). -62-176-
Слайд 64
Экстракционное концентрирование может быть избирательным и

групповым: выбор между ними определяется задачей анализа и методом
анализа.
Избирательное концентрирование, при котором из пробы выделяется один элемент или последовательно ряд элементов, применяется обычно в сочетании с одноэлементными методами (фотометрическим, атомно-абсорбционным ), когда одновременное присутствие в концентрате нескольких элементов может исказить результаты анализа. Для избирательного концентрирования необходимо тщательное соблюдение условий эксперимента для устранения мешающего влияния посторонних элементов.
При групповом концентрировании, позволяющем за один прием выделять несколько элементов-примесей, аналитический контроль упрощается, снижаются затраты реагентов и продолжительность проведения многоэлементного определения. Групповое концентрирование часто применяют в сочетании с атомно-эмиссионным, рентгенофлуоресцентным и вольтамперометрическим определением (то есть многоэлементными методами), когда взаимное влияние элементов на результаты определения
не слишком значительно.
Экстракция дает возможность отделять микрокомпоненты от макрокомпонента (матрицы) двумя способами:
– при одном из них экстрагируют микрокомпоненты,
– при другом – экстрагируют матрицу, при этом примеси остаются в водной
фазе. -63-177-
Слайд 65
Выбор приема зависит от конкретных условий, но экстракция

микропримесей в общем случае более удобна, так как при
этом происходит более полное их отделение от основного вещества; однако она требует более тщательной очистки реагентов. Объектами для экстракции микрокомпонентов являются природные и сточные воды, соли щелочных и щелочноземельных металлов, соединения металлов, существующих при экстракции в виде анионов.
Экстракционное извлечение основного компонента требует большего расхода реагентов, что приводит к увеличению поправки на холостой опыт, но зато позволяет получить концентрат, содержащий большее число элементов-примесей. Извлечение матрицы успешно только в том случае, когда анализируемая проба имеет сравнительно простой макроэлементный состав. Поэтому оно широко применяется главным образом при анализе металлов и сплавов, простых солей и оксидов. Гораздо реже извлечение матрицы применяют при анализе природных объектов, например горных пород или биологических материалов.
Эффективным методом разделения элементов с близкими свойствами (коэффициенты распределения D практически не различаются) является
метод колоночной экстракционной хроматографии, где
– химизм процесса – экстракционный,
– но метод работы – хроматографический.
-64-178-
Слайд 66
По степени абсолютного концентрирования (отношение концентрации микропримесей в

органической фазе к концентрации в водной) экстракция уступает соосаждению
с неорганическими и органическими соосадителями, однако относительное концентрирование (отношение концентрации в органическом растворителе микроэлемента к другим элементам, присутствующим в водном растворе в несравнимо больших концентрациях), т. е. обогащение, может быть при экстракции очень эффективным.
Поскольку экстракционное концентрирование связано с использованием реагентов, оно уступает в этом отношении испарению при высокой температуре, зонной плавке и другим методам, которые не связаны с химическими реакциями и реагентами.
Недостатком экстракции является также необходимость использования в некоторых случаях довольно огнеопасных и вредных растворителей.
Достоинством же экстракции является универсальность: этот метод приложим практически ко всем элементам. Метод экстракции экспрессен и прост в исполнении, легко поддается автоматизации. В сочетании с инструментальными методами анализа он позволяет решать сложные проблемы анализа руд, сплавов, чистых веществ, продуктов ядерных реакций и т.д. Все это предопределило широкое распространение экстракции как метода выделения, разделения и концентрирования элементов не только в аналитическом контроле, но и в ряде отраслей промышленности (химической, атомной и др.).
-65-179-
Слайд 67
6. Другие методы разделения и концентрирования
6.1. Селективное растворение
Концентрирование

элементов этим методом заключается в селективном растворении матрицы или
микрокомпонентов, содержащихся в твердых веществах сложного состава или жидком металле, что значительно упрощает их последующее определение инструментальными методами. Иногда для уменьшения продолжительности анализа растворение проводят при воздействии СВЧ-излучения (излучение сверхвысокой частоты, микроволновая обработка).
Селективное растворение матрицы используют для концентрирования различных оксидов, карбидов и нитридов, присутствующих в сталях, цветных металлах и сплавах в виде включений и поверхностных пленок.
Пробу обрабатывают при нагревании растворителем, в котором матрица растворима, а оксиды и другие включения - нерастворимы. После растворения матрицы остаток отделяют фильтрованием. При необходимости компоненты остатка разделяют селективным растворением и проводят элементный анализ. Условием селективного растворения микрокомпонентов с целью концентрирования является их взаимодействие с растворителем при отсутствии взаимодействия с ним матрицы. -66-180-
Слайд 68
Многие металлы растворяют в минеральных кислотах и полученные

растворы выпаривают досуха для распределения микрокомпонентов на поверхности или
между кристаллами матрицы (оксидами или солями). Иногда сухой остаток прокаливают для перевода матрицы в другие менее растворимые соединения. Затем под воздействием ультразвука (ускоряющем процесс растворения) микрокомпоненты и небольшое количество матрицы растворяют в воде, минеральных кислотах, органических растворителях или их смесях. При содержании микрокомпонентов в пробе 10–9-10–6 г/г степень извлечения составляет >95 %, коэффициент концентрирования – 102-104.
6.2. Дистилляция, сублимация и родственные методы
Дистилляция и сублимация — старейшие методы разделения в аналитической химии, но их широко используют и в современных методах определения следов элементов в самых различных объектах.
Главные достоинства методов – простота, доступность, экспрессность, малая поправка на холостой опыт, большая степень абсолютного концентрирования. Эти методы часто объединяют под общим названием методы испарения, среди которых различают:
* простую отгонку (выпаривание),
* ректификацию,
* молекулярную дистилляцию (дистилляцию в вакууме),
* сублимацию (возгонку),
* перегонка при помощи химических транспортных реакций. -67-181-
Слайд 69
Важное место занимают сухая (озоление) и мокрая минерализация

органических и биологических проб, а также отгонка неорганических веществ
после химических превращений. При этом, обычно при повышенных температурах, отгоняться может как матрица, так и элементы-примеси.
В основе всех методов лежит различие в давлении паров разделяемых компонентов или основного соединения и примеси или, другими словами, различие в коэффициентах распределения макро- и микрокомпонентов в системах жидкость – пар или твердое тело – пар (газ).
Метод отгонки основан на образовании «летучих» соединений, под которыми понимают вещества, существующие в газообразном состоянии при температуре и давлении проведения отгонки, а в более общем случае – вещества, имеющие высокое давление паров над раствором или самим веществом в жидком или твердом состоянии. Наиболее распространен вариант отгонки из раствора.
Простая отгонка (или выпаривание) – одноступенчатый процесс разделения и концентрирования микрокомпонентов, когда коэффициент распределения сравнительно велик. Наиболее часто используют отгонку матрицы, особенно в тех случаях, когда она обладает более высокой летучестью, чем летучесть определяемых микрокомпонентов (удаление упариванием воды или органических растворителей из растворов). Отгонка микрокомпонентов из раствора практически не проводится, потому что они редко находятся в форме готовых летучих соединений. -68-182-
Слайд 70
Ректификация - многоступенчатый процесс

разделения и концентрирования -осуществляется многократным испарением и конденсацией в
насадочных, тарельчатых или пленочных колонках при противотоке пара и жидкости с частичным возвратом дистиллята (флегмой) при установившихся массо- и теплообмене. Методом ректификации разделяют компоненты с весьма близкими свойствами.
Молекулярная дистилляция. Успешное использование испарения из жидкости зависит от химической устойчивости макро- и микрокомпонентов при длительном нагревании. При разделении химически неустойчивых веществ или веществ с высокой температурой кипения используют специальные системы вакуумирования для проведения процесса при пониженном давлении (до 10–1-10–2 Па; 1 Па = 7,5·10–3 мм рт. ст.). Такое разделение называют молекулярной или вакуумной дистилляцией. Этот метод используют, например, для концентрирования нелетучих микропримесей в тетрахлориде титана TiCI4 (жидкость) с последующим атомно-эмиссионным определением
Сублимация (возгонка) представляет собой процесс испарения вещества путем непосредственного перехода его из твердого состояния в парообразное. Поэтому сублимация возможна в том случае, когда вещество, будучи нагрето до температуры ниже точки его плавления, характеризуется достаточно высоким давлением паров. При сублимации примеси, более летучие, чем вещество основы, могут быть отогнаны при низкой температуре, а менее летучие примеси сосредоточены в остатке. -69-183-
Слайд 71
Примером использования возгонки может служить атомно-эмиссионное определение 16

микрокомпонентов (Ag, Al, Au, Са, Сг, Сu, Fe, Mg,
Mn, Ni, Pb, Sb, Sn, Ti, V, Zn) в йоде после сублимирования матрицы (йода) при 60-65 °С.
Перегонка при помощи химических транспортных реакций.
Эти реакции используют не для концентрирования примесей, а для получения высокочистых соединений (металлов и твердых веществ). Хотя летучие металлы можно получить в очень чистом состоянии при помощи дистилляции, тем не менее давления паров большинства металлов и ряда полупроводников недостаточно для осуществления их дистилляции с целью глубокого разделения или очистки при относительно невысоких температурах.
Перегонка веществ при помощи химических транспортных реакций как способ их разделения и очистки основывается на превращении основного металла в промежуточное газообразное соединение, более летучее, чем примеси или другие компоненты. Образующееся газообразное соединение основного металла способно при изменении условий процесса (температура, давление) вновь переходить в твердое состояние.
На рисунке представлена схема устройства для проведения транспортной реакции очистки никеля переносом его в виде тетракарбонила никеля Ni(CO)4: -70-184-
Слайд 72
Схема реактора для проведения реакции с участием тетракарбонила
никеля:
I —исходный
никель;
II — очищенный никель;
1 — холодная зона; 2 — фланцевое соединение; 3 — труба; 4 — горячая зона
В холодный конец стеклянной трубки помещают исходный никель. После откачивания воздуха ее заполняют оксидом углерода СО. При этом в холодном конце трубки (Т1 = 45-50 °С) образуется тетракарбонил никеля:
Газообразный Ni(CO)4 диффундирует в горячий конец трубки (Т2 = 180-200 °С), где разлагается:
Выделяющийся никель оседает на стенках горячего конца трубки, а освобожда-ющийся СО диффундирует к холодному концу трубки и транспортирует следующие порции никеля. В конце концов весь никель постепенно может быть перенесен из холодного конца трубки в горячий, поэтому такие реакции и называются реакциями переноса. Описанный процесс используют как для очистки никеля, так и для концентрирования содержащихся в нем примесей.
-71-185-
Слайд 73
Химические транспортные реакции широко используют для получения многих

металлов высокой чистоты:
циркония, гафния, тория, молибдена, железа, германия
и многих других.
Cухая минерализация (озоление) и мокрая минерализация.
Эти виды концентрирования относятся к отгонке после химических превращений и используется для определения микрокомпонентов, входящих в состав органических соединений, неорганических объектов, содержащих органические вещества, биологических объектов (почвы, растения, животные ткани), нефтепродуктов, полимеров и т. п. В абсолютном боль шинстве случаев органическое вещество пробы окисляют каким-либо подходящим способом.
При сухой минерализации окислителем служит воздух, реже - чистый кислород и хлор. Основными продуктами реакции при окислении на воздухе являются СО2, Н2О и N2, при наличии в образце серы выделяется SO2. Сухое озоление проводят при температурах 400-500 °С в муфельной печи.
При мокром озолении в качестве окислителей используют концентрированные кислоты и их смеси (НСlO4, HNO3, H2SO4), Н2О2, КСlO3 в среде НСl; КМnO4 - в кислой и щелочной средах. -72-186-
Слайд 74
6.3. Пирометаллургические методы
1. Пирометаллургическое шлакование. Это специфический метод

концентрирования примесей в металлах, основанный на частичном окислении матрицы
кислородом. При этом микрокомпоненты переходят в оксиды и, образуя шлак, концентрируются наповерхности затвердевающего слитка.
2. Метод концентрирования, основанный на распределении вещества между двумя несмешивающимися расплавами . Этот метод используют для снижения предела обнаружения по отдельным микропримесям до 10–6-10–8%. Взаимодействие элементов в расплавленном состоянии может происходить как по механизму физического растворения, так и путем образования химических соединений.
3. Особый вид предварительного концентрирования –
пробирная плавка
Она является основным методом концентрирования благородных металлов, содержащихся в рудах, горных породах и продуктах их переработки, а в виде пробирного анализа – и способ установления концентрации драгметаллов в сплавах и изделиях.
В пробирной плавке объединяются разложение пробы
и концентрирование микроколичеств благородных металлов.
Содержание последних очень незначительное и поэтому определение их обычными химическими методами затруднительно. -73-187-

особенность пробирного анализа, отличающая его от обычных методов количественного
анализа, состоит в том, что металл, как правило, выделяется в свободном состоянии и количество металла определяется непосредственно взвешиванием.
Пробирный анализ, под которым подразумевается определение золота Аu и серебра Ag, включает следующие основные операции:
1) шихтование — смешение измельченной представительной средней пробы (до 100 г) с шихтой, в состав которой входят коллектор (РbО), флюсы (кварц, бура, сода и др.), а также в зависимости от способа плавки восстановители либо окислители;
2) плавка (тигельная или шерберная) анализируемого объекта с различными флюсами с целью получения сплава драгметалла со свинцом;
3) купелирование – окислительное плавление сплава благородных металлов со свинцом;
4) разваривание полученного сплава благородных металлов (Ag и Аu);
5) определение Ag и Аu.
Обычно применяют тигельную плавку – для анализа руд и продуктов их переработки с содержанием благородных металлов выше 1 г на 1 т исходного вещества.
Тигельная плавка – это восстановителъно-растворителъное плавление навески материала с шихтой при 1000-1050 °С в огнеупорных (шамотных) тиглях вместимостью от 300 до 800 см3. -74-188-
Слайд 76
Плавление ведется в специальных печах, называемых горнами. В

шихту вводится глёт РbО и восстановители – углеродсодержащие вещества
(порошок древесного угля, крахмал, мука, бумага, железные опилки и др.). При плавлении глёт восстанавливается до металлического свинца, в расплавленных каплях которого при температуре 500-550 °С растворяются благородные и другие металлы (если только последние находятся в свободном состоянии), образуя легкоплавкий сплав (черновой свинец, или веркблей). Одновременно происходит образование легкоплавких шлаков при взаимодействии компонентов породы с флюсами. Жидкий расплав выливают в чугунную изложницу и после охлаждения отделяют от шлака механическим путем (шлак отбивают молотком).
Шерберная плавка – это окислителъно-растворителъное плавление при 900-1050 °С в шербере – неглубокой чашке из огнеупорной глины диаметром 50-75 мм. Эта операция выполняется как для очистки веркблея, полученного при тигельной плавке, так и как самостоятельный метод для плавления небольших навесок материала (1-5 г), богатого золотом и серебром (Ag-руды, Аu- и Pt-концентраты, электролитные и цианистые шламы с содержанием благородных металлов порядка сотен граммов на тонну). В состав шихты при этом входят металлический (зерненый) свинец, бура и кварц. Окислительная атмосфера создается поступающим в печь воздухом и глётом, образующимся из свинца. Глёт в расплавленном состоянии выступает как энергичный окислитель. -75-189-

действии глёта и кислорода воздуха происходит окисление различных компонентов,
переходящих в шлак при взаимодействии с кремнеземом и бурой, в то время как благородные металлы концентрируются в металлическом свинце, образуя сплав (как и в вышеприведенном случае он называется веркблеем). Последний отделяется от шлака также механическим путем.
Для выделения серебра и золота из веркблея используют способность свинца быстро окисляться кислородом воздуха. Для этого проводят операцию купелирования – окислительное плавление веркблея в специальных пористых сосудах (капелях) диаметром 40-60 мм, изготовленных из костной муки, магнезита MgCO3 или цемента. Плавление ведут в муфельных печах при 900 °С.
Процесс купелирования основан на избирательном окислении неблагородных металлов, которые вследствие большого сродства к кислороду окисляются раньше, чем благородные металлы. При плавлении свинец окисляется и переходит в глёт РbО. Расплавленный глёт, в свою очередь, окисляет примеси неблагородных металлов, растворяет их оксиды и на 98,5% адсорбируется под действием капиллярных сил поверхностью купели, играющей роль полупрони-цаемой перегородки. Остальная часть глёта (до 1,5%) улетучивается в виде паров. На поверхности капели остается королек – сплав Ag с Аu. После взвешивания его «разваривают», т. е. обрабатывают разбавленной азотной кислотой в фарфоровых или платиновых тиглях при 80-90 °С. Серебро при этом растворяется и в полученном растворе подвергается регенерации (осаждение в виде AgCl и плавление этого осадка с бурой или под слоем соды в графитовом тигле). -76-190-
Слайд 78
Оставшуюся после

обработки королька азотной кислотой «корточку» золота промывают, прокаливают и
взвешивают. Содержание серебра определяют по разности масс королька и корточки.
К преимуществам пробирного анализа можно отнести непосредственное определение содержания металла без необходимости производить отделение от других компонентов. Метод характеризуется селективностью, он обеспечивает представительность пробы и достаточно высокие коэффициенты концентрирования (до 103-104), низкие пределы определения: по золоту 0,1-0,2 г/т (10–5%), по серебру — 5-10 г/т (10–3%). Однако при таком содержании благородных металлов возникают трудности в ходе разделения элементов, вследствие чего при пробирно-химическом анализе резко ухудшаются воспроизводимость и правильность. Комбинирование пробирной плавки с высокочувствительными инструментальными методами анализа сняло эти ограничения и позволило значительно расширить границы применимости этого метода. Поэтому сейчас сочетание пробирной плавки со спектрофотометрией, атомно-эмиссионной и атомно-абсорбционной спектрометрией и стало уже традиционным.
. -77-191-
Слайд 79
Пробирный анализ используется и для количественного определения платины

Pt и палладия Pd. Он основан на способности этих
металлов образовывать сплавы с серебром. Металлы-спутники платины и палладия (Rh, Ir, Ru и Os) в меньшей степени удовлетворяют условиям пробирного анализа, поэтому их анализ более сложен и труден. Тигельная плавка на Pt-металлы осуществляется при более высокой температуре, чем на золото и серебро; по окончании плавки достигают 1200 °С. Если требуется раздельное определение Pt-металлов, то его проводят по очень сложной и многостадийной схеме.
Пробирное концентрирование пригодно также для определения урана (по продуктам деления), висмута, олова и индия. В настоящее время для пробирной плавки кроме свинца используют олово и сульфид никеля.
Недостатки пробирного анализа—многостадийность, длительность, большие трудо- и энергозатраты, загрязнение окружающей среды свинцом.
6.4. Кристаллизационные методы
Они включают в себя: * направленную кристаллизацию и
* зонную плавку
и относятся к числу безрегентных методов концентрирования и очистки металлов и полупроводниковых материалов.
Суть методов заключается в полном (при направленной кристаллизации) или частичном (с одного конца при зонной плавке) расплавлении слитка металла. В последнем случае зону высокой температуры постепенно продвигают вдоль слитка. -78-192-
Слайд 80
При этом небольшое количество расплавленного металла проходит постепенно
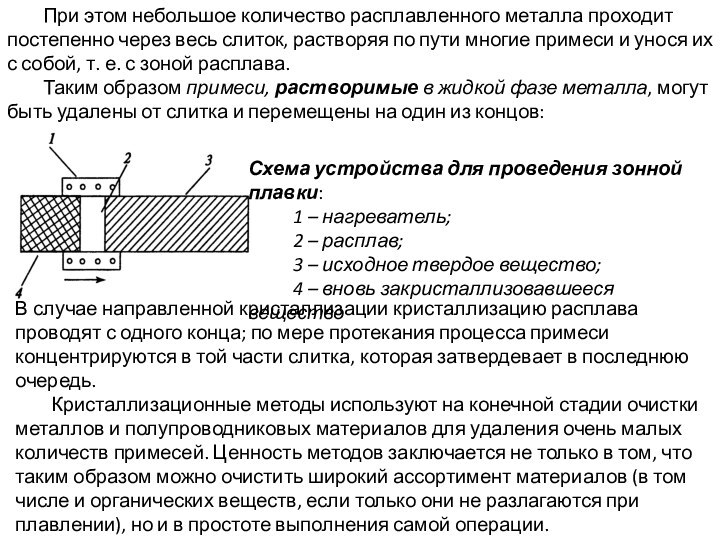
через весь слиток, растворяя по пути многие примеси и
унося их с собой, т. е. с зоной расплава.
Таким образом примеси, растворимые в жидкой фазе металла, могут быть удалены от слитка и перемещены на один из концов:
Схема устройства для проведения зонной плавки:
1 – нагреватель;
2 – расплав;
3 – исходное твердое вещество;
4 – вновь закристаллизовавшееся вещество
В случае направленной кристаллизации кристаллизацию расплава проводят с одного конца; по мере протекания процесса примеси концентрируются в той части слитка, которая затвердевает в последнюю очередь.
Кристаллизационные методы используют на конечной стадии очистки металлов и полупроводниковых материалов для удаления очень малых количеств примесей. Ценность методов заключается не только в том, что таким образом можно очистить широкий ассортимент материалов (в том числе и органических веществ, если только они не разлагаются при плавлении), но и в простоте выполнения самой операции.
-79-193-
Слайд 81
Зонная плавка может быть эффективно выполнена в любых

масштабах – и для очистки нескольких граммов органического вещества,
и для рафиниро-вания слитков металла массой в десятки килограммов. В настоящее время успешной зонной очистке подвергнуто несколько десятков металлов и полупроводниковых материалов.
6.5. Флотация
Флотация – метод концентрирования и разделения смесей твердых частиц веществ, основанный на различии в смачиваемости.
Флотацию широко применяют в гидрометаллургии как высокоэффектив-ный способ обогащения полезных ископаемых - руд, минералов после их предварительного измельчения.
Флотируемые вещества должны быть гидрофобными. Для этого водную суспензию измельченного сырья обрабатывают реагентами-собирателями (флотационными реагентами), которые бывают двух типов: катионные и анионные. В зависимости от того, какой ион флотационно-активен, он адсорбируется на поверхности частиц извлекаемого компонента с одновременной ее гидрофобизацией. В свою очередь, образовавшиеся мицеллы (крупные частицы в коллоидных растворах, состоящие из нерастворимого в данной среде ядра, окруженного оболочкой адсорбированных ионов и молекул растворителя) сорбируются на пузырьках газа (воздуха или азота), пропускаемого в суспензию через мелкопористый диск, и выносятся на поверхность раствора. -80-194-
Слайд 82
Для удержания флотируемых осадков на поверхности раствора в

систему добавляют поверхностно-активные вещества (ПАВ), образующие стабильный слой пены.
В ряде случаев для предотвращения выноса в концентрат балластных веществ (пустой породы) в суспензию вводят реагенты-подавители (депрессоры), гидрофилизирующие поверхность частиц, не подлежащих флотации, и вследствие этого оседающих на дне обогатительной установки.
В результате флотации над поверхностью суспензии образуется устойчивый слой пены, обогащенной извлекаемыми микрокомпонентами (хотя флотация может применяться и для выделения матрицы). Продукты флотации после их отделения специальными пробоотборниками подвергают анализу.
Флотации могут быть подвергнуты также неорганические и органические осадки, используемые в качестве коллекторов (носителей) для выделения из разбавленных растворов микрокомпонентов методом соосаждения. Предпочтение отдают объемным хлопьевидным осадкам, размер частиц которых превышает диаметр пузырьков газа. В этом случае многочисленные мелкие пузырьки газа легко захватываются осадком и обеспечивают его хорошую плавучесть.
Метод концентрирования микрокомпонентов флотацией является более быстрым и удобным, чем метод соосаждения, который требует применения трудоемких и продолжительных операций — отделение осадка от маточного раствора фильтрованием или центрифугированием.
-81-195-
Слайд 83
Наиболее широко флотация применяется в цветной металлургии. Методика

проведения флотационных процессов уже настолько разработана, что при помощи
так называемой селективной флотации удается не только отделять руду от пустой породы, но и во многих случаях и успешно разделять отдельные минералы полиметаллических руд.
6.6. Фильтрация
Фильтрация – это процесс движения жидкости или газа через пористую среду, сопровождающийся отделением взвешенных частиц.
Метод используют для концентрирования твердых частиц, содержащихся в атмосферном воздухе и воздушной среде промышленных помещений. В качестве материала фильтрующих элементов применяют бумагу, графит, пористое стекло, стекловолокно, синтетические материалы.
Методика определения микрокомпонентов в воздухе включает отбор пробы, совмещенный со стадией концентрирования, путем пропускания определенного объема воздуха через фильтрующий элемент, отбор частиц с него (например, озолением фильтра) и собственно определение.
В ряде случаев для концентрирования микрокомпонентов используют инертную полимерную мембрану. Метод основан на избирательном связывании элементов в комплексы с водорастворимыми полимерами, содержащими комплексообразующие группы. Ионы металлов, не образующих комплексов с водорастворимыми полимерами, проходят через мембрану, а ионы, связанные в комплексные соединения, концентрируются в растворе над матрицей. -82-196-
Слайд 84
6.7 Диффузия и термодиффузия
Для разделения и очистки газообразных

веществ может быть использовано различие в скоростях диффузии через
пористые перегородки. В силу этого по одну сторону перегородки концентрируются газы, обладающие большей скоростью диффузии, а по другую — меньшей. Многократное повторение этого процесса в камере, снабженной большим числом пористых перегородок, позволяет достигнуть высокой степени разделения газов. Чем тяжелее газ и соответственно больше его молекулярная масса, тем он медленнее диффундирует через пористую перегородку и тем меньше его концентрация за перегородкой.
Той же цели – разделению газообразных веществ – может служить и другая форма диффузионных процессов – так называемая термическая диффузия, основанная на явлении возникновения градиента концентрации в двухкомпонентной газовой или жидкой смеси при создании в ней температурного градиента. Если сосуд с газовой смесью подогревать с одного конца и охлаждать с другого, то через некоторое время состав смеси в горячей и холодной частях будет различаться. Различие тем значительнее, чем больше разница температур. В горячей части смеси содержится больше того из компонентов, который обладает меньшей молекулярной массой («масса – мера инерции»).
Диффузия через пористые перегородки и термодиффузия применяются для разделения изотопов в форме их газообразных соединений. -83-197-
Слайд 85
Общие замечания о методах концентрирования
и разделения
При многообразии

методов разделения и концентрирования трудно решить, какому из них
следует отдать предпочтение.
Каждый метод имеет свою сферу применения в зависимости от поставленных перед химиком-аналитиком задач, свои достоинства и ограничения. Успех применения каждого метода зависит от того, насколько правильно выбраны условия, обеспечивающие количественный переход нужного (или мешающего) компонента в одну из фаз, либо, если это гомогенная система,
накопление компонента в определенной части системы.
Выбор метода концентрирования определяется нормативных документом, который основан на учете специальных условий:
1) конкретная практическая задача, т. е. учет природы объекта анализа, перечень микрокомпонентов, которые следует определять; требуемые метрологические параметры рабочей методики (достигаемые коэффициенты концентрирования, а следовательно, пределы обнаружения; степень извлечения; воспроизводимость получаемых результатов (см. рисунок:
-84-194-
Слайд 86
Сопоставление методов по коэффициентам концентрирования
2) происхождение и предыстория
объекта анализа (прежде всего это относится к веществам и
материалам промышленного изготовления, когда простой доступный способ разделения уже был использован технологом или синтетиком, а поэтому химик-аналитик не должен повторять его);
3) сочетаемость выбранного метода концентрирования и метода последующего определения микрокомпонентов в концентрате;
4) универсальность, простота, доступность, время на выполнение операции;
5) оснащенность головной лаборатории (предприятия-разработчика) и тех лабораторий, которые используют метод для рутинного анализа (возможность автоматизации); 85-199

6) специализация и квалификация исследователя, разрабатывающего методику, его приверженность
к тому или иному методу, а также специали-зация и квалификация аналитиков производственных лабораторий, которые будут эту методику использовать;
7) необходимость обеспечения безопасных условий работы;
8) возможность четкого разделения макро- и микрокомпонентов;
9) форма существования микрокомпонентов, присутствующих в пробе, их состояние окисления, равномерность распределения по объему, состояние их в растворах (ионное или коллоидное). Все это важно, хотя концентрирование и переводит компоненты в однородное состояние независимо от первоначальной формы существования их в анализируемой пробе. Методы концентрирования весьма различаются по степени использования. В определенной мере это свидетельствует о значении отдельных методов.
Наиболее распространены следующие методы концентрирования:
экстракция и экстракционная хроматография, соосаждение, дистилляционные методы (отгонка, фракционное испарение, сублимация), адсорбционная, распределительная, осадочная хроматография и ионный обмен, электрохимические методы (электроосаждение, электродиализ, цементация, ионофорез), зонная плавка, озоление.
Известны и другие методы – ультрацентрифугирование, диализ, диффузия и термодиффузия, электродиффузия, флотация. -86-200-
Слайд 88
Концентрирование расширяет возможности методов определения, обеспечивая устранение матричного

эффекта, который значительно повышает пределы обнаружения и другие параметры
аналитической методики и может вообще исключить возможность определения тех или иных микрокомпонентов выбранным методом.
Предварительное концентрирование микрокомпонентов расширяет и круг объектов, которые можно анализировать выбранным методом. Так, приме-нение эмиссионного спектрального анализа для определения микрокомпонентов в матрице, дающей многолинейчатый спектр (лантаниды, актиниды), осложняет-ся наложением линий макрокомпонента на линии определяемых микрокомпо-нентов. Предварительное концентрирование микрокомпонентов и удаление основы снимают эти затруднения. Концентрирование с полным отделением матрицы особенно полезно при анализе токсичных, радиоактивных и дорогостоящих веществ.
Концентрированию свойственны и недостатки: оно удлиняет анализ и усложняет его; для осуществления концентриро-вания нужны реактивы высокой чистоты, причем иногда в немалых количествах. В отдельных случаях требуется специальная аппаратура и освоение специфических приемов работы. Процесс концентрирования может сопровождаться потерями определяемых элементов или внесением загрязнений, иногда уменьшением числа определяемых микрокомпонентов и ухудшением параметров методики. Однако достоинства концентрирования перекрывают его недостатки. -87-201-