- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Классификация и свойства кислот
Содержание
- 2. Кислоты – это сложные неорганические соединения, состоящие из протона водорода и кислотного остатка
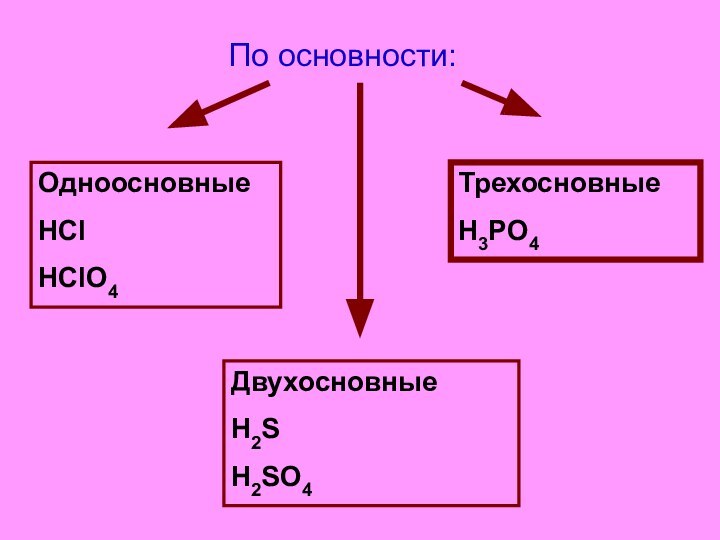
- 3. Классификация кислот. По основности:
- 4. По основности:ОдноосновныеHClHClO4ДвухосновныеH2SH2SO4ТрехосновныеH3PO4
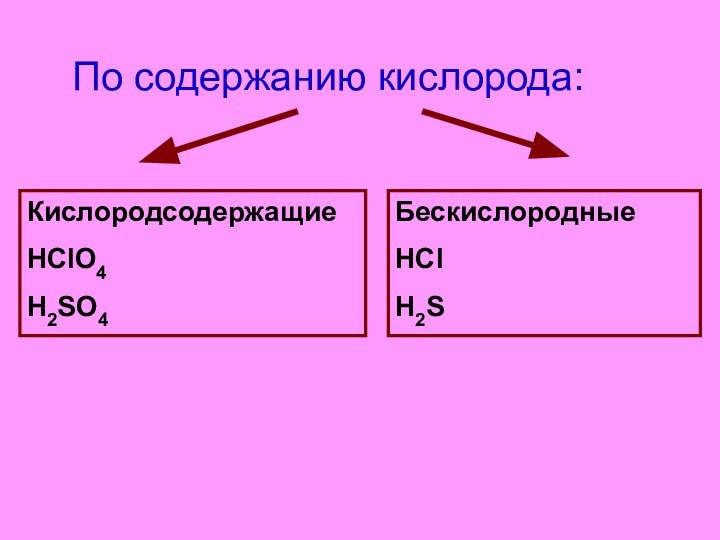
- 5. По содержанию кислорода:
- 6. По содержанию кислорода:КислородсодержащиеHClO4H2SO4БескислородныеHClH2S
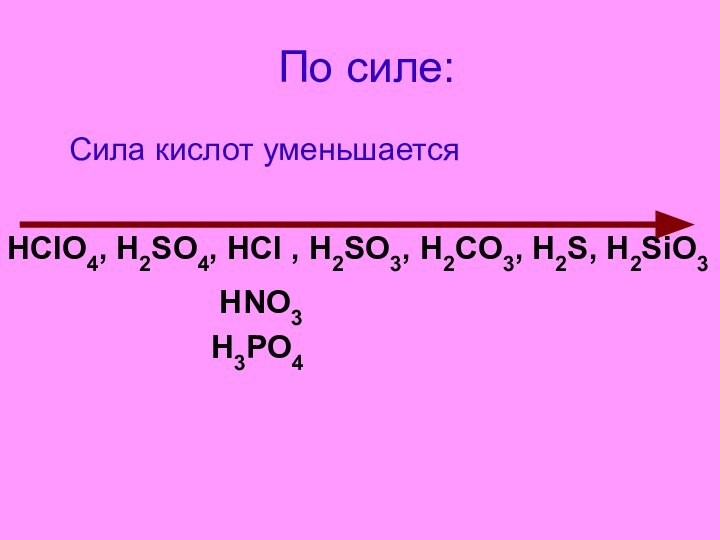
- 7. По силе: Сила кислот уменьшается
- 8. По силе: Сила кислот
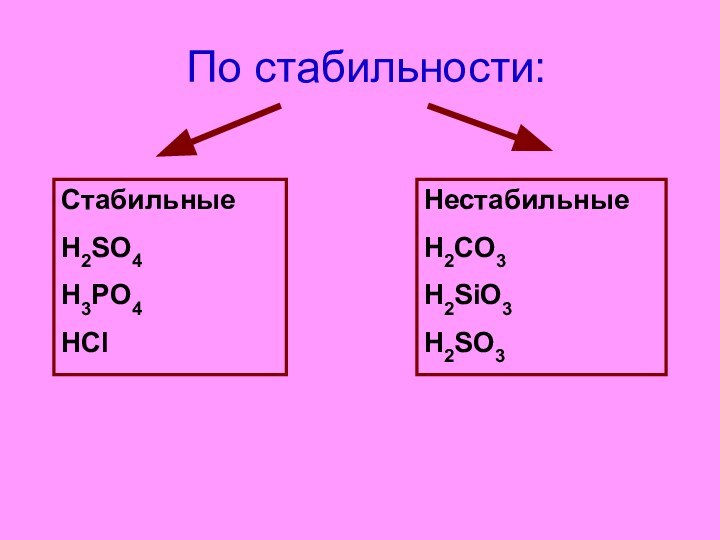
- 9. По стабильности:
- 10. По стабильности:СтабильныеH2SO4H3PO4HClНестабильныеH2CO3H2SiO3 H2SO3
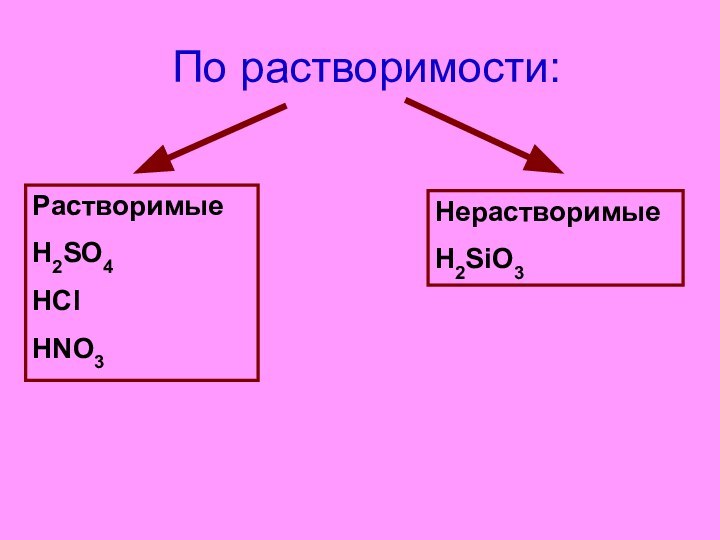
- 11. По растворимости:
- 12. По растворимости:РастворимыеH2SO4 HClHNO3НерастворимыеH2SiO3
- 13. Правила техники безопасности при работе с кислотами1.
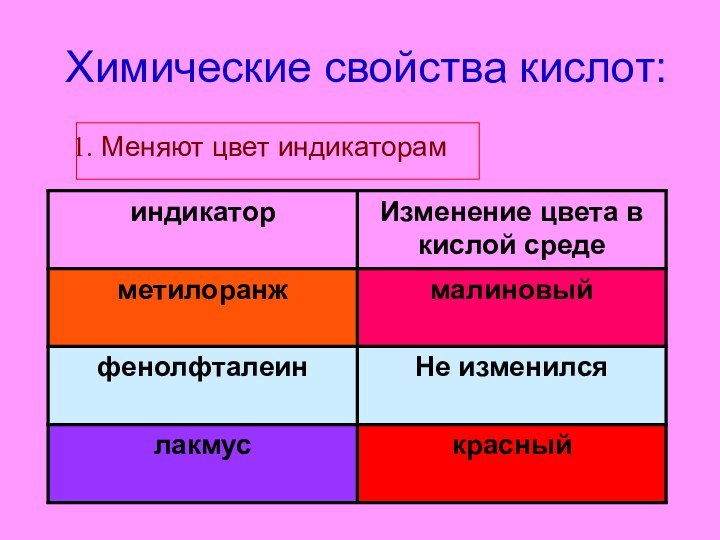
- 14. Химические свойства кислот:Меняют цвет индикаторам
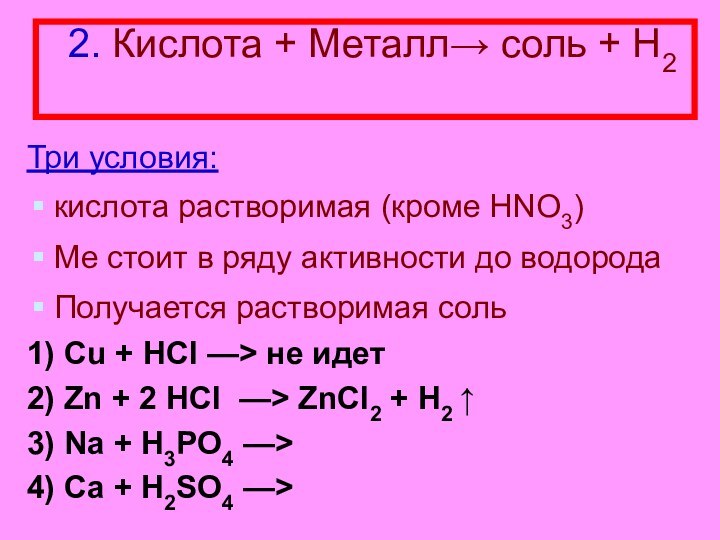
- 15. 2. Кислота + Металл→ соль + Н2
- 16. 3. Кислота + основной оксид → соль
- 17. 4. Кислота + амфотерный оксид → соль
- 18. 5. Кислота + основание → соль +
- 19. 6. Кислота + соль → соль* +
- 20. 7. При нагревании некоторые кислоты разлагаются. Как
- 21. Способы получения кислот:1. Кислотный оксид + Н2О
- 22. Скачать презентацию
- 23. Похожие презентации
Кислоты – это сложные неорганические соединения, состоящие из протона водорода и кислотного остатка









Слайд 2 Кислоты – это сложные неорганические соединения, состоящие из
протона водорода и кислотного остатка
Слайд 13
Правила техники безопасности при работе с кислотами
1. При
разбавлении кислот водой следует кислоту тонкой струйкой при перемешивании
наливать в воду, а не наоборот.2. Если случайно кислота попадет на руку или на одежду, то немедленно смойте ее большим количеством воды, а потом обработайте место раствором гидрокарбоната натрия (соды).
Слайд 15
2. Кислота + Металл→ соль + Н2
Три условия:
кислота растворимая (кроме HNO3)
Ме стоит в ряду активности до
водородаПолучается растворимая соль
1) Cu + НСl —> не идет
2) Zn + 2 HCl —> ZnCI2 + H2 ↑
3) Na + H3PO4 —>
4) Ca + H2SO4 —>
Слайд 16 3. Кислота + основной оксид → соль +
Н2О
Условия:
Все кислоты кроме нестабильных (H2CO3, H2SiO3)
Образуется растворимая соль
1)
2 HCl + CaO —> CaCl2 + H2O2) HNO3 + K2O —>
t
3) HCl + CuO —>
Слайд 17 4. Кислота + амфотерный оксид → соль +
Н2О
Условия:
Все кислоты кроме нестабильных (H2CO3, H2SiO3)
Образуется растворимая
соль1) 6 HCl + Al2O3 —> 2 AlCl3 + 3 H2O
2) HNO3 + ZnO —>
3) HCl + BeO —>
Слайд 18 5. Кислота + основание → соль + Н2О
(реакция нейтрализации)
1) H2SO4 + 2 KOH —> K2SO4 +
2 H2O2) HCl + Al(OH)3 —>
3) HNO3 + Zn(OH)2 —>
Слайд 19 6. Кислота + соль → соль* + кислота*
Должно выполняться одно из двух условий:
Один из продуктов
реакции – летучее вещество (газ)Один из продуктов реакции выпадает в осадок
1) 2 HCl + CaCO3 —> CaCl2 + H2O + CO2↑
2) H2SO4 + BaCl2 —> BaSO4↓ + 2 HCl
3) HCl + AgNO3 —>
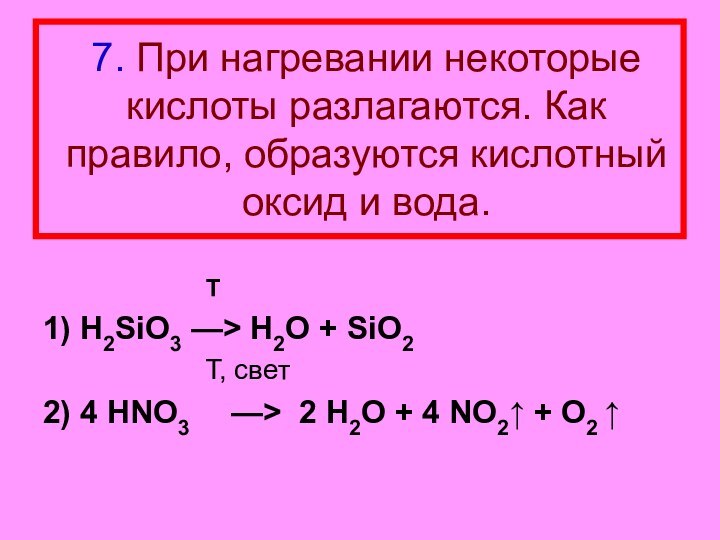
Слайд 20 7. При нагревании некоторые кислоты разлагаются. Как правило,
образуются кислотный оксид и вода.
Т1) H2SiO3 —> H2O + SiO2
T, свет
2) 4 HNO3 —> 2 H2O + 4 NO2↑ + O2 ↑
Слайд 21
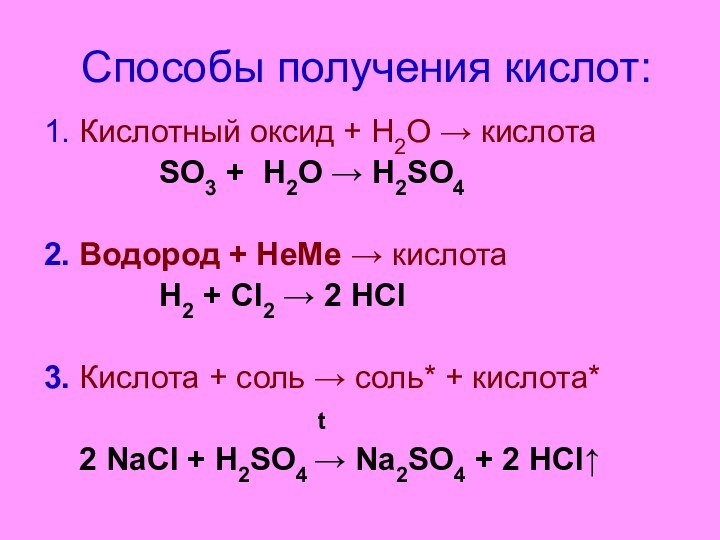
Способы получения кислот:
1. Кислотный оксид + Н2О →
кислота
SO3 +
H2O → H2SO42. Водород + НеМе → кислота
Н2 + Cl2 → 2 HCl
3. Кислота + соль → соль* + кислота*
t
2 NaCl + H2SO4 → Na2SO4 + 2 HCl↑