- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Окислительно-восстановительные равновесия в аналитической химии
Содержание
- 2. План лекции:Использование ОВР в аналитической химии.Типы ОВР.Количественное
- 3. Использование ОВР в аналитической химииПри пробоподготовке для
- 4. Например, при гипоксии (состояние кислородного голодания) происходит
- 5. Типы ОВР 1. Межмолекулярные – изменяются степени окисления (С.О.) атомов элементов, входящих в состав разных веществ:
- 6. 2. Внутримолекулярные – окислитель и восстановитель - атомы одной молекулы:
- 7. 3. Самоокисления – самовосстановления (диспропорционирования) – один
- 8. Количественное описание ОВР Например, чем сильнее основание, тем
- 9. Рассматривая ОВ пару в целом, можно записать
- 10. При температуре 298 К уравнение Нернста принимает вид:
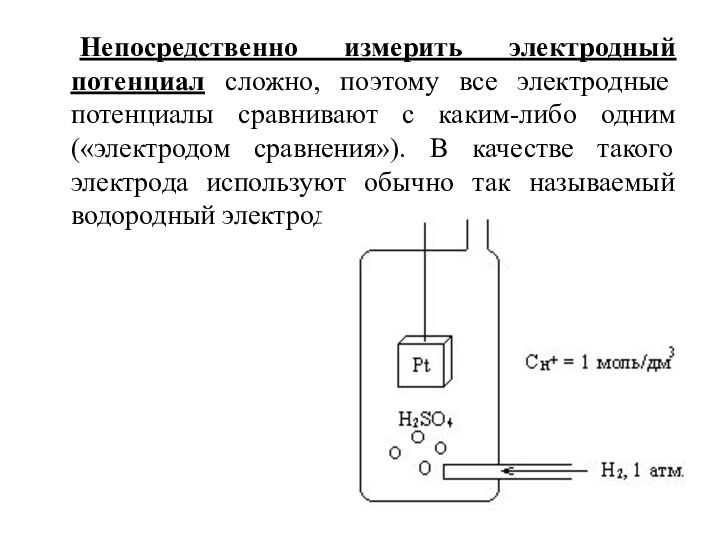
- 11. Непосредственно измерить электродный потенциал сложно, поэтому все
- 12. В уравнении Нернста можно использовать вместо активностей
- 13. На силу окислителя и восстановителя могут влиять:
- 14. Для расчета реального потенциала полуреакций, получаемых сочетанием
- 15. ∙ если восстановленная форма представляет собой малорастворимое соединение:
- 16. Сочетание ОВР и реакций комплексообразования ∙ если окисленная форма связана в комплекс:
- 17. ∙ если восстановленная форма связана в комплекс:
- 18. ∙ если обе формы связаны в комплекс:
- 19. Сочетание ОВР и реакций протонирования если протонируется окисленная форма:
- 20. если протонируется восстановленная форма:
- 21. если протонируются обе формы:
- 22. если реакция протекает по следующему уравнению: Ox
- 23. Константа равновесия ОВРРасчет константы равновесия для реакции: Sn2+ + 2Fe3+ = Sn4+ + 2Fe2+Константа равновесия рассчитывается:
- 24. Выражения для реальных ОВ потенциалов каждой редокс-пары будут выглядеть следующим образом:
- 25. В условиях равновесия:
- 26. Проведя математические операции, получим: К = 1021
- 27. Используя приведенное вычисление константы равновесия, получим для любого обратимого ОВ процесса при 20 0С следующее уравнение:
- 28. Например, в цериметрии (окислитель Се4+): Fe2+ +
- 29. Скачать презентацию
- 30. Похожие презентации
План лекции:Использование ОВР в аналитической химии.Типы ОВР.Количественное описание ОВР. Константа равновесия ОВР. Устойчивость водных растворов окислителей и восстановителей.
















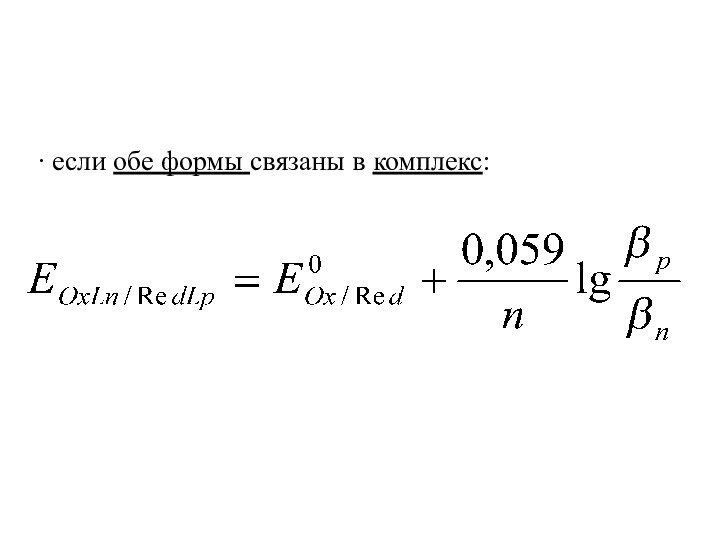











Слайд 2
План лекции:
Использование ОВР в аналитической химии.
Типы ОВР.
Количественное описание
ОВР.
восстановителей.
Слайд 3
Использование ОВР в аналитической химии
При пробоподготовке для переведения
в раствор пробы.
Для разделения смеси ионов.
Для маскирования.
Для проведения
реакций обнаружения катионов и анионов в качественном химическом анализе. В титриметрическом анализе.
В электрохимических методах анализа.
Слайд 4 Например, при гипоксии (состояние кислородного голодания) происходит замедление
транспорта Н+ и е – в дыхательной цепи и
накопление восстановленных форм соединений. Этот сдвиг сопровождается снижением ОВ потенциала (ОВП) ткани и по мере углубления ишемии (местное малокровие, недостаточное содержание крови в органе или ткани) ОВП снижается. Это связано как с угнетением процессов окисления вследствие недостатка кислорода и нарушения каталитической способности окислительно-восстановительных ферментов, так и с активацией процессов восстановления в ходе гликолиза.
Слайд 5
Типы ОВР
1. Межмолекулярные – изменяются степени окисления (С.О.)
атомов элементов, входящих в состав разных веществ:
Слайд 7
3. Самоокисления – самовосстановления (диспропорционирования) – один и
тот же элемент повышает и понижает С.О.
Cl2 -
является окислителем и восстановителем.
Слайд 8
Количественное описание ОВР
Например, чем сильнее основание, тем больше
его сродство в протону. Также и сильный окислитель обладает
большим сродством к электрону.Например, в кислотно-основных реакциях участвует растворитель (вода), отдавая и принимая протон, а в ОВР вода тоже может терять или присоединять электрон.
Например, для проведения кислотно-основных реакций необходимы как кислота, так и основание, а в ОВР – и окислитель и восстановитель.
Слайд 9 Рассматривая ОВ пару в целом, можно записать схематичное
уравнение реакции:
Ox + nē = Red
Равновесие в растворе
можно описать с помощью равновесного потенциала, который зависит от состава раствора по уравнению Нернста:
Слайд 11 Непосредственно измерить электродный потенциал сложно, поэтому все электродные
потенциалы сравнивают с каким-либо одним («электродом сравнения»). В качестве
такого электрода используют обычно так называемый водородный электрод.Слайд 12 В уравнении Нернста можно использовать вместо активностей ионов
их концентрации, но тогда необходимо знать коэффициенты активностей ионов:
Слайд 13
На силу окислителя и восстановителя могут влиять:
значение
рН,
реакции осаждения
реакции комплексообразования.
Тогда свойства редокс-пары будут
описываться реальным потенциалом.
Слайд 14
Для расчета реального потенциала полуреакций, получаемых сочетанием
ОВР
и реакций осаждения, используются формулы:
∙ если окисленная форма представляет собой
малорастворимое соединение:
Слайд 23
Константа равновесия ОВР
Расчет константы равновесия для реакции:
Sn2+ +
2Fe3+ = Sn4+ + 2Fe2+
Константа равновесия рассчитывается:
Слайд 24 Выражения для реальных ОВ потенциалов каждой редокс-пары будут
выглядеть следующим образом:
Слайд 27 Используя приведенное вычисление константы равновесия, получим для любого
обратимого ОВ процесса при 20 0С следующее уравнение:
Слайд 28 Например, в цериметрии (окислитель Се4+): Fe2+ + Се4+ =
Fe3+ + Се3+
К = 1011,4 = 2,3 ·
1011