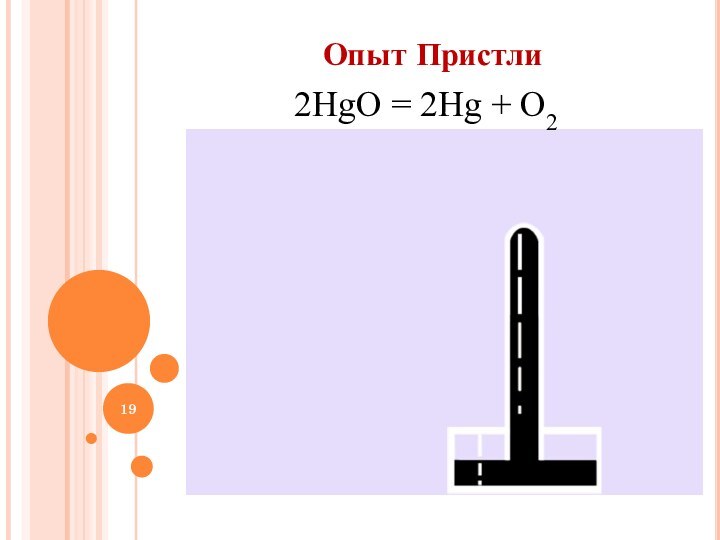
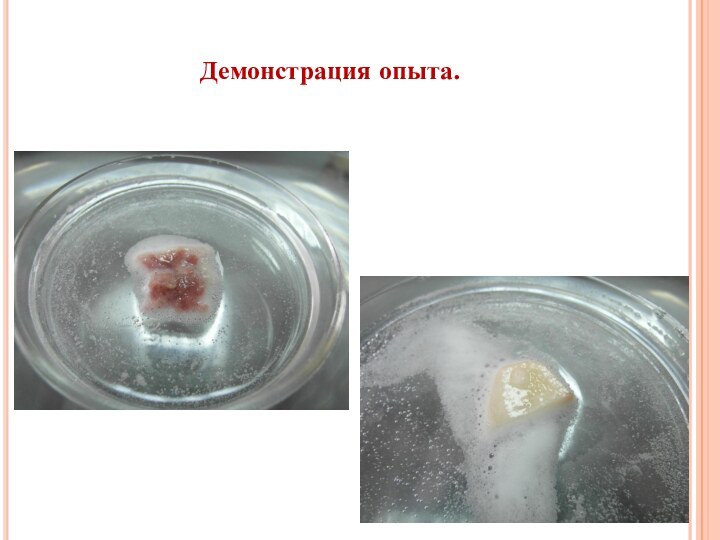
в природе;
дать общую характеристику элементу кислород;
изучить способы получения
кислорода в промышленности и лаборатории; рассмотреть понятие «катализатор».
ЦЕЛИ УРОКА: