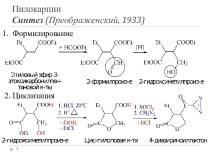
Слайд 3
Химия-это наука, изучающая процессы превращения веществ, сопровождающиеся изменением
состава и структуры, а так же взаимные переходы между
этими процессами и другими формами движения материи.
Объектами изучения химии являются вещества и их мельчайшие частицы- молекулы и атомы.
Молекула - наименьшая частица вещества, обладающая его химическими свойствами.
Атом - наименьшая частица химического элемента, обладающая его химическими свойствами. Атомы являются составными частями молекул.
Химический элемент-вид атомов, характеризующийся определенной совокупностью свойств. При соединении друг с другом атомов одного и того же элемента образуются простые вещества; сочетание атомов различных элементов дает сложные вещества.
Слайд 4
Относительная атомная (молекулярная) масса (Ar или Mr )
– масса атома ( молекулы) в относительных единицах [а.е.м.].
Она вычисляется как отношение средней атомной массы элемента к 1/12 части массы атома углерода 12С. Значения Ar атомов приводятся в периодической системе элементов. Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов, входящих в состав молекулы.
Моль- это единица измерения количества вещества, содержащая столько молекул, атомов и других структурных единиц, сколько их содержится в 12 г изотопа углерода 12С.
Число структурных единиц, содержащееся в 1 моль вещества, называется числом Авогадро (NA ): NA=6.02*1023 моль-1 .
Слайд 5
Молярная масса (М) -масса одного моля вещества [г/моль]
(численно равна относительной молекулярной массе вещества).
Количество вещества n=m/M=N/ NA
(моль).
Атомы соединяются в молекулы в соответствии с их валентностями.
Элементы, имеющие постоянную валентность: водород – I; кислород –II (кроме перекиси водорода – Н2О2);фтор-I; хлор, бром, йод-I (в бинарных соединениях, состоящих из атомов двух элементов и не содержащих кислорода); сера, селен, теллур –II (в бинарных соединениях, состоящих из атомов двух элементов и не содержащих кислорода); литий, натрий, калий, рубидий, цезий – I; кальций, магний, барий- II; алюминий- III.
Слайд 6
Степень окисления- это условный заряд атома в молекуле.
В простых соединениях степень окисления численно равна валентности элемента,
но имеет знак «+» или «-». В бинарных соединениях отрицательный заряд приобретают атомы, имеющие более неметаллические свойства ( в периодической системе они находятся правее и выше).В названиях бинарных соединений название элемента, имеющего отрицательную степень окисления, имеет окончание «ид». Например, Na2Se-селенид натрия.
Слайд 7
Реакция соединения: (из двух веществ образуется одно более
сложное):S+O2=SO2; CaO+CO2=CaCO3
Реакция разложения: (из одного вещества образуется несколько более
простых):Fe(OH)2= FeO+H2O
Реакция замещения:Mg+2HCl=MgCl2+H2
Реакция обмена:BaCl2+H2 SO4=Ba SO4+2HCl




![Основные понятия химии Молярная масса (М) -масса одного моля вещества [г/моль] (численно равна относительной молекулярной](/img/tmb/13/1263210/2e1afd2e9537d9700a240d3d6065ff77-720x.jpg)