- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Периодический закон и периодическая система химических элементов Д.И. Менделеева
Содержание
- 2. ПС элементов была предложена выдающимся русским химиком Д.И. Менделеевымв 1869 году
- 3. ПЕРИОДИЧЕСКИЙ ЗАКОНСвойства простых веществ и соединений, которые
- 4. ПЕРИОДИЧЕСКИЙ ЗАКОНПериодический закон был сформулирован почти за
- 5. ПС ЭЛЕМЕНТОВ ЧАСТО ИСПОЛЬЗУЕМАЯ В РОССИИ (короткопериодный вариант)
- 6. ОФИЦИАЛЬНАЯ ПС ЭЛЕМЕНТОВ ИЮПАК (длиннопериодный вариант)
- 7. СТРУКТУРА ПСЛантаниды (лантаноиды) – 4f элементы (ид
- 8. Закономерности изменения свойств атомов и ионовК числу
- 9. Закономерности изменения свойств атомов и ионовОдна из
- 10. Металлический радиус Металлический радиус (для металлов) –половина расстояния между ядрами соседних атомов
- 11. Ковалентный радиус Ковалентный радиус (для неметаллов) –половина
- 12. Ионный радиус Ионный радиус (для ионных соединений)
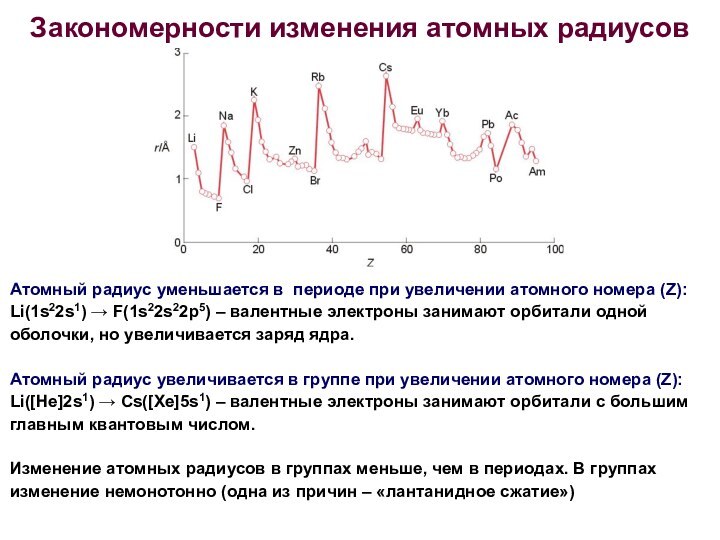
- 13. Закономерности изменения атомных радиусовАтомный радиус уменьшается в
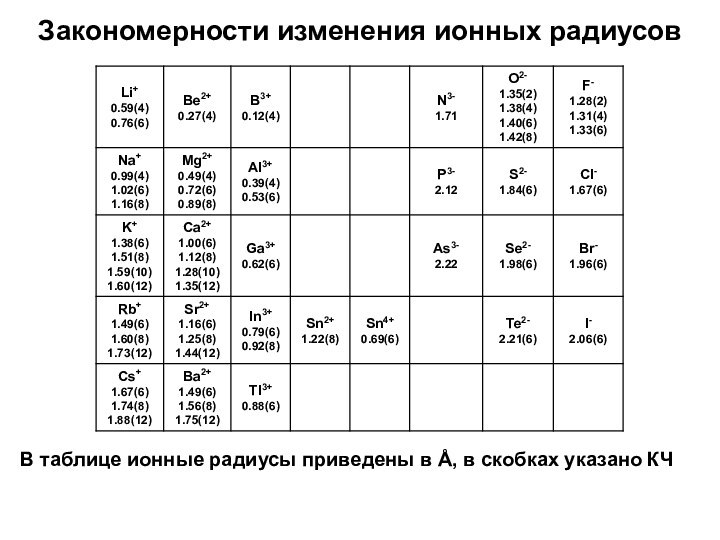
- 14. Закономерности изменения ионных радиусовВ таблице ионные радиусы приведены в Å, в скобках указано КЧ
- 15. Закономерности изменения ионных радиусовИонный радиус зависит от
- 16. Закономерности изменения ионных радиусов для переходных
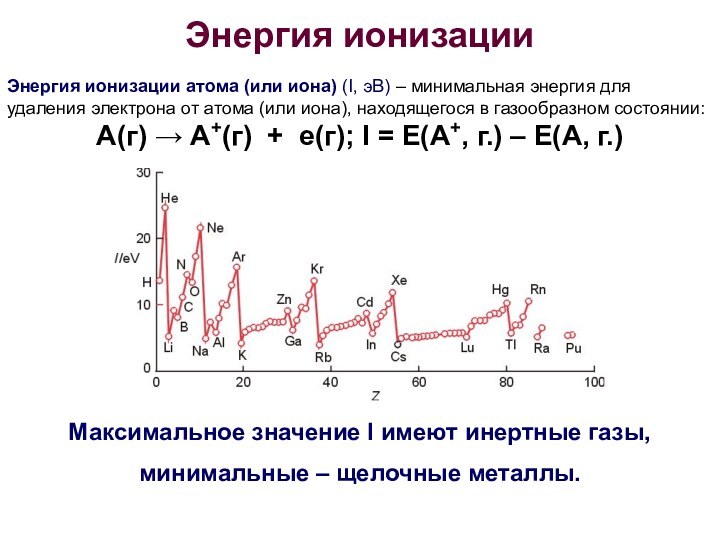
- 17. Энергия ионизации Энергия ионизации атома (или иона)
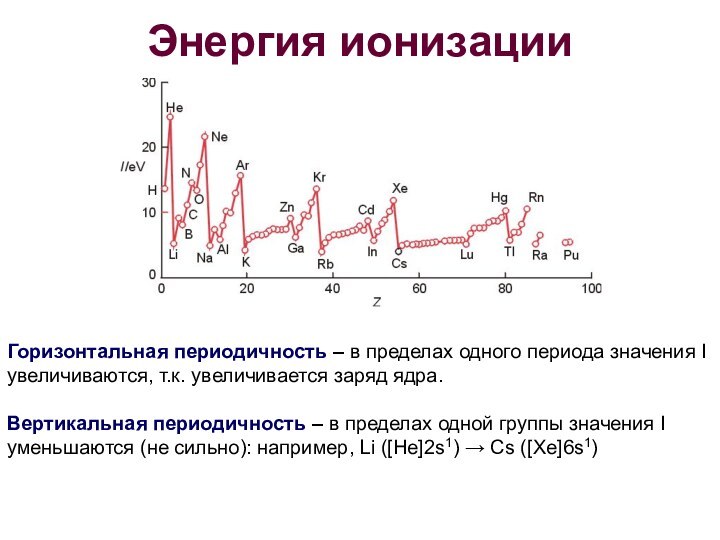
- 18. Энергия ионизацииГоризонтальная периодичность – в пределах одного
- 19. Энергия ионизацииПримеры отклонений в плавном изменении значений
- 20. Электроотрицательность Электроотрицательность (χ) – способность элемента притягивать
- 21. ЭлектроотрицательностьЭлектроотрицательность увеличивается в периоде при увеличении атомного
- 22. Закономерности изменения кислотно-основных свойств гидроксидов элементовОсновные свойства:
- 23. Закономерности изменения кислотно-основных свойств гидроксидов элементовУменьшение основных
- 24. Кислотные свойства бескислородных кислот НЭДва фактора (изменение
- 25. Эмпирическая корреляция между строением и силой кислоты
- 26. Некоторые закономерности изменения окислительно-восстановительных свойствЭ + 2е
- 27. Окислительно-восстановительные свойства соединений элементов в высших степенях
- 28. Скачать презентацию
- 29. Похожие презентации
ПС элементов была предложена выдающимся русским химиком Д.И. Менделеевымв 1869 году
















Слайд 3
ПЕРИОДИЧЕСКИЙ ЗАКОН
Свойства простых веществ и соединений, которые они
образуют, находятся в периодической зависимости от величины атомного номера
элемента.В основу современной классификации элементов положен главный признак – заряд ядра и электронная конфигурация атомов.
Слайд 4
ПЕРИОДИЧЕСКИЙ ЗАКОН
Периодический закон был сформулирован почти за полстолетия
до открытия электрона!
Сформулированный закон позволил:
уточнить атомные массы многих
известных Менделееву элементов;предсказать существование и свойства неизвестных в то время элементов
(экасилиция (германия), экабора (галлия) и экаалюминия (скандия).
Графическим отображением ПЗ является ПС
Слайд 7
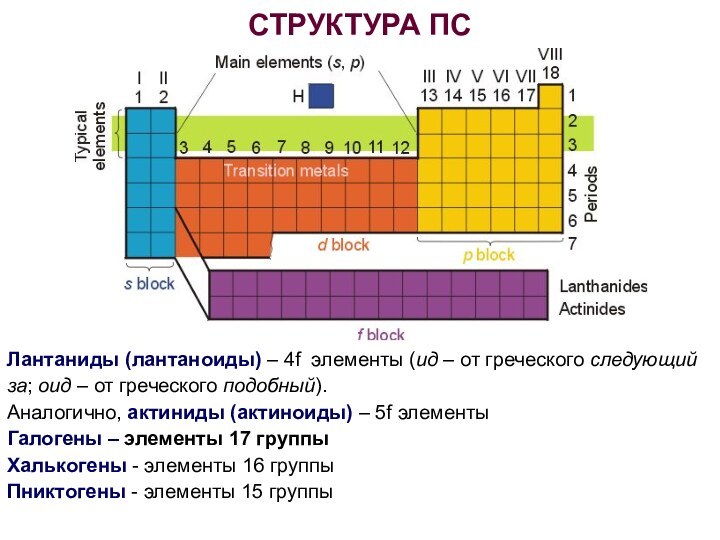
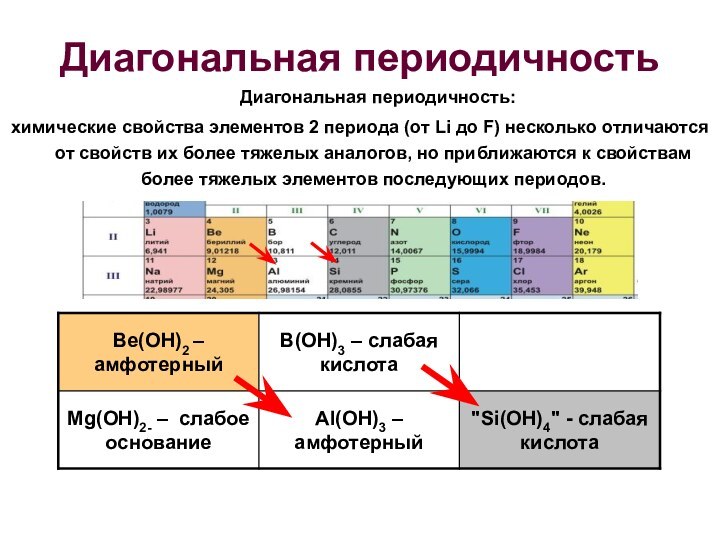
СТРУКТУРА ПС
Лантаниды (лантаноиды) – 4f элементы (ид –
от греческого следующий за; оид – от греческого подобный).
Аналогично,
актиниды (актиноиды) – 5f элементыГалогены – элементы 17 группы
Халькогены - элементы 16 группы
Пниктогены - элементы 15 группы
Слайд 8
Закономерности изменения свойств атомов и ионов
К числу важнейших
свойств элементов, определяемых электронным строением, относятся:
радиусы;
потенциалы ионизации;
сродство к электрону;электроотрицательность.
Все эти характеристики закономерно изменяются по периодам и группам
Слайд 9
Закономерности изменения свойств атомов и ионов
Одна из основных
характеристик атомов и ионов – их размеры.
Строение соединений –
расположение атомов в пространстве (расстояния между атомами, углы).Единица измерения расстояний - 1Å
Слайд 10
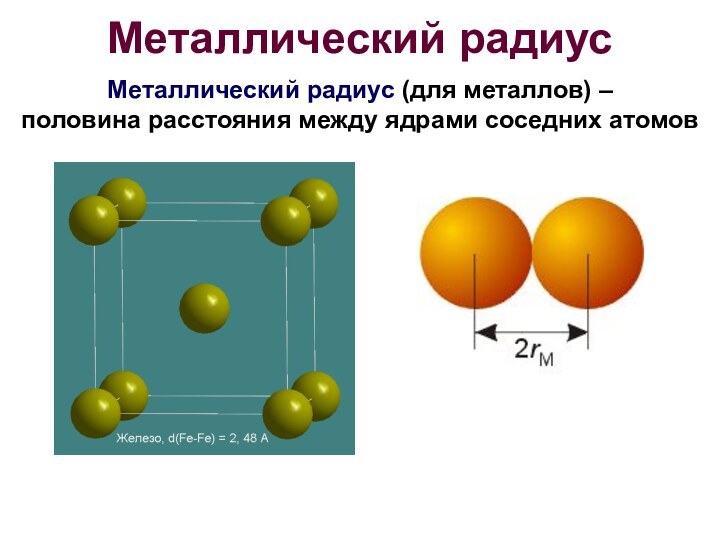
Металлический радиус
Металлический радиус (для металлов) –
половина расстояния
между ядрами соседних атомов
Слайд 11
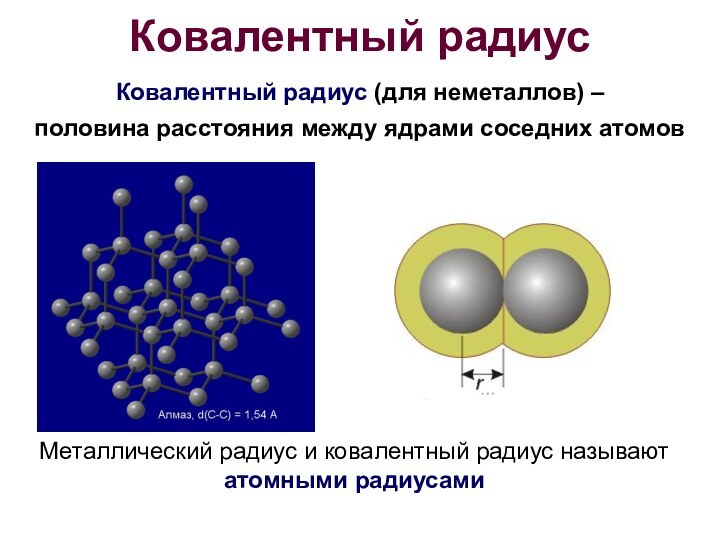
Ковалентный радиус
Ковалентный радиус (для неметаллов) –
половина расстояния
между ядрами соседних атомов
Металлический радиус и ковалентный радиус
называют атомными радиусами
Слайд 12
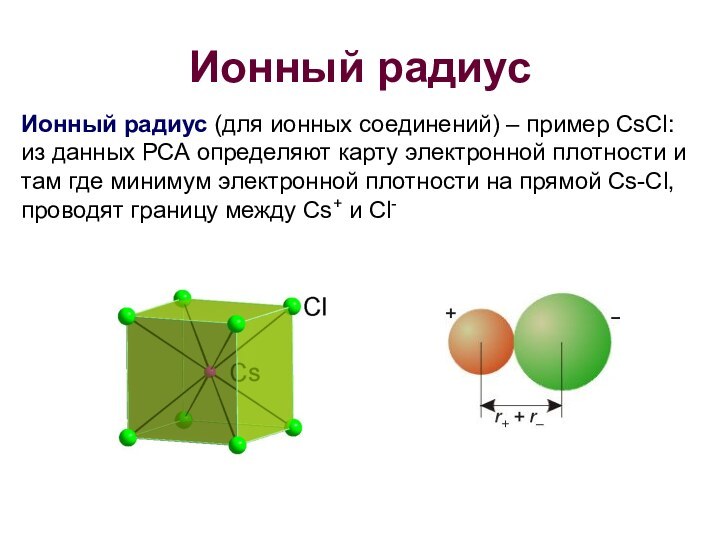
Ионный радиус
Ионный радиус (для ионных соединений) –
пример CsCl: из данных РСА определяют карту электронной плотности
и там где минимум электронной плотности на прямой Cs-Cl, проводят границу между Cs+ и Cl-
Слайд 13
Закономерности изменения атомных радиусов
Атомный радиус уменьшается в периоде
при увеличении атомного номера (Z):
Li(1s22s1) → F(1s22s22p5) – валентные
электроны занимают орбитали одной оболочки, но увеличивается заряд ядра.Атомный радиус увеличивается в группе при увеличении атомного номера (Z):
Li([He]2s1) → Cs([Xe]5s1) – валентные электроны занимают орбитали с большим главным квантовым числом.
Изменение атомных радиусов в группах меньше, чем в периодах. В группах изменение немонотонно (одна из причин – «лантанидное сжатие»)
Слайд 14
Закономерности изменения ионных радиусов
В таблице ионные радиусы приведены
в Å, в скобках указано КЧ
Слайд 15
Закономерности изменения ионных радиусов
Ионный радиус зависит от координационного
окружения (КЧ) –
чем больше КЧ, тем больше радиус.
В пределах
периода размеры анионов больше размеров катионов (упрощенно: катионы – маленькие, анионы – большие).Ионный радиус увеличивается в группе при увеличении атомного номера: Li+ ([He] → Cs+ ([Xe]).
Изоэлектронные катионы – Na+, Mg2+, Al3+ имеют одинаковую электронную конфигурацию [Ne], но отличаются зарядом, ионный радиус сильно уменьшается.
Изоэлектронные анионы – P3-, S2-, Cl- имеют одинаковую электронную конфигурацию [Ar], но отличаются зарядом, ионный радиус уменьшается
Слайд 16
Закономерности изменения ионных радиусов
для переходных металлов
В периоде:
Ti2+ (1,00 Å) → Ni2+ (0,83 Å) –
уменьшение радиуса катиона, но различия небольшие.
Зависимость от заряда: Fe2+ (0,75 Å) → Fe3+ (0,69 Å). Больше положительный заряд, меньше ионный радиус.
Слайд 17
Энергия ионизации
Энергия ионизации атома (или иона) (I,
эВ) – минимальная энергия для удаления электрона от атома
(или иона), находящегося в газообразном состоянии:А(г) → А+(г) + е(г); I = E(A+, г.) – E(A, г.)
Максимальное значение I имеют инертные газы,
минимальные – щелочные металлы.
Слайд 18
Энергия ионизации
Горизонтальная периодичность – в пределах одного периода
значения I увеличиваются, т.к. увеличивается заряд ядра.
Вертикальная периодичность –
в пределах одной группы значения I уменьшаются (не сильно): например, Li ([He]2s1) → Cs ([Xe]6s1)
Слайд 19
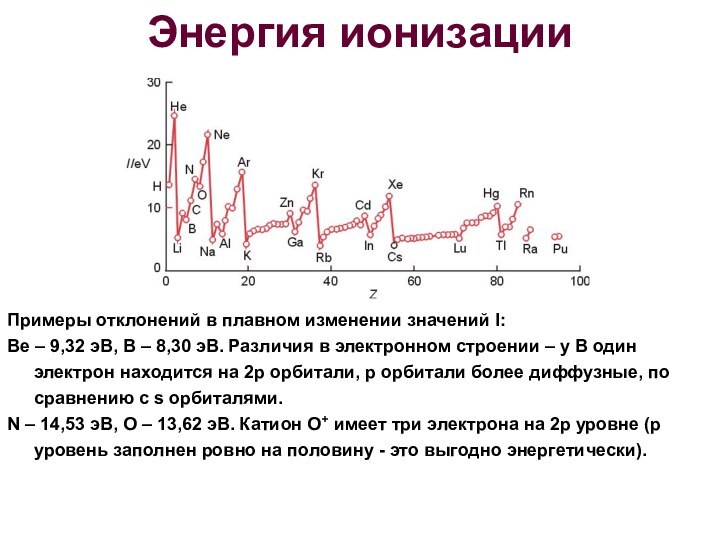
Энергия ионизации
Примеры отклонений в плавном изменении значений I:
Be
– 9,32 эВ, В – 8,30 эВ. Различия в
электронном строении – у В один электрон находится на 2p орбитали, р орбитали более диффузные, по сравнению с s орбиталями.N – 14,53 эВ, O – 13,62 эВ. Катион O+ имеет три электрона на 2р уровне (p уровень заполнен ровно на половину - это выгодно энергетически).
Слайд 20
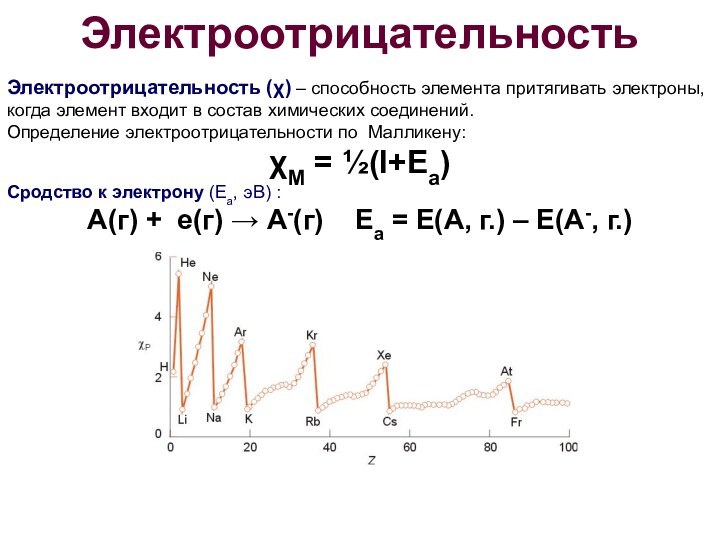
Электроотрицательность
Электроотрицательность (χ) – способность элемента притягивать электроны,
когда элемент входит в состав химических соединений.
Определение электроотрицательности по
Малликену: χМ = ½(I+Ea)
Сродство к электрону (Ea, эВ) :
А(г) + е(г) → А-(г) Ea = E(A, г.) – E(A-, г.)
Слайд 21
Электроотрицательность
Электроотрицательность увеличивается в периоде при увеличении атомного номера
элемента.
Электроотрицательность уменьшается в группе при увеличении атомного номера элемента.
Слайд 22
Закономерности изменения кислотно-основных свойств гидроксидов элементов
Основные свойства: ЭОН
→ Э+ + ОН-
Кислотные свойства: ЭОН → ЭО-
+ Н+Изменение по группе:
увеличение ионного радиуса приводит к ослаблению связи с ОН-
Слайд 23
Закономерности изменения кислотно-основных свойств гидроксидов элементов
Уменьшение основных свойств
коррелирует с увеличением заряда катиона и уменьшением радиуса катиона
Слайд 24
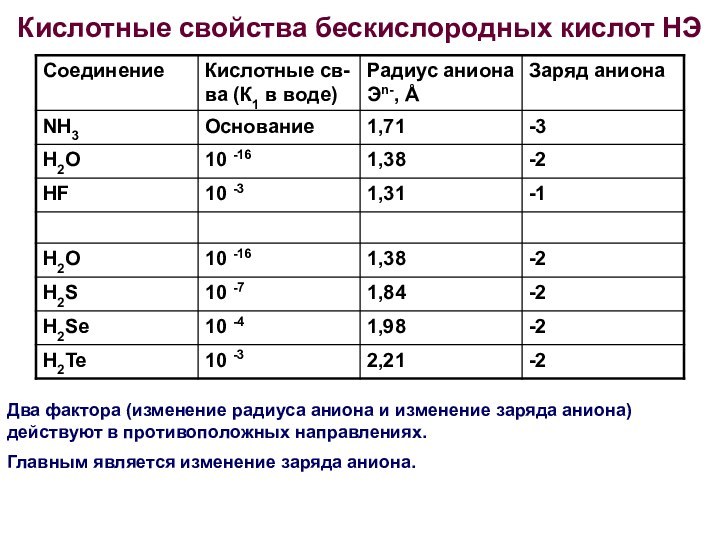
Кислотные свойства бескислородных кислот НЭ
Два фактора (изменение радиуса
аниона и изменение заряда аниона) действуют в противоположных направлениях.
Главным
является изменение заряда аниона.
Слайд 25
Эмпирическая корреляция между строением и силой кислоты
(правила Полинга)
Можно
предсказать относительную силу кислот:
для кислородсодержащих кислот:
сила кислоты Э(ОН)nОm тем
выше, чем больше mрКа ~ 8 −5m;
для многоосновных кислот: при отщеплении каждого
последующего Н+ рКа увеличивается на ~5.
HClO ≡ Cl(OH) (m=0) – очень слабая кислота (рКа ~ 10−8);
HClO2 ≡ Cl(OH)О (m=1) – кислота средней силы (рКа ~ 10−2);
HClO3 ≡ Cl(OH)О2 (m=2) – сильная кислота;
HClO4 ≡ Cl(OH)О3 (m=3) – очень сильная кислота.
Н3РО4: рКа1 ~ 10−2; рКа2 ~ 10−6; рКа3 ~ 10−12.
Слайд 26
Некоторые закономерности изменения окислительно-восстановительных свойств
Э + 2е +
2Н+ → Н2Э (Э – халькоген)
Окислительные свойства уменьшаются в
ряду O2, S, Se, TeВосстановительные свойства увеличиваются в ряду H2O, H2S, H2Se, H2Te
Аналогичные закономерности для галогенов.
Э2 + 2е + 2Н+ → 2НЭ (Э – галоген)
Слайд 27
Окислительно-восстановительные свойства соединений элементов
в высших степенях окисления
Главные элементы
– s и p:
14 группа: CO2, SiO2, GeO2 –
практически не являются окислителями;PbO2 – сильный окислитель.
Переходные металлы:
5 группа: V(V) – окислитель,
Nb(V) и Ta(V) – не являются окислителями.
6 группа: Cr(VI) - окислитель,
Mo(VI) и W(VI) – не являются окислителями.
7 группа: Mn(VII) - окислитель,
Tc(VII) и Re(VII) – не являются окислителями.





























