Слайд 2
Тема урока: «Предельные одноосновные карбоновые кислоты»
Цель урока:
•Знать строение
одноосновных карбоновых кислот, их определение, изомеры, гомологи, название по
систематической номенклатуре.
•Уметь объяснять причины и следствия взаимного влияния атомов в молекулах карбоновых кислот.
•На примере муравьиной и уксусной кислот уметь составлять уравнения реакций, характеризующих химические свойства карбоновых кислот.
Слайд 3
Карбоновые кислоты
Давайте вспомним, какие классы кислородсодержащих органических веществ
мы уже знаем.
Каким образом генетически карбоновые кислоты связаны с
ранее изученным классом альдегидов?
Слайд 4
Все карбоновые кислоты имеют функциональную группу.
Что называется
карбоновыми кислотами?
Классификация карбоновых кислот:
В зависимости от числа карбоксильных групп
●
одноосновные – уксусная
● двухосновные – щавелевая
● многоосновные - лимонная
Слайд 5
2) В зависимости от природы радикала
● предельные –
пропионовая
● непредельные – акриловая
● ароматические – бензойная
? Задание
для самоконтроля
Изомерия карбоновых кислот
СН3-СН2-СН2-СООН
СН3-СН-СООН
l
СН3
Какой вид изомерии присущ карбоновым кислотам?
Номенклатура карбоновых кислот
? Задание для самоконтроля
Слайд 6
Многие кислоты имеют исторически сложившиеся
или
тривиальные названия, связанные главным образом с
источником их
получения.
Карбоновые кислоты в природе
Слайд 7
Более подробно рассмотрим предельные одноосновные карбоновые кислоты,
которые
образуют
гомологический ряд.
Общая формула
карбоновых кислот
Строение карбоксильной группы
Ответьте на вопросы:
Как
происходит перераспределение электронной плотности в карбоксильной группе?
В чем заключается взаимное влияние атомов в молекулах карбоновых кислот?
Как это будет отражаться на химических свойствах карбоновых кислот?
? Проверь себя
Слайд 8
Физические свойства карбоновых кислот
Физические свойства предельных карбоновых кислот
ТБ
Слайд 9
Почему среди кислот отсутствуют
газообразные вещества?
Это связано с ассоциацией молекул посредством водородных
связей.
Образованием водородных связей можно объяснить и растворимость карбоновых кислот в воде.
Химические свойства карбоновых кислот
Общие свойства карбоновых кислот аналогичны соответствующим свойствам неорганических кислот:
1. Диссоциация в водных растворах (среда кислая, индикаторы меняют окраску).
2. Карбоновые кислоты вступают в реакцию замещения с металлами, стоящими в ряду напряжений до водорода.
видео
Видео
Слайд 10
3. Карбоновые кислоты реагируют с основными оксидами с
образованием соли и воды.
4. Вступают в реакцию нейтрализации с
основаниями (щелочами и нерастворимыми) и амфотерными гидроксидами.
Задание: Напишите уравнение реакции взаимодействия уксусной кислоты с гидроксидом меди, назовите получившуюся соль.
5. Взаимодействуют с солями более слабых и летучих кислот, вытесняя их из солей.
видео
Видео
Видео
Слайд 11
6. Реакция этерификации – образование сложных эфиров при
взаимодействии карбоновых кислот со спиртами.
7. Кислоты могут образовывать кислотные
оксиды
(или ангидриды кислот).
Особые свойства кислот, обусловленных наличием в их молекулах радикалов. Реакция с галогенами.
? Какая из этих кислот сильнее? Почему?
Сл. эфиры
Слайд 15
Получение карбоновых кислот
Предельные карбоновые кислоты получают:
1. Окислением спиртов
2.
Окислением альдегидов
3. Окислением углеводородов
Существуют и другие способы получения карбоновых
кислот
Видео
Слайд 16
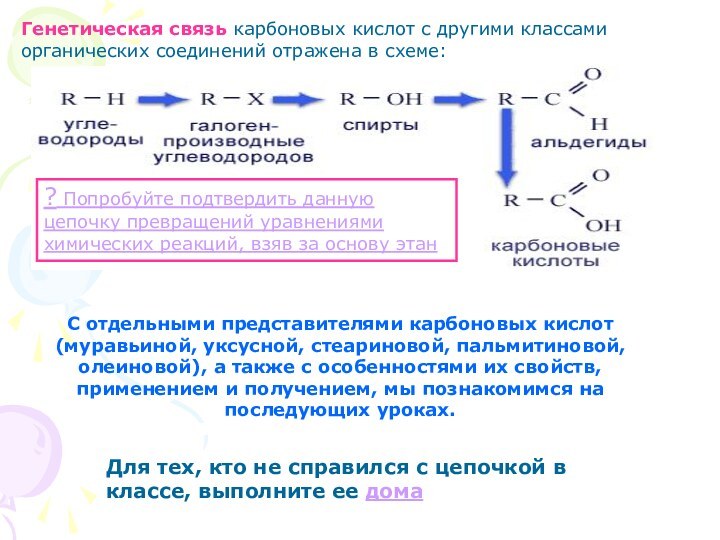
Генетическая связь карбоновых кислот с другими классами органических
соединений отражена в схеме:
? Попробуйте подтвердить данную цепочку превращений
уравнениями химических реакций, взяв за основу этан
С отдельными представителями карбоновых кислот (муравьиной, уксусной, стеариновой, пальмитиновой, олеиновой), а также с особенностями их свойств, применением и получением, мы познакомимся на последующих уроках.
Для тех, кто не справился с цепочкой в классе, выполните ее дома
Слайд 17
Тема урока: «Предельные одноосновные карбоновые кислоты»
Цель урока:
● Знать
строение одноосновных карбоновых кислот, их определение, изомеры, гомологи, названия
по систематической номенклатуре.
●Уметь объяснять причину и следствия взаимного влияния атомов в молекулах карбоновых кислот.
● Уметь составлять уравнения химических реакций, характеризующих химические свойства кислот
Слайд 18
Выводы:
Карбоновыми кислотами называются органические вещества, молекулы которых содержат
одну или несколько карбоксильных групп, соединенных с углеводородным радикалом.
Для
карбоновых кислот, как и для альдегидов, характерна изомерия углеродного скелета.
Молекулы карбоновых кислот образуют димеры.
Общие свойства, характерные для класса карбоновых кислот, обусловлены наличием в молекулах гидроксильной группы, которая содержит резко полярную связь между атомами водорода и кислорода. Для карбоновых кислот характерны свойства как общие с неорганическими кислотами, так и специфические, присущие только для органических кислот.
Слайд 19
Из перечисленных формул выберите формулу карбоновой кислоты
Слайд 20
Повторите определение карбоновых кислот.
Неправильно!
Подумайте еще.
Слайд 21
К сожалению Вы дали неверный ответ!
Вернитесь к теории.
Слайд 22
Теория Вами освоена.
Молодец!
Правильно!
Слайд 23
Номенклатура сложных эфиров
Сложные эфиры в природе
Назовите данные
природные эфиры
В
случае затруднения воспользуйтесь шпаргалкой
1.
2.
3.
Слайд 24
1.
Изобутилацетат или изобутиловый эфир уксусной кислоты
2.
Изопентилацетат или изопентиловый
эфир уксусной кислоты
3.
Этилпропионат или этиловый эфир пропионовой кислоты.
Слайд 25
Назовите карбоновые кислоты
СН2-СН2-СН2-СН-СН-СООН
l
l
СН3 СН3
СН3 СН3
l l
2. СН3-СН-С-СООН
l
СН3
В случае затруднения воспользуйтесь шпаргалкой
Проверь себя
Слайд 26
Проверь себя:
3,4 – диметилгексановая кислота
2,2,3 –
триметилбутановая кислота
Слайд 27
Проверь себя
2СН3-СООН +Сu(OH)2 → (СН3-СОО)2Сu + 2H2O
Ацетат меди
Слайд 31
В случае затруднений воспользуйтесь формулами для осуществления цепочки
превращений и выполните это задание дома
Слайд 33
Для определения названия кислоты в соответствии с номенклатурой
IUPAC нужно придерживаться следующего порядка:
Главную цепь выбирают таким образом,
чтобы атом углерода карбоксильной группы оказался в ней.
Нумерация атомов углерода главной цепи начинается с атома углерода карбоксильной группы.
Полное название данной кислоты образуется от названия алкана с тем же числом атомов углерода в молекуле с добавлением «-овая кислота».
Если углеводородный радикал разветвлен, то сначала называют номер атома углерода, при котором находится радикал, затем через дефис называют сам радикал. Обратите внимание, что отсутствие дефиса в данном случае считается за ошибку. Если с основной цепью соединены два различных радикала, то первым из них указывается наиболее простой. Если с основной цепью соединены два или более одинаковых радикалов, то их количество указывается с использованием соответствующих префиксов: -ди, -три, -тетра и т. д.
Слайд 34
Ответы на вопросы
● Электронная плотность в карбонильной группе

(особенно σ-связи) смещена в сторону кислорода, как более электроотрицательного
элемента. Вследствие этого карбонильный атом углерода приобретает частичный положительный заряд. Чтобы его компенсировать, он притягивает к себе электроны атома кислорода гидроксильной группы. Электронная плотность на атоме кислорода понижается и он смещает в свою сторону электронную плотность связи О – Н. Полярность связи в гидроксогруппе возрастает, водород становится подвижнее и легче отщепляется в виде протона, что обуславливает общие свойства карбоновых кислот.
● Влияние радикала на карбоксильную группу объясняется сдвигом электронной плотности к центральному атому углерода. В результате его частичный положительный заряд уменьшается и его действие на электронную плотность атома кислорода –ОН- группы ослабляется, а, значит, отщепление ионов водорода затрудняется. Как следствие – самая сильная-муравьиная кислота.
● Карбоксильная группа влияет на радикал таким образом, что наиболее легко замещаемым становится водород при α-углеродном атоме.
Слайд 35
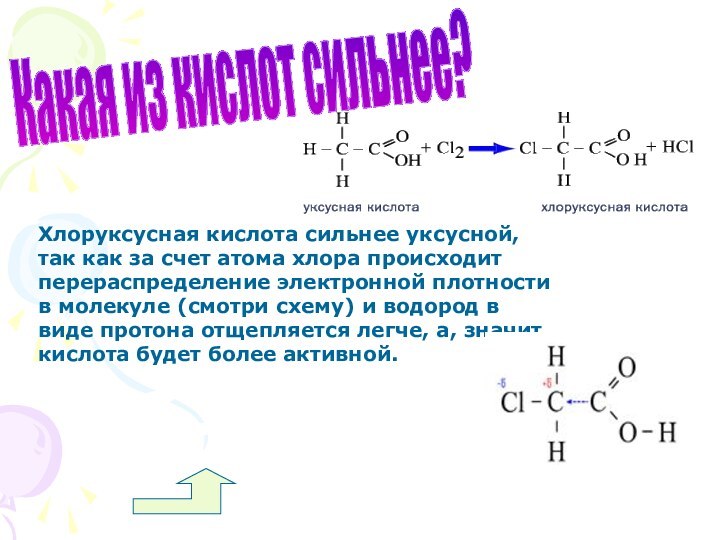
Какая из кислот сильнее?
Хлоруксусная кислота сильнее уксусной, так
как за счет атома хлора происходит перераспределение электронной плотности
в молекуле (смотри схему) и водород в виде протона отщепляется легче, а, значит, кислота будет более активной.
Слайд 36
Проверь свои знания по карбоновым кислотам
Реши задачу
Выполни тест
Реши
кроссворд
Слайд 37
Реши задачи
Задача 1 (для работы в классе).
Одноосновная
карбоновая кислота имеет следующий состав: углерод – 40%, водород
– 6,67%, кислород – 53,33%. Плотность паров этой кислоты по аргону равна 1,5. Исходя из этих данных, найдите молекулярную формулу этой кислоты.
Задача 2 (для работы дома).
Одноосновная карбоновая кислота имеет следующий состав: углерод – 48,65%, водород – 8,11%, кислород – 43,24%. Плотность паров этой кислоты по водороду равна 37. Найдите формулу этой карбоновой кислоты.
Реши задачу в тетради
Проверьте свое решение по шпаргалке
Слайд 38
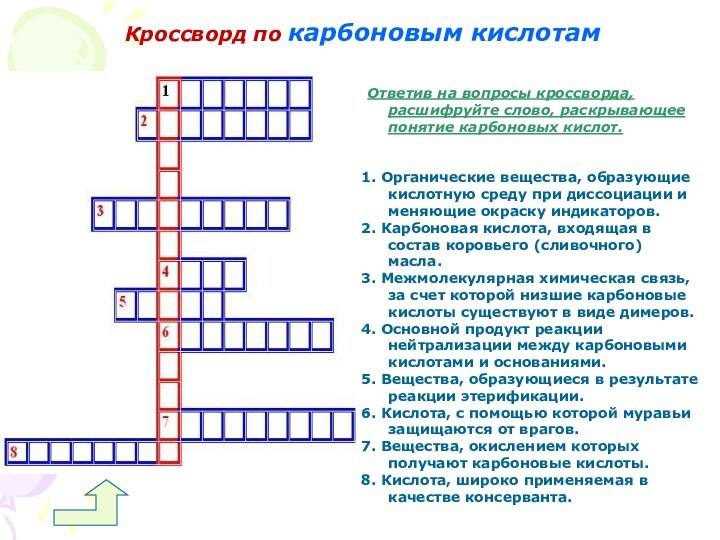
Кроссворд по карбоновым кислотам
Ответив на вопросы кроссворда,
расшифруйте слово, раскрывающее понятие карбоновых кислот.
1. Органические вещества, образующие
кислотную среду при диссоциации и меняющие окраску индикаторов.
2. Карбоновая кислота, входящая в состав коровьего (сливочного) масла.
3. Межмолекулярная химическая связь, за счет которой низшие карбоновые кислоты существуют в виде димеров.
4. Основной продукт реакции нейтрализации между карбоновыми кислотами и основаниями.
5. Вещества, образующиеся в результате реакции этерификации.
6. Кислота, с помощью которой муравьи защищаются от врагов.
7. Вещества, окислением которых получают карбоновые кислоты.
8. Кислота, широко применяемая в качестве консерванта.
Слайд 39
Решение задачи 1.
По данному образцу реши дома задачу
Слайд 40
Домашнее задание
Глава 8, §2;
Решить задачу №2 со слайда;
Выполнить
цепочку превращений со слайда (для тех, кто не сделал
ее в классе);
Осуществить поиск информации в сети Интернет по применению карбоновых кислот;
Выполнить творческое задание в программе «MS Power Point» по теме: «Карбоновые кислоты в жизни человека».