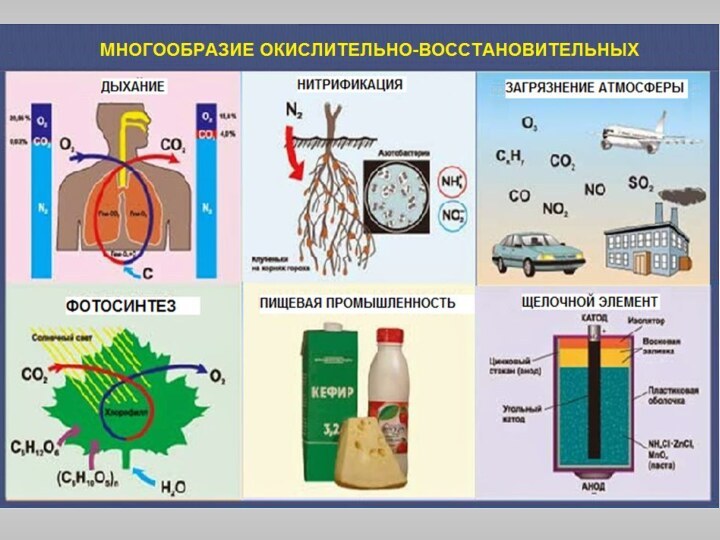
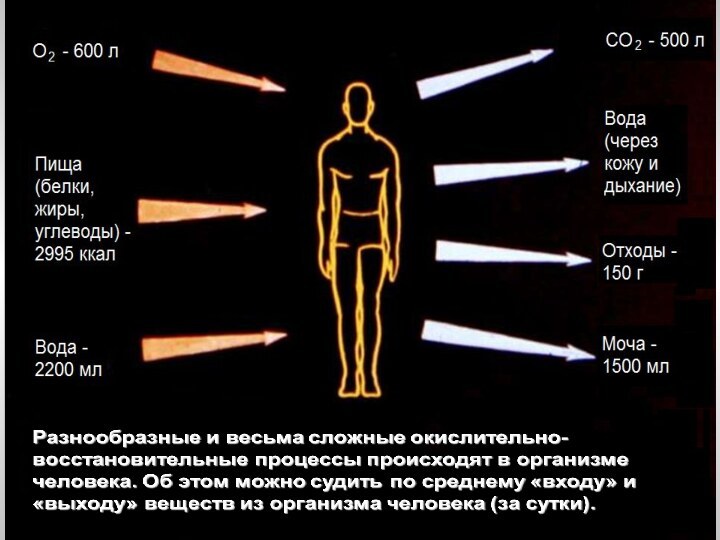
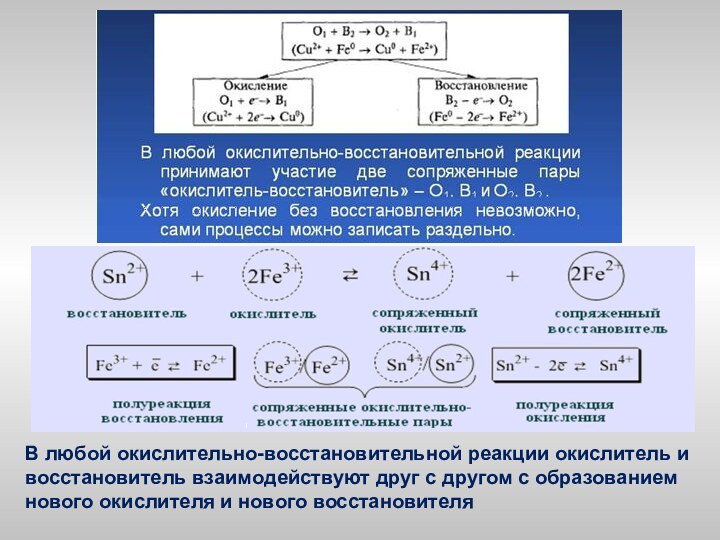
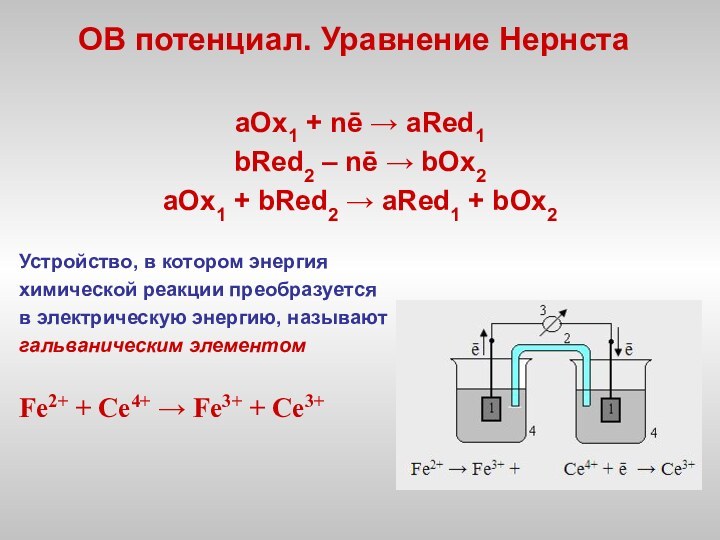
электронов атомом, молекулой или ионом:
Na° – ē → Na+
Н2О2
– 2ē → 2Н+ + О2SО32- + 2ОН‾ – 2ē → SO42- + Н2О
Восстановление – это процесс, при котором происходит присоединение электронов атомом, молекулой или ионом:
S° + 2ē → S2-
Н2О2 + 2Н+ + 2ē → 2Н2О
Сr2О72- + 14Н+ + 6ē → 2Сг3+ + 7Н2О
МnО4‾ + 8Н+ + 5ē → Мn2+ + 4Н2О