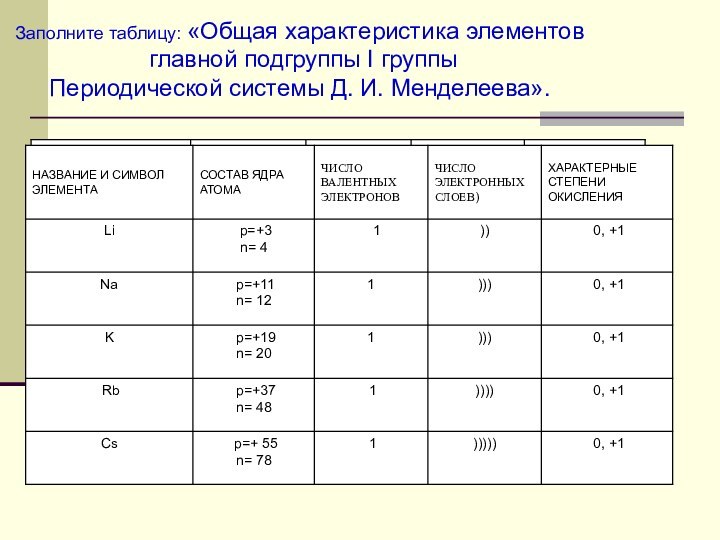
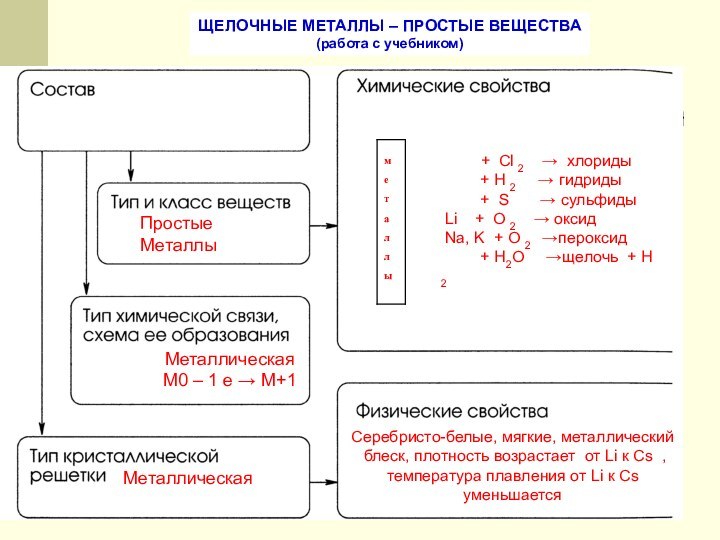
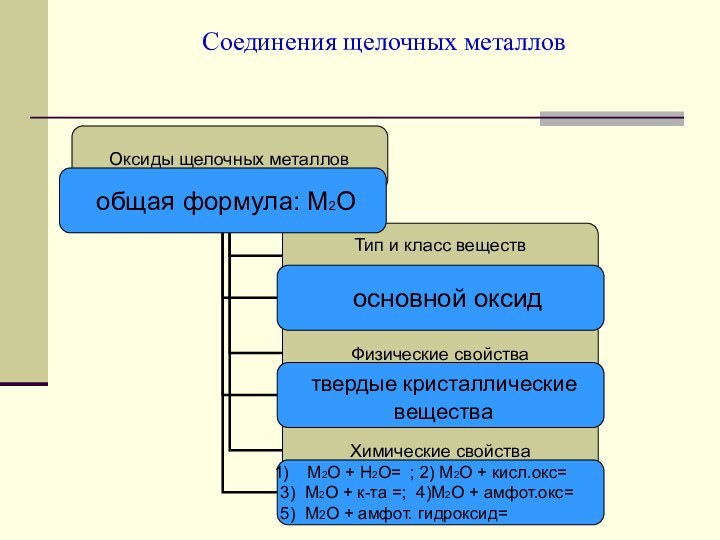
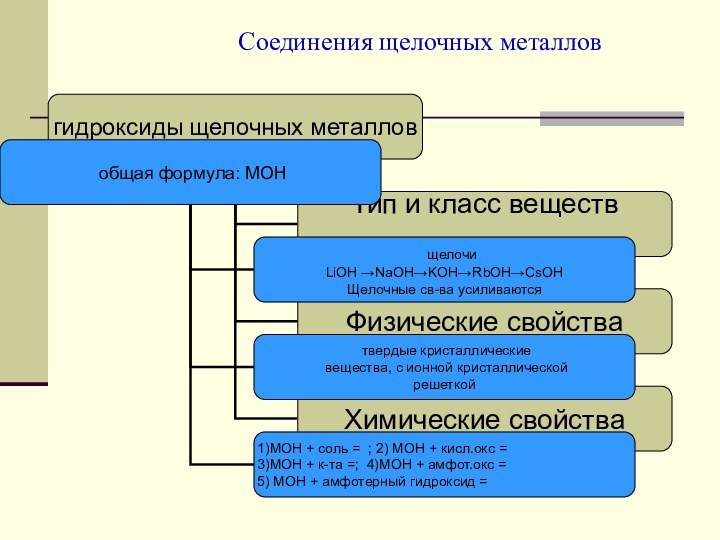
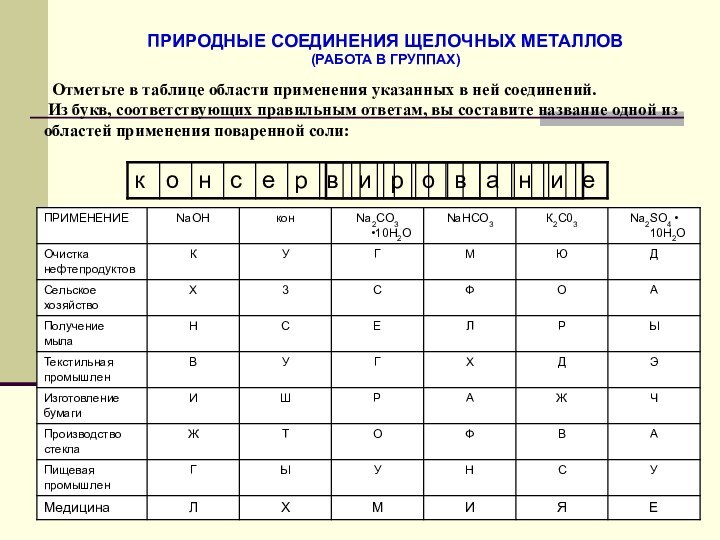
металлов в свете общего,
особенного и единичного по трем формам существования химических элементов: атомов, простых веществ и сложных веществ. Повторить
основные закономерности изменения свойств элементов в
Периодической системе (в группе), металлическую связь. Физические и
химические свойства металлов.
развивающая: способствовать дальнейшему развитию логического мышления
учащихся – формировать умение сравнивать, обобщать.
Продолжить развитее навыков самообразования: умение работать
с книгой, инструкцией, тестом.
воспитывающая: продолжить формирование диалектико-материалистического
учения: подтвердить на примере изучения данной темы причинно-
следственную зависимость, развитие от простого к сложному.