Слайд 2
Содержание
Подготовка к усвоению нового материала.
Изучение нового материала:
Понятие электролиза.
Виды
электродов.
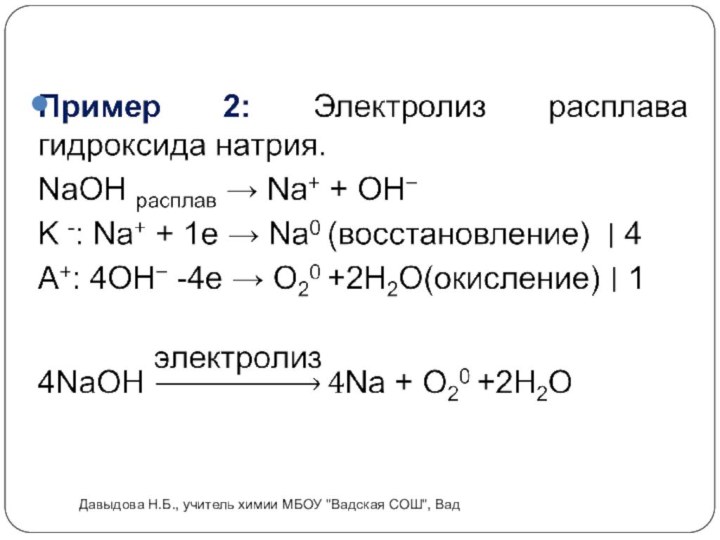
Электролиз расплавов.
Электролиз растворов.
Применение электролиза.
Закрепление и применение полученных знаний.
Подведение итогов.
Рефлексия.
Домашнее задание.
Список литературы.
Интернет-ресурсы.
Слайд 3
История открытия
1807 г. английский физик и химик Гемфри
Дэви с помощью электричества получил металлический калий и натрий
разложением едкого кали и едкого натра, считавшихся неразложимыми веществами.
Открытие Г. Дэви было сенсацией. До него никому не удавалось получить эти активнейшие металлы.
Сейчас процессы электролиза лежат в основе производства хлора, щелочей, фтора, щелочных металлов, алюминия и др. Сегодня электрохимия проникает в промышленность органического синтеза.
Слайд 4
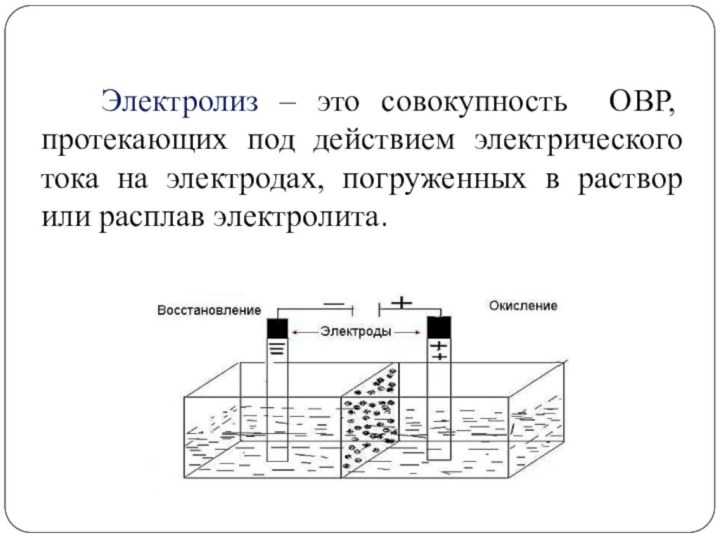
Электролиз – это совокупность ОВР, протекающих
под действием электрического тока на электродах, погруженных в раствор
или расплав электролита.
Слайд 5
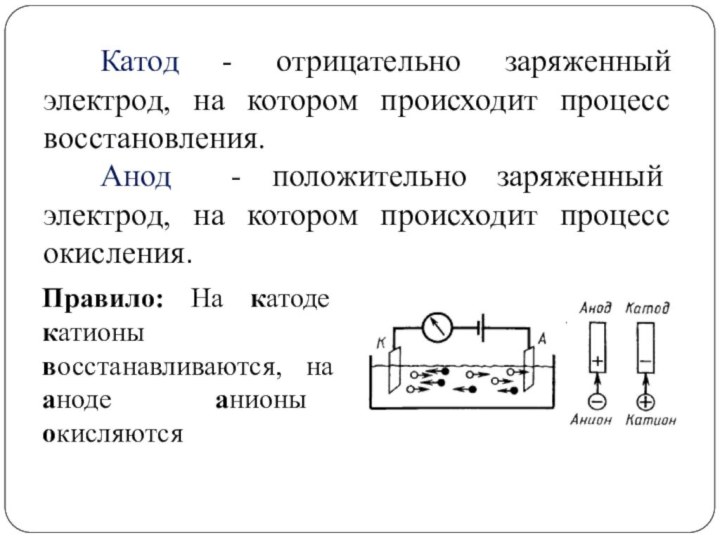
Катод - отрицательно заряженный электрод, на котором происходит
процесс восстановления.
Анод - положительно заряженный электрод, на котором происходит
процесс окисления.
Правило: На катоде катионы восстанавливаются, на аноде анионы окисляются
Слайд 6
Виды анодов:
1. Инертные аноды (нерастворимые, пассивные): материал анода
не окисляется, окисляются ионы электролита (платина, графит).
2. Активные аноды
(растворимые): материал анода легко окисляется (медь, цинк, железо).
Слайд 8
Давыдова Н.Б., учитель химии МБОУ "Вадская СОШ", Вад
Слайд 9
На катоде:
От Li+ до Al 3+ (включительно) восстанавливаются
молекулы воды или катионы H+:
2H2O+2e →H2↑+2OH−
2H++2e →H2↑
Электролиз растворов
Слайд 10
Катодные процессы:
От Al 3+ до Н2 восстанавливаются металл
и молекулы воды (катионы H+):
Men+ + ne →Me0
2H2O+2e →H2↑+2OH−
2H++2e →H2↑
После Н2 восстанавливаются металл :
Men+ + ne →Me0
Слайд 11
Анодные процессы:
I. Нерастворимый анод (инертный) Рt, C
Окисляются:
1. Анионы
бескислородных кислот: I-, Br-, S2-, Cl-, RCOO-: 2Cl--2e →Cl20
, 2RCOO- -2e → R – R + 2CO2↑
2. Кислород воды, если в растворе есть анионы кислородсодержащих кислот (SO42-, NO3-) или фторид-ион F-: 2H2O – 4e → O2↑ + 4H+
или гидроксид – ионы (в щелочной среде) по схеме: 4OH- - 4e → O2↑ + 2 H2O.
3. В растворах не разряжаются анионы кислородсодержащих кислот и фторид – ион: F-, SO42-, NO3-, CO32-, PO43-
II. Растворимый анод (активный) Cu, Ag, Ni, Zn
Окисление металла анода: Me 0 – ne → Me n+
Слайд 12
Пример 3: Электролиз раствора иодида калия.
Слайд 15
Применение электролиза
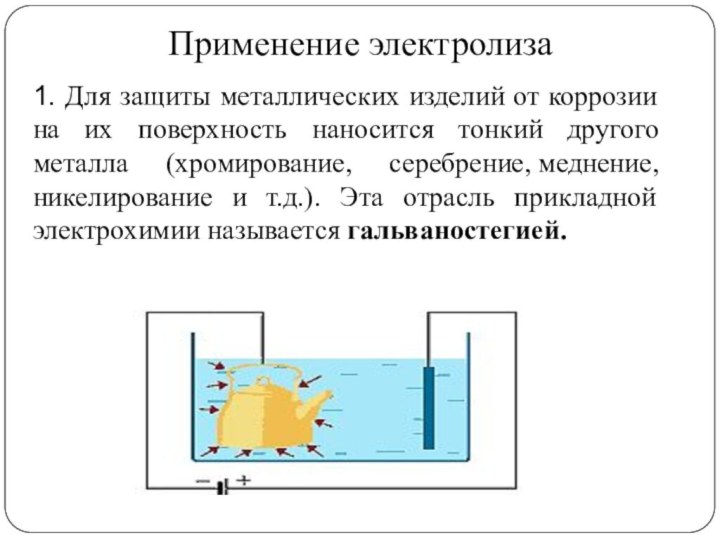
1. Для защиты металлических изделий от коррозии
на их поверхность наносится тонкий другого металла (хромирование, серебрение, меднение,
никелирование и т.д.). Эта отрасль прикладной электрохимии называется гальваностегией.
Слайд 16
2. Гальванопластика - получение точных металлических копий с
предметов. С помощью гальванопластики изготавливают клише для печатания денег,
печатные схемы в радиотехнике, грампластинки.
Слайд 17
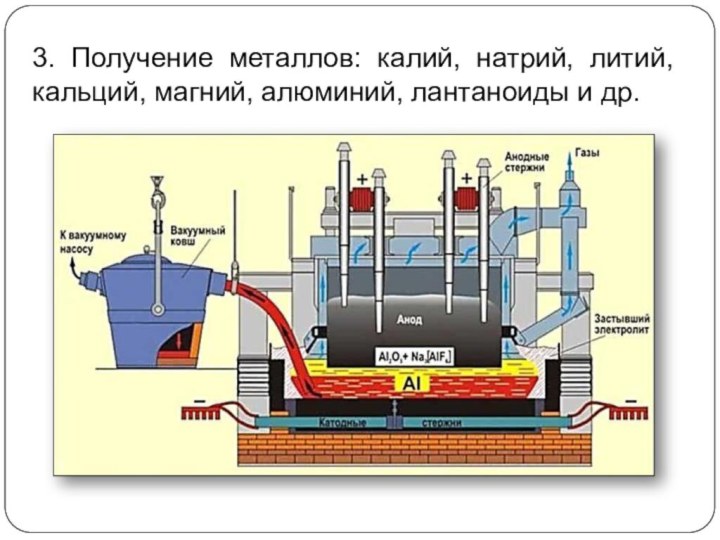
3. Получение металлов: калий, натрий, литий, кальций, магний,
алюминий, лантаноиды и др.
Слайд 18
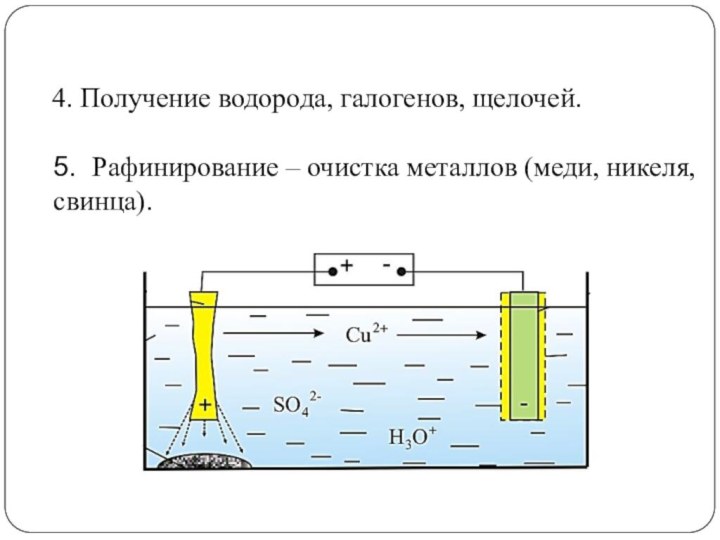
4. Получение водорода, галогенов, щелочей.
5. Рафинирование – очистка
металлов (меди, никеля, свинца).
Слайд 19
Закрепление и применение полученных знаний
Базовый уровень сложности
1. При
электролизе AgNO3 на катоде выделяется (-ются):
1) серебро
2) водород
3) серебро и водород 4) водород и кислород
2. При электролизе водного раствора нитрата калия на аноде выделяется
1) О2 2) NO2 3) N2 4) H2
3. При электролизе водного раствора какой соли на катоде и аноде будут выделятся газообразные вещества
1) AgNO3 2) КNO3 3) CuCl2 4) SnCl2
Слайд 20
Закрепление и применение полученных знаний
Повышенный уровень сложности
4. Установите
соответствие между формулой вещества и продуктами электролиза его водного
раствора на инертных электродах.
Слайд 21
Закрепление и применение полученных знаний
Повышенный уровень сложности
5. Установите
соответствие между формулой соли и продуктом, образующимся на инертном
аноде при электролизе его водного раствора
Слайд 22
Рефлексия:
1. Что нового вы узнали сегодня на
уроке?
2. Что запомнилось?
3. Что понравилось, а что не удалось,
на ваш взгляд?
4. Где ты применишь полученные знания?
5. В какой момент урока ты чувствовал себя особенно успешным?
Слайд 23
Домашнее задание:
Учебник: Кузнецова Н.Е., Литвинова Т.Н., Левкин А.Н.;
под ред. Н. Е. Кузнецовой. Химия: профильный уровень. Ч.1
- М.: Вентана - Граф, 2010
§33 упр. 2
Задача: Вычислите массу меди, которая выделилась на катоде, если в результате электролиза сульфата меди (II) на аноде образовался кислород объемом 11,2 л (н.у.).
Задание: сообщения на темы «Получение щелочных и щелочноземельных металлов Г. Дэви», «Получение фтора А. Муассаном», «Производство алюминия».
Слайд 24
1. Кузнецова Н.Е., Литвинова Т.Н., Левкин А.Н.; под
ред. Н. Е. Кузнецовой. Химия: профильный уровень. Ч.1 -
М.: Вентана - Граф, 2010
2. Задачник по химии: 11 класс: для учащихся 10 классов общеобразовательных учреждений / А.Н.Левкин, Н.Е.Кузнецова. – М.: Вентана-Граф, 2009.
3. ЕГЭ 2009. Химия: сборник экзаменационных заданий / Авт.-сост.: А.А.Каверина, Ю.Н.Медведев, Д.Ю. Добротин. – М.: Эксмо, 2009.
4. Самое полное издание типовых вариантов заданий ЕГЭ: 2012: Химия / авт.-сост. А.А.Каверина, Д.Ю.Добротин, А.С. Корощенко, М.Г. Снастина. - М.: АСТ: Астрель, 2012.
Список литературы