- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Окислительно-восстановительные реакции
Содержание
- 2. горение
- 3. сгорание топлива
- 4. Получениеметаллов
- 5. коррозияметалловисплавов
- 6. БрожениеГниение
- 7. фотосинтезэто единственно важный первичный источник энергии для
- 8. ОВР- это такие реакции, при которых происходит
- 9. Cуть ОВР-переход электронов от одних атомов, молекул или ионов к другим.
- 10. ОКИСЛЕНИЕ – ОТДАЧА ЭЛЕКТРОНОВ(повышение с.о.)ВОССТАНОВЛЕНИЕ-ВЗЯТИЕ ЭЛЕКТРОНОВ(понижение с.о.)
- 11. Восстановители (отдающие электроны): металлы, водород, уголь, СO,сероводород,
- 12. Внимание!!!Самостоятельная работа...
- 13. Лабораторные опыты:
- 14. ЛАБОРАТОРНЫЙ ОПЫТ №1Zn + HCl =КУСОЧЕК ЦИНКА ОПУСТИТЕВ ПРОБИРКУ С РАСТВОРОМ СОЛЯНОЙ КИСЛОТЫ
- 15. Zn + 2HCl =ZnCl2 + H 2
- 16. ЛАБОРАТОРНЫЙ ОПЫТ №2Железный гвоздик опустите в раствор сульфата меди (II)Fe + CuSO4 =
- 17. Fe + CuSO4 = Cu + FeSO4
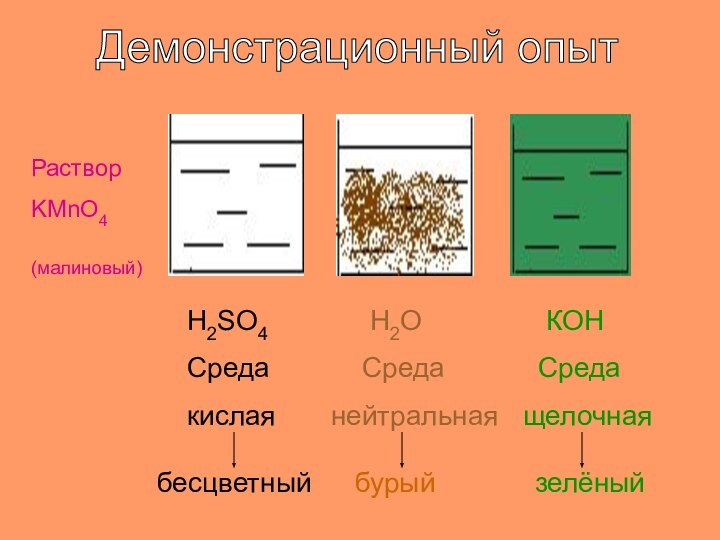
- 18. Демонстрационный опытРастворKMnO4(малиновый)H2SO4 Средакислаябесцветный Н2О Среданейтральнаябурый КOH Средащелочнаязелёный
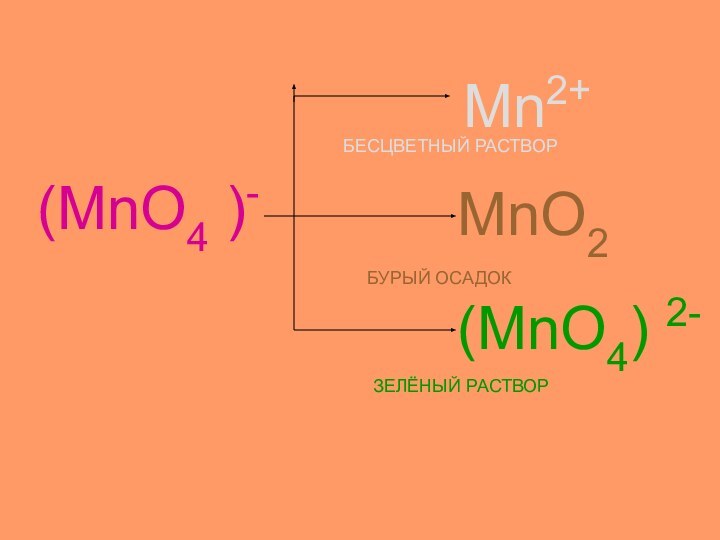
- 19. (MnO4 )-Mn2+MnO2(MnO4) 2-БЕСЦВЕТНЫЙ РАСТВОРБУРЫЙ ОСАДОКЗЕЛЁНЫЙ РАСТВОР
- 20. СОСТАВЬТЕ УРАВНЕНИЯ овр МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА:I вариантKMnO4
- 21. выводы:4)среда оказывает влияние на процесс.1)овр чрезвычайно распространены;2)суть
- 22. Скачать презентацию
- 23. Похожие презентации
горение














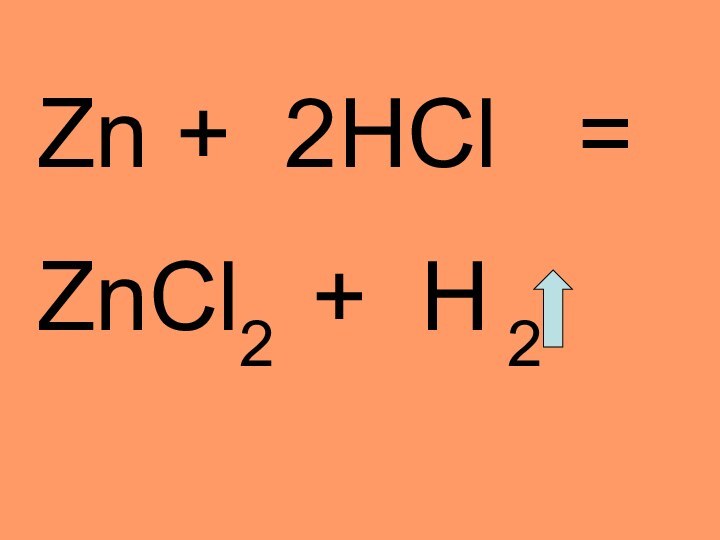





Слайд 8 ОВР- это такие реакции, при которых происходит изменение
степеней окисления атомов химических элементов или ионов, образующих реагирующие
вещества.
Слайд 10
ОКИСЛЕНИЕ – ОТДАЧА ЭЛЕКТРОНОВ
(повышение с.о.)
ВОССТАНОВЛЕНИЕ-ВЗЯТИЕ ЭЛЕКТРОНОВ
(понижение с.о.)
Слайд 11
Восстановители (отдающие электроны): металлы, водород, уголь, СO,сероводород, аммиак.
Окислители(принимающие
электроны): O2 ,галогены, азотная и серная кислоты,KMnO4 , K2Cr2O7
.
Слайд 18
Демонстрационный опыт
Раствор
KMnO4
(малиновый)
H2SO4
Среда
кислая
бесцветный
Н2О
Среда
нейтральная
бурый
КOH
Среда
щелочная
зелёный
Слайд 20
СОСТАВЬТЕ УРАВНЕНИЯ овр МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА:
I вариант
KMnO4 +
K2SO3 +H2SO4 =
II вариант
KMnO4 + K
2SO 3 +H 2O =III вариант
KMnO4 + K 2SO3 + КOH =
Слайд 21
выводы:
4)среда оказывает влияние на процесс.
1)овр чрезвычайно распространены;
2)суть овр-переход
электронов от одних
атомов,молекул или ионов к другим;
3)овр-единство двух противоположных
процессов-окисления и восстановления;





























