- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Основные сведения о строении атомов
Содержание
- 3. Атом – сложная частица
- 4. Цели:обобщить знания из курсов химии и физики
- 5. Содержание:1. Атом – сложная частица. 2. Доказательства
- 6. Определение атома в БСЭАтом (от греч. atomos
- 7. Развитие представлений о строении атомаI. Атом – химически неделимая частица (элемент).
- 8. II. Доказательства сложности строения атома:Открытие рентгеновских лучей
- 9. Вильгельм Конрад Рентген (1845 — 1923) Рентгеновские лучи
- 10. Сэр Джозеф Джон Томсон (1856 — 1940) Катодные лучи
- 11. Антуан Анри Беккерель (1852 - 1908) Радиоактивность
- 12. Пьер Кюри (1859—1906) Мария Складовская - Кюри́ (1867 — 1934)Изучение радиоактивности
- 13. III. Модели строения атомов«Пудинг с изюмом» (1902
- 14. Кельвин (Kelvin) Вильям (26.VI.1824–17.XII.1907). «Пудинг с изюмом»Сэр Джозеф Джон Томсон (1856 — 1940)
- 15. Эрне́ст Ре́зерфорд (1871 —1937) Планетарная модель
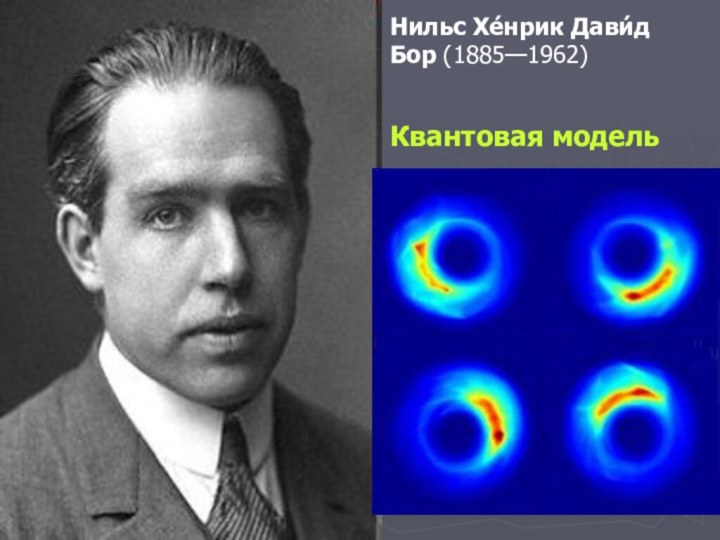
- 16. Нильс Хе́нрик Дави́д Бор (1885—1962) Квантовая модель
- 17. Постулаты БораЭлектрон двигается по строго определённым замкнутым
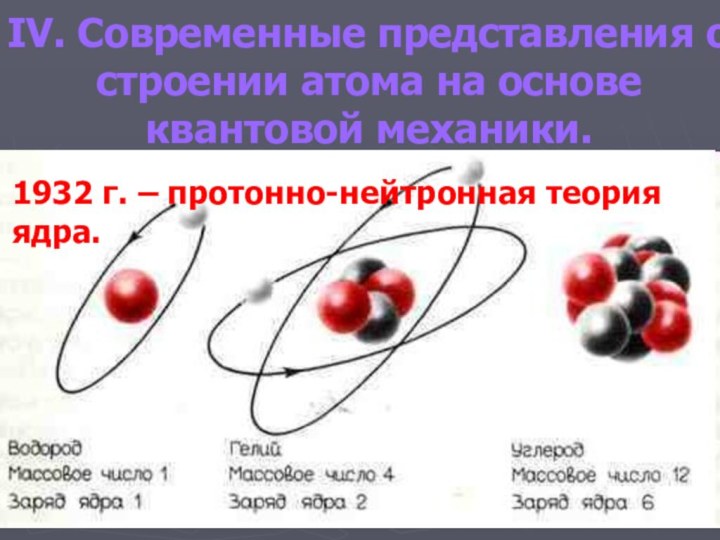
- 19. IV. Современные представления о строении атома на основе квантовой механики.1932 г. – протонно-нейтронная теория ядра.
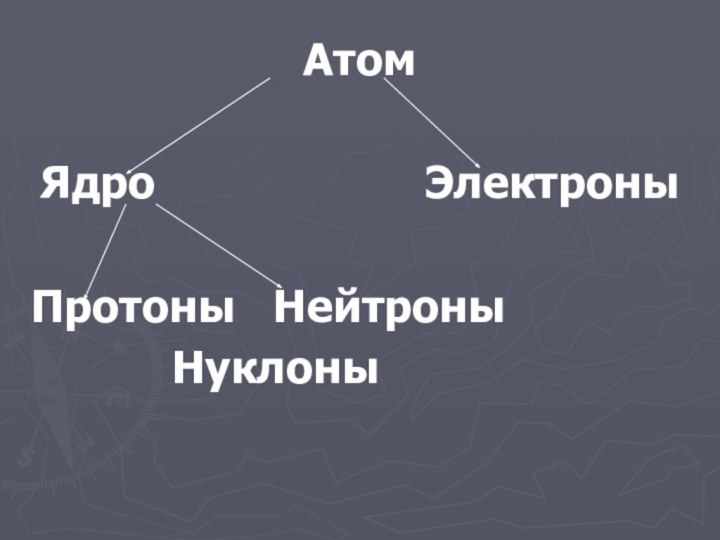
- 20. Атом Ядро
- 21. Атом – это электронейтральная система взаимодействующих элементарных
- 22. Ar = Σ p+ + Σ n0Σ p+ = constΣ n0 ≠ const
- 23. Изотопы – это разновидности атомов одного
- 24. Химический элемент – это вид атомов с
- 25. БСЭКорпускулярно-волновой дуализм – положение, лежащее в основе
- 26. Электронная оболочка – совокупность всех электронов в
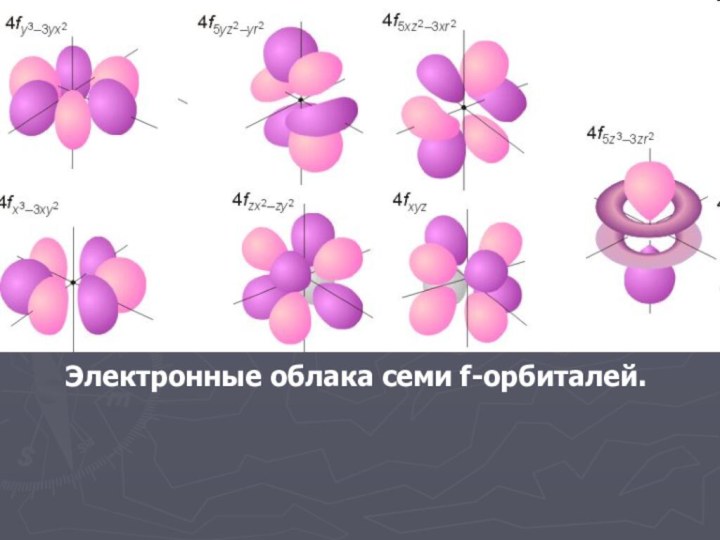
- 27. Орбиталь или электронное облако – пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона
- 29. Электронные облака семи f-орбиталей.
- 31. n = 2N2 где, n
- 32. Валерий Я́ковлевич Брюсов (1873 — 1924) — русский поэт Портрет работы Михаила Врубеля
- 33. Скачать презентацию
- 34. Похожие презентации
Атом – сложная частица



























Слайд 4
Цели:
обобщить знания из курсов химии и физики о
явлениях, доказывающих сложность строения атома;
взглядов на строение атома.
Слайд 5
Содержание:
1. Атом – сложная частица.
2. Доказательства сложности
строения атома.
3. Модели строения атомов.
4. Модели строения
атомов. 5. Ядро и нуклоны.
6. Электрон.
7. Дуализм электрона.
Слайд 6
Определение атома в БСЭ
Атом (от греч. atomos —
неделимый), частица вещества микроскопических размеров и очень малой массы
(микрочастица), наименьшая часть химического элемента, являющаяся носителем его свойств. Каждому элементу соответствует определённый род А., обозначаемых символом элемента (например, А. водорода Н: А. железа Fe; А. ртути Hg; А. урана U).
Слайд 8
II. Доказательства сложности строения атома:
Открытие рентгеновских лучей (1895
г., К. Рентген).
Открытие катодных лучей (1897 г., Дж. Томсон).
Открытие
радиоактивности (1896 г., А Беккерель) и её изучение (1897 – 1903 гг., М. Склодовская-Кюри, П. Кюри)
Слайд 13
III. Модели строения атомов
«Пудинг с изюмом» (1902 –
1904 гг., В. Кельвин, Дж. Томсон).
Планетарная (1907 г.. Э.
Резерфорд).Квантовая модель Н. Бора.
Слайд 14
Кельвин (Kelvin) Вильям (26.VI.1824–17.XII.1907).
«Пудинг с изюмом»
Сэр Джозеф
Джон Томсон
(1856 — 1940)
Слайд 17
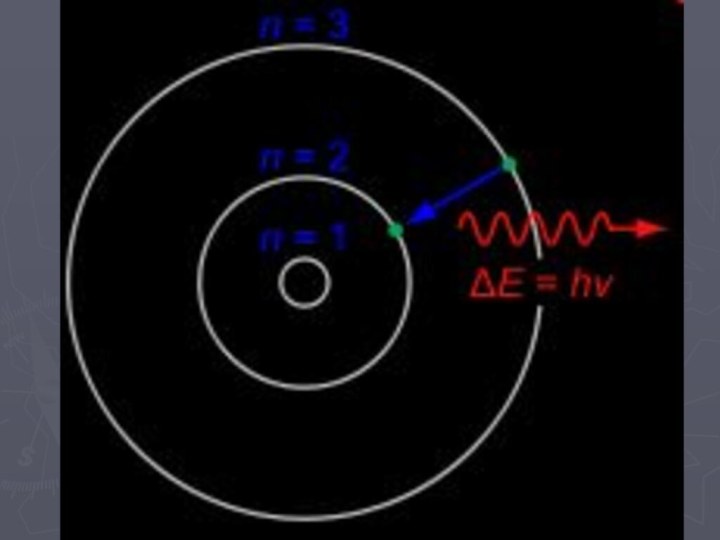
Постулаты Бора
Электрон двигается по строго определённым замкнутым стационарным
орбитам в соответствии с «разрешёнными» значениями энергии Е1, Е2,
… Еn, при этом энергия не поглощается и не выделяется.Электрон переходит из одного разрешённого энергетического состояния в другое, что сопровождается излучением или поглощением кванта энергии.
Слайд 19 IV. Современные представления о строении атома на основе
квантовой механики.
1932 г. – протонно-нейтронная теория ядра.
Слайд 21
Атом – это электронейтральная система взаимодействующих элементарных частиц,
состоящих их ядра (образованного протонами и нейтронами) и электронов.
Слайд 23
Изотопы – это разновидности атомов одного и
того же химического элемента, имеющие одинаковый заряд атомного ядра
(одинаковое число протонов в нём), но разную относительную атомную массу (разное число нейтронов).
Слайд 24
Химический элемент – это вид атомов с одинаковым
положительным зарядом ядра.
16О, 17О, 18О – изотопы кислорода
35Сl, 37Сl – изотопы хлора39K, 40K – изотопы калия
39Ar, 40Ar – изотопы аргона
Слайд 25
БСЭ
Корпускулярно-волновой дуализм – положение, лежащее в основе квантовой
механики о том, что в поведении микрообъектов проявляются как
корпускулярные, так и волновые черты.
Слайд 26
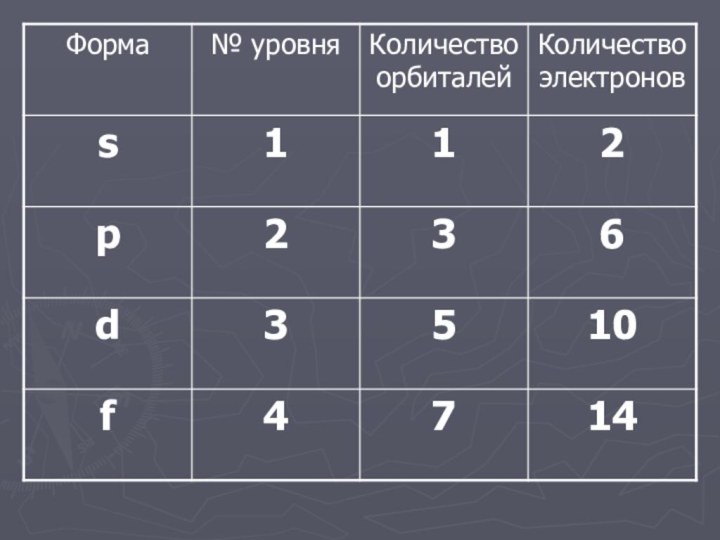
Электронная оболочка – совокупность всех электронов в атоме.
Электронный
слой или энергетический уровень – электроны, обладающие близкими значениями
энергии.Число энергетических уровней в атоме равно номеру периода, в котором располагается элемент