- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Углерод. Аллотропные модификации
Содержание
- 2. Положение в таблице МенделееваУглерод Carbogenium - 6ой
- 3. Нахождение в природеВ настоящее время известно более
- 4. Нахождение в природеУглерод занимает 17-е место по
- 5. Нахождение в природеУглерод входит в состав органических
- 6. Свободный углеродВ свободном виде углерод встречается в
- 7. Алмаз
- 8. Графит
- 9. Модель фуллерена С60Модель фуллерена С60
- 10. Все это - чистый углерод
- 11. АлмазАлмаз – бесцветное, прозрачное, сильно преломляющее свет
- 12. АлмазПлотность алмаза – 3,5 г/см3, tплав=3730С, tкип=4830оС.
- 13. АлмазНепрерывная трехмерная сетка ковалентных связей, которая характеризуется
- 14. ГрафитГрафит – устойчивая при нормальных условиях аллотропная
- 15. ГрафитАтомы углерода в графите расположены отдельными слоями,
- 16. ГрафитГрафит характеризуется меньшей плотностью и твердостью, а
- 17. КарбинКарбин был получен в начале 60-х годов
- 18. КарбинОн имеет вид черного мелкокристаллического порошка, однако
- 19. КарбинЗа счет существования различных типов связи и
- 20. Другие формы углеродаИзвестны и другие формы углерода,
- 21. ФуллереныФуллерены – класс химических соединений, молекулы которых
- 22. ФуллереныПроисхождение термина "фуллерен" связано с именем американского
- 23. ФуллереныВ противоположность первым двум, графиту и алмазу,
- 24. НанотрубкиНаряду со сфероидальными углеродными структурами, могут образовываться
- 25. НанотрубкиНа рисунке представлена идеализированная модель однослойной нанотрубки.
- 26. НаночастицыВ процессе образования фуллеренов из графита образуются
- 27. ГрафенГрафе́н— двумерная аллотропная модификация углерода, образованная слоем
- 28. ГрафенОсновной из существующих в настоящее время способов
- 29. Скачать презентацию
- 30. Похожие презентации
Положение в таблице МенделееваУглерод Carbogenium - 6ой элемент в таблице Менделеева. Он располагается в главной подгруппе четвертой группы, втором периоде. Углерод-типичный неметалл.



























Слайд 3
Нахождение в природе
В настоящее время известно более миллиона
соединений углерода с другими элементами. Их изучение составляет целую
науку – органическую химию. В тоже время за изучение свойств чистого углерода ученые взялись сравнительно недавно - около 20 лет назад.
Слайд 4
Нахождение в природе
Углерод занимает 17-е место по распространенности
в земной коре – 0,048%. Но несмотря на это,
он играет огромную роль в живой и неживой природе.
Слайд 5
Нахождение в природе
Углерод входит в состав органических веществ
в растительных и живых организмах, в состав ДНК. Содержится
в мышечной ткани – 67%, костной ткани – 36% и крови человека (в человеческом организме массой 70 кг в среднем содержится 16 кг связанного углерода).
Слайд 6
Свободный углерод
В свободном виде углерод встречается в нескольких
аллотропных модификациях – алмаз, графит, карбин, крайне редко фуллерены.
В лабораториях также были синтезированы многие другие модификации: новые фуллерены, нанотрубки, наночастицы и др.
Слайд 11
Алмаз
Алмаз – бесцветное, прозрачное, сильно преломляющее свет вещество.
Алмаз тверже всех найденных в природе веществ, но при
этом довольно хрупок. Он настолько тверд, что оставляет царапины на большинстве материалов.Структура алмаза
Слайд 12
Алмаз
Плотность алмаза – 3,5 г/см3, tплав=3730С, tкип=4830оС. Алмаз
можно получить из графита при p > 50 тыс.
атм. и tо = 1200оC В алмазе каждый 4-х валентный атом углерода связан с другим атомом углерода ковалентной связью и количество таких связанных в каркас атомов чрезвычайно велико.
Слайд 13
Алмаз
Непрерывная трехмерная сетка ковалентных связей, которая характеризуется большой
прочностью, определяет многие свойства алмаза, так то плохая тепло-
и электропроводимость, а также химическая инертность. Алмазы очень редки и ценны, их вес измеряется в каратах (1 карат=200мг). Ограненный алмаз называют бриллиантом.Знаменитый бриллиант «Кохинор»
Слайд 14
Графит
Графит – устойчивая при нормальных условиях аллотропная модификация
углерода, имеет серо-черный цвет и металлический блеск, кажется жирным
на ощупь, очень мягок и оставляет черные следы на бумаге.Структура графита
Слайд 15
Графит
Атомы углерода в графите расположены отдельными слоями, образованными
из плоских шестиугольников. Каждый атом углерода на плоскости окружен
тремя соседними, расположенными вокруг него в виде правильного треугольника.
Слайд 16
Графит
Графит характеризуется меньшей плотностью и твердостью, а также
графит может расщепляться на тонкие чешуйки. Чешуйки легко прилипают
к бумаге – вот почему из графита делают грифели карандашей. В пределах шестиугольников возникает склонность к металлизации, что объясняет хорошую тепло- и электропроводность графита, а также его металлический блеск.Графитовый электрод
Слайд 17
Карбин
Карбин был получен в начале 60-х годов В.В.
Коршаком, А.М. Сладковым, В.И. Касаточкиным, Ю.П. Кудрявцевым. Карбин имеет
кристаллическую структуру, в которой атомы углерода соединены чередующимися одинарными и тройными связями.Строение карбина
Слайд 18
Карбин
Он имеет вид черного мелкокристаллического порошка, однако может
существовать в виде белого вещества с промежуточной плотностью. Карбин
обладает полупроводниковыми свойствами, под действием света его проводимость резко увеличивается.
Слайд 19
Карбин
За счет существования различных типов связи и разных
способов укладки цепей из углеродных атомов в кристаллической решетке,
физические свойства карбина могут меняться в широких пределах. Позднее карбин был найден в природе в виде вкраплений в природном графите, содержащемся в минерале чаоит, а также в метеоритном веществе.Метеорит содержащий вкрапления карбина
Слайд 20
Другие формы углерода
Известны и другие формы углерода, такие
как уголь, кокс и сажа. Но все эти формы
являются композитами, то есть смесью малых фрагментов графита и алмаза.Сажа
Слайд 21
Фуллерены
Фуллерены – класс химических соединений, молекулы которых состоят
только из углерода, число атомов которого четно, от 32
и более 500, они представляют по структуре выпуклые многогранники, построенные из правильных пяти- и шестиугольников.Фуллерен С70
Слайд 22
Фуллерены
Происхождение термина "фуллерен" связано с именем американского архитектора
Ричарда Букминстера Фуллера, конструировавшего полусферические архитектурные конструкции, состоящие из
шестиугольников и пятиугольников.Купол Фуллера
Слайд 23
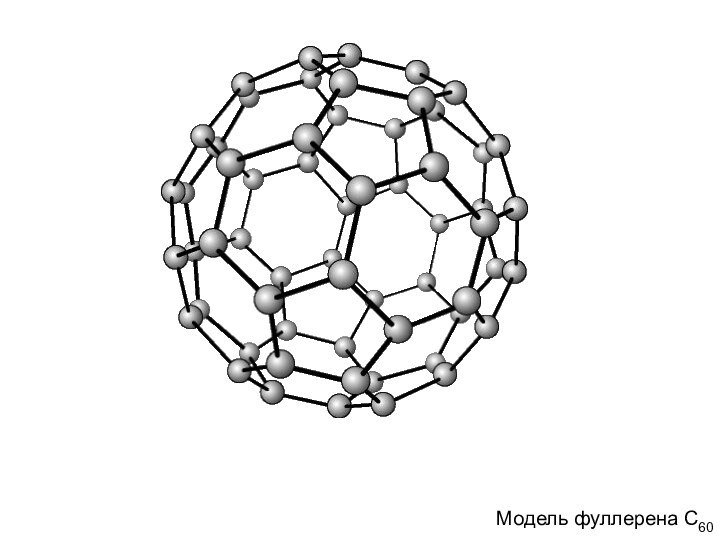
Фуллерены
В противоположность первым двум, графиту и алмазу, структура
которых представляет собой периодическую решетку атомов, третья форма чистого
углерода является молекулярной. Это означает, что минимальным элементом ее структуры является не атом, а молекула углерода, представляющая собой замкнутую поверхность, которая имеет форму сферы.Модель фуллерена С60
Слайд 24
Нанотрубки
Наряду со сфероидальными углеродными структурами, могут образовываться также
и протяженные цилиндрические структуры, так называемые нанотрубки, которые отличаются
широким разнообразием физико-химических свойств.Идеальная нанотрубка представляет собой свернутую в цилиндр графитовую плоскость, выложенную правильными шестиугольниками, в вершинах которых расположены атомы углерода.
Строение нанотрубки