- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Влияние роданина калия на кинетику разряда ионов водорода на стали Ст3
Содержание
- 2. ВведениеНаводороживание металлов – распространенное явление, приводящее к
- 3. Степень наводороживания металла связана с активностью Надс,
- 4. механизмы реакции катодного выделения водорода на железе
- 5. Кинетические уравнения в случае замедленного разряда, с
- 6. Рис. 1 Зависимость тока диффузии водорода от
- 7. Рис. 2. Полулогарифмическая зависимость тока диффузии водорода
- 8. Рис. 3. Зависимость тока диффузии водорода iн
- 9. Рис. 4. Зависимость степени заполнения поверхности стальной
- 10. Кинетические параметры РВВ и диффузии водорода в
- 11. Рис. 5. Зависимость коэффициента ρ от величины
- 12. Рис. 6. Диаграмма Найквиста для стали Ст3
- 13. Некоторые параметры электрохимического импеданса стали Ст.
- 14. Выводы:1.Введение добавок роданида калия увеличивает iн и
- 15. Скачать презентацию
- 16. Похожие презентации
ВведениеНаводороживание металлов – распространенное явление, приводящее к существенному изменению их физико-химических характеристик, что, в свою очередь, влечет за собой изменение объема кристаллической решетки, появление механических напряжений, водородной хрупкости, трещин. В основе существующей концепции наводороживания лежит комплекс











Слайд 3 Степень наводороживания металла связана с активностью Надс, а
следовательно, и с механизмом восстановления водорода, и с величиной
перенапряжения. Следовательно, зная механизм, можно прогнозировать наводороживание; с другой стороны, можно использовать наводороживание для изучения механизма восстановления водорода.Если предположить, что в металл диффундируют атомы водорода, адсорбированные на поверхности , то скорость диффузии непосредственно связана со степенью заполнения поверхности Н.
iH – поток твердофазной диффузии водорода, DН – коэффициент диффузии, L – толщина мембраны, F – постоянная Фарадея.
Движущей силой диффузии является градиент концентрации dH/dL.
где k - кинетико-диффузионная константа, объединяю
щая кинетику абсорбции и десорбции водорода на поляризационной стороне мембраны и транспорт внутри мембраны.
,
Слайд 4 механизмы реакции катодного выделения водорода на железе в кислых
средах
РВВ протекает в несколько последовательных стадий. На первой стадии
по реакции Фольмера образуются хемосорбированные атомы водорода:Н+ solvent + e Надс + solvent,
где solvent – молекула растворителя.
Для кислых водных растворов данная реакция принимает вид:
+ e Надс + Н2О
Удаление атомарного водорода может происходить либо посредством электрохимической десорбции Гейровского:
+ Надс + e Н2 + Н2О,
либо по стадии рекомбинации Тафеля:
Надс + Надс Н2.
либо путем диффузии вглубь металла:
Надс ⇄ Набс
Слайд 5 Кинетические уравнения в случае замедленного разряда, с учетом
строения двойного электрического слоя
где Е – потенциал электрода, Н
– перенапряжение водорода, – истинный коэффициент переноса (обычно равный 0,5), – падение потенциала в диффузной части ДЭС, iK – плотность катодного тока.
Слайд 6 Рис. 1 Зависимость тока диффузии водорода от величины
катодной поляризации стальной мембраны в растворах 0,1N HCl +
0,9N KCl (а) и 0,9N HCl + 0,1N KCl (б) без и с добавками роданида калия, мМ: ● – отсутствует; ○ – 1; ▲ – 5; □ – 20; × – 50.Слайд 7 Рис. 2. Полулогарифмическая зависимость тока диффузии водорода (1-5)
в сталь от потенциала и стационарные катодные поляризационные кривые
(6-10) в растворах 0,1N HCl + 0,9N KCl (а) и 0,9N HCl + 0,1N KCl (б) без и с добавками роданида калия, мМ: ● – отсутствует; ○ – 1; ▲ – 5; □ – 20; × – 50Слайд 8 Рис. 3. Зависимость тока диффузии водорода iн через
стальную мембрану от скорости рекомбинации ir0,5 в растворах 0,1N
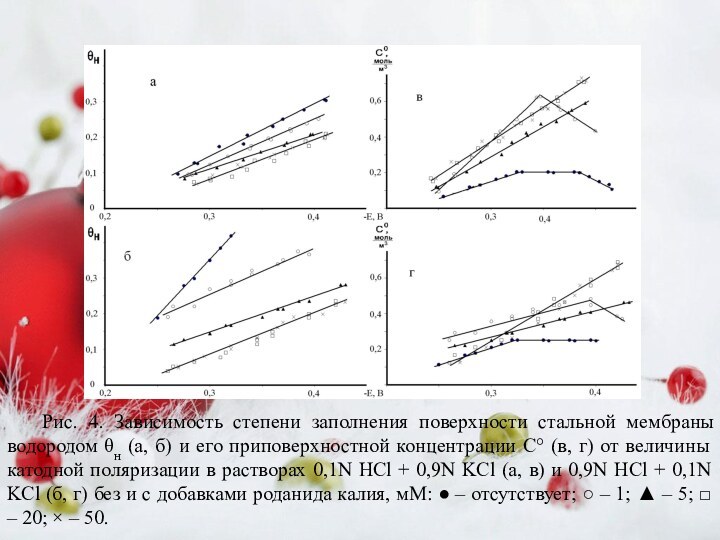
HCl + 0,9N KCl (а) и 0,9N HCl + 0,1N KCl (б) без и с добавками роданида калия, мМ: ● – отсутствует; ○ – 1; ▲ – 5; □ – 20; × – 50.Слайд 9 Рис. 4. Зависимость степени заполнения поверхности стальной мембраны
водородом θн (а, б) и его приповерхностной концентрации С°
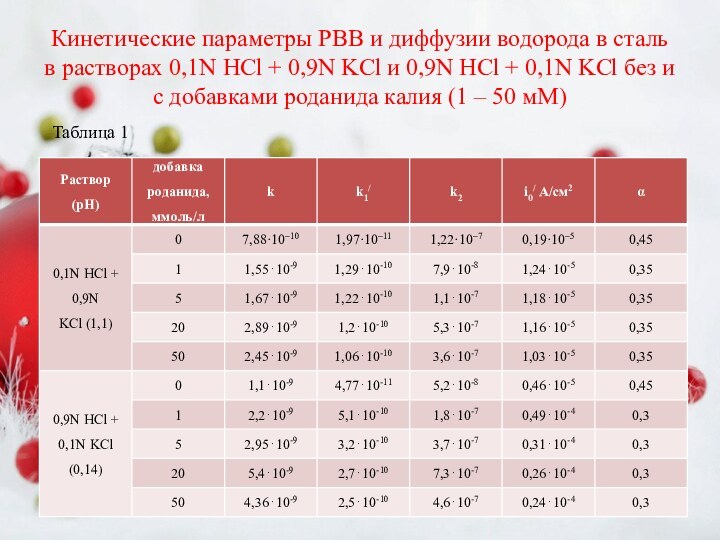
(в, г) от величины катодной поляризации в растворах 0,1N HCl + 0,9N KCl (а, в) и 0,9N HCl + 0,1N KCl (б, г) без и с добавками роданида калия, мМ: ● – отсутствует; ○ – 1; ▲ – 5; □ – 20; × – 50.Слайд 10 Кинетические параметры РВВ и диффузии водорода в сталь
в растворах 0,1N HCl + 0,9N KCl и 0,9N
HCl + 0,1N KCl без и с добавками роданида калия (1 – 50 мМ)Таблица 1
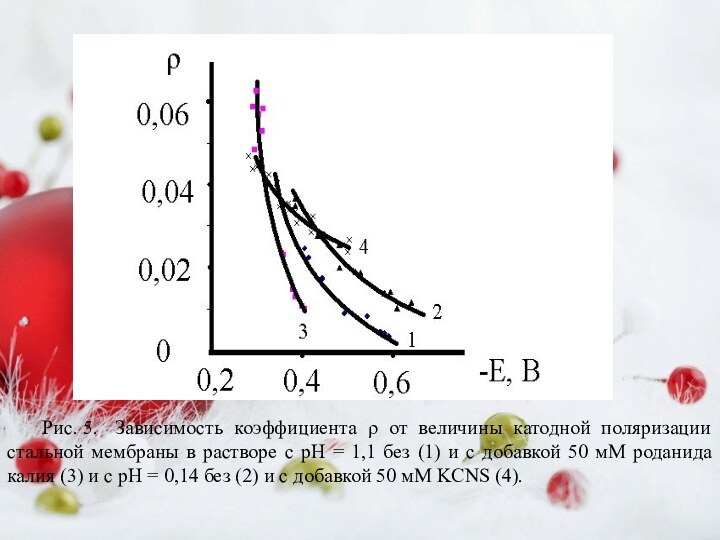
Слайд 11 Рис. 5. Зависимость коэффициента ρ от величины катодной
поляризации стальной мембраны в растворе с рН = 1,1
без (1) и с добавкой 50 мМ роданида калия (3) и с рН = 0,14 без (2) и с добавкой 50 мМ KCNS (4).Слайд 12 Рис. 6. Диаграмма Найквиста для стали Ст3 при
потенциале коррозии в растворе 0,9N HCl + 0,1N KCl
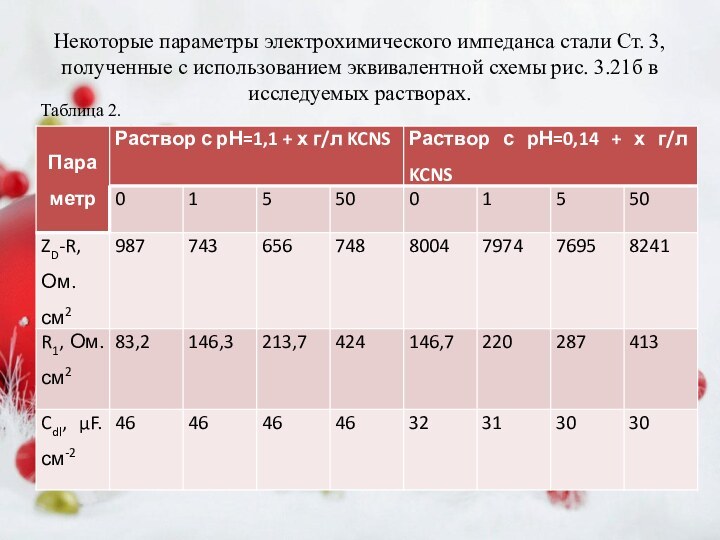
без (1) и с добавками KCNS, мМ: 2 – 1; 3 – 5; 4 – 20; 5 – 50 (а) и эквивалентная схема импеданса стального электрода (б). Числа над верхней кривой соответствуют частотам в Гц.Слайд 13 Некоторые параметры электрохимического импеданса стали Ст. 3, полученные
с использованием эквивалентной схемы рис. 3.21б в исследуемых растворах.
Таблица
2.
Слайд 14
Выводы:
1.Введение добавок роданида калия увеличивает iн и изменяет
вид зависимости iH = ƒ(-Е): iн систематически увеличивается с
ростом катодной поляризации в обоих растворах при СKCNS > 1мМ. Причем при рН=1,1 iн растет с ростом СKCNS от 5 до 20 и снижается при последующем увеличении до 50 мМ. При рН=0,14 подобная зависимость iн от СKCNS характеризуется совпадением данных при 20 и 50 мМ KCNS. Однако в растворах с добавками 1 мМ KCNS функция iH = ƒ(-Е) имеет максимум, смещенный при рН=0,14 к более отрицательным потенциалам, чем в растворе с рН=1,1.2.Присутствие KCNS вызывает рост ρ (коэффициент , характеризующий долю тока диффузии водорода через мембрану от величины катодного тока, определяющего общий сток водорода, уменьшается с увеличением кислотности среды и катодной поляризации мембраны) в хлоридных средах тем большие, чем выше катодная поляризация.