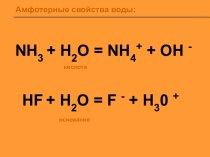Слайд 2
Муниципальное бюджетное образовательное учреждение
«Средняя общеобразовательная школа №
7»
Составитель: Маклакова Т.С.
Вид: Электронный задачник
Номинация: Задания для практической работы
на уроке
Предмет: Химия
Возраст: 9 класс
Задачник по химии
Для подготовки к ГИА
По теме:
«Расчетные задачи».
Слайд 3
Содержание
Введение
Справочный материал
Основные физические величины в химии
Основные уравнения связи
Задания
с выбором ответа (А15 )
Задания с развернутым ответом (С2)
1
тип: Если дано чистое вещество, надо найти концентрацию полученного раствора (при известной массе раствора) или массу раствора (при известной концентрации).
2 тип: Если известна масса раствора определенной концентрации, необходимо найти массу выпавшего осадка или выделившегося газа.
3 тип: Если известна масса смеси, в которой содержится определенный процент примесей, надо найти массу вещества, или массу выпавшего осадка, или объем выделившего газа.
Литература и интернет-ресурсы
Слайд 4
Введение
При изучении химии вам необходимо научиться решать
задачи. Решать задачи – это активный познавательный процесс, требующий
умения мыслить логически, составлять план решения, кратко его записывать, производить расчеты и теоретически их обосновывать.
Цель данного пособия – помочь вам выработать навыки решения разных химических задач. Этой цели и служит «помощник»: он подскажет нужные формулы и объяснит, как решать задачи. А подготовиться к успешной сдаче итоговой аттестации за курс основной школы вам помогут тестовые задания.
Сборник включается все типы расчетных задач, которые встречаются в материалах ГИА. В каждом разделе сборник вы найдете задачи разных типов. Также в пособии содержатся справочные материалы, необходимые для решения задач.
Надеемся, что сборник пригодится не только вам, но и вашим учителям, и даже вашим родителям.
Желаем удачи!
Слайд 5
2. Буквенное обозначение
3. Единицы измерения
1. Определение
Относительная молекулярная масса
Масса
Количество
вещества
Молярная масса
Величина
Характеристика
Основные физические величины в химии
Относительная атомная масса
Слайд 6
2. Буквенное обозначение
3. Единицы измерения
1. Определение
Относительная молекулярная масса
Масса
Количество
вещества
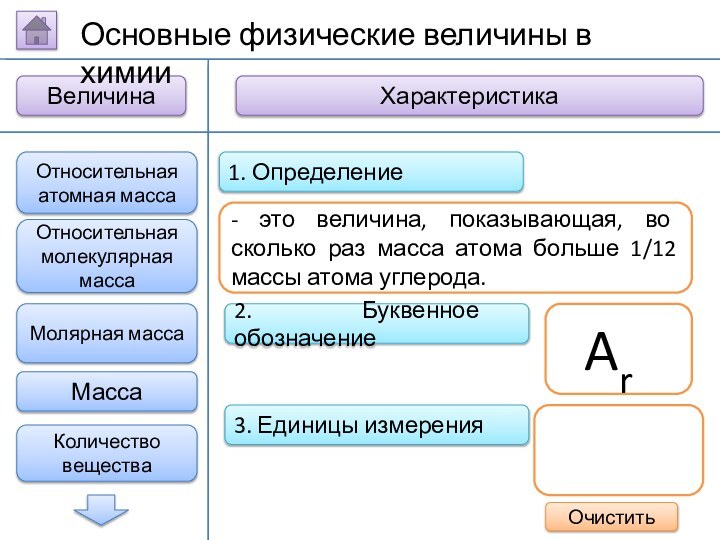
- это величина, показывающая, во сколько раз масса атома
больше 1/12 массы атома углерода.
Ar
Молярная масса
Величина
Характеристика
Основные физические величины в химии
Относительная атомная масса
Очистить
Слайд 7
2. Буквенное обозначение
3. Единицы измерения
1. Определение
Относительная молекулярная масса
Масса
Количество
вещества
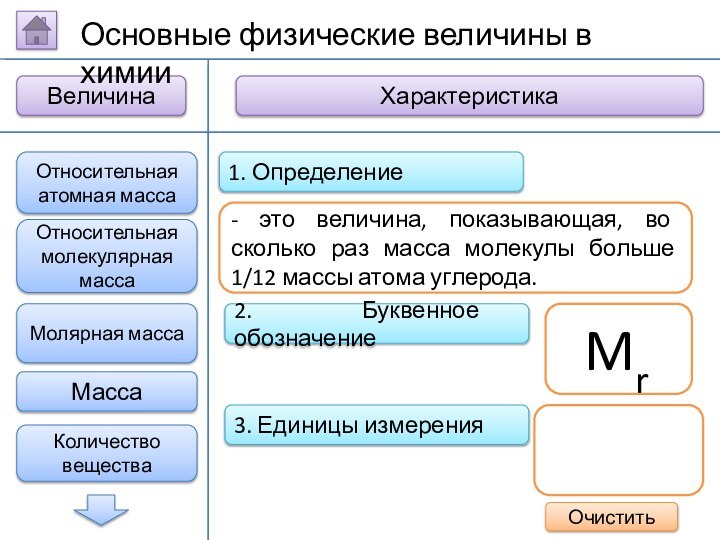
- это величина, показывающая, во сколько раз масса молекулы
больше 1/12 массы атома углерода.
Mr
Молярная масса
Величина
Характеристика
Основные физические величины в химии
Относительная атомная масса
Очистить
Слайд 8
2. Буквенное обозначение
3. Единицы измерения
1. Определение
Относительная молекулярная масса
Масса
Количество
вещества
- это масса одного моля вещества.
M
г/моль
Молярная масса
Величина
Характеристика
Основные физические
величины в химии
Относительная атомная масса
Очистить
Слайд 9
2. Буквенное обозначение
3. Единицы измерения
1. Определение
Относительная молекулярная масса
Масса
Количество
вещества
это величина, характеризующая воздействие тела на свою опору.
m
г; кг
Молярная масса
Величина
Характеристика
Основные физические величины в химии
Относительная атомная масса
Очистить
Слайд 10
2. Буквенное обозначение
3. Единицы измерения
1. Определение
Относительная молекулярная масса
Масса
Количество
вещества
- это число частиц (атомов, молекул или других частиц),
выраженное в молях.
n
моль
Молярная масса
Величина
Характеристика
Основные физические величины в химии
Относительная атомная масса
Очистить
Слайд 11
2. Буквенное обозначение
3. Единицы измерения
1. Определение
Объем
Массовая доля элемента
в сложном вещ-ве
Массовая доля растворенного вещества
Величина
Характеристика
Основные физические величины в
химии
Молярный объем
Моль
Слайд 12
2. Буквенное обозначение
3. Единицы измерения
1. Определение
- это количество
вещества, содержащее столько же частиц, сколько содержится атомов углерода
в 12 г. углерода.
Величина
Характеристика
Основные физические величины в химии
Очистить
Объем
Массовая доля элемента в сложном вещ-ве
Массовая доля растворенного вещества
Молярный объем
Моль
Слайд 13
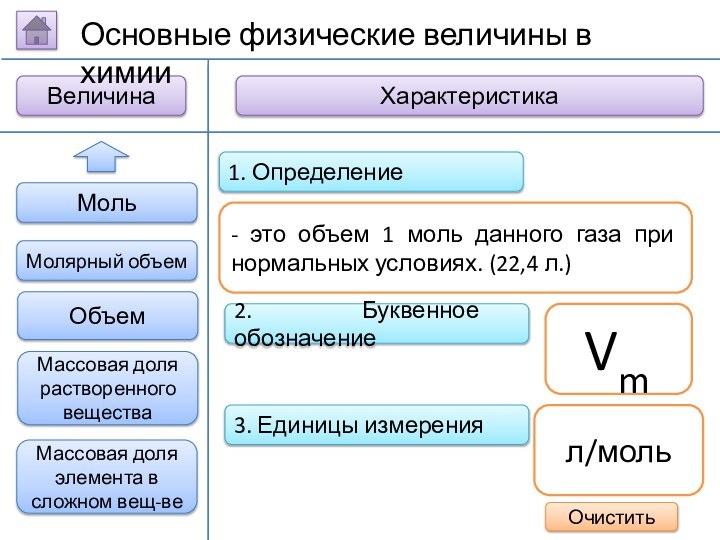
2. Буквенное обозначение
3. Единицы измерения
1. Определение
- это объем
1 моль данного газа при нормальных условиях. (22,4 л.)
Vm
л/моль
Величина
Характеристика
Основные физические величины в химии
Очистить
Объем
Массовая доля элемента в сложном вещ-ве
Массовая доля растворенного вещества
Молярный объем
Моль
Слайд 14
2. Буквенное обозначение
3. Единицы измерения
1. Определение
- это величина,
характеризующая пространство, занимаемое телом или веществом.
V
мл; л
Величина
Характеристика
Основные физические
величины в химии
Очистить
Объем
Массовая доля элемента в сложном вещ-ве
Массовая доля растворенного вещества
Молярный объем
Моль
Слайд 15
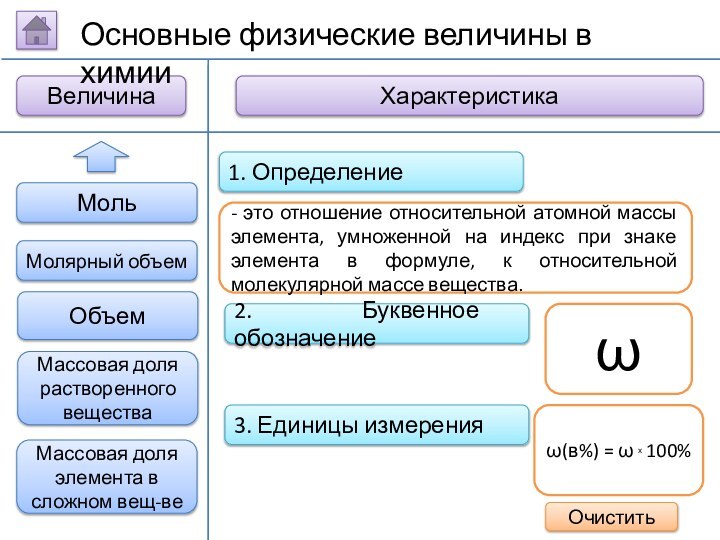
2. Буквенное обозначение
3. Единицы измерения
1. Определение
- это отношение
массы растворенного вещества к общей массе раствора.
ω
ω(в%) = ω
х 100%
Величина
Характеристика
Основные физические величины в химии
Очистить
Объем
Массовая доля элемента в сложном вещ-ве
Массовая доля растворенного вещества
Молярный объем
Моль
Слайд 16
2. Буквенное обозначение
3. Единицы измерения
1. Определение
- это отношение
относительной атомной массы элемента, умноженной на индекс при знаке
элемента в формуле, к относительной молекулярной массе вещества.
ω
ω(в%) = ω х 100%
Величина
Характеристика
Основные физические величины в химии
Очистить
Объем
Массовая доля элемента в сложном вещ-ве
Массовая доля растворенного вещества
Молярный объем
Моль
Слайд 17
Величины расчета
Уравнение связи
Молярная масса
Молярный объем
Основные уравнения связи
Количество в-ва
Массовая
доля
Массовая доля эл-та
Слайд 18
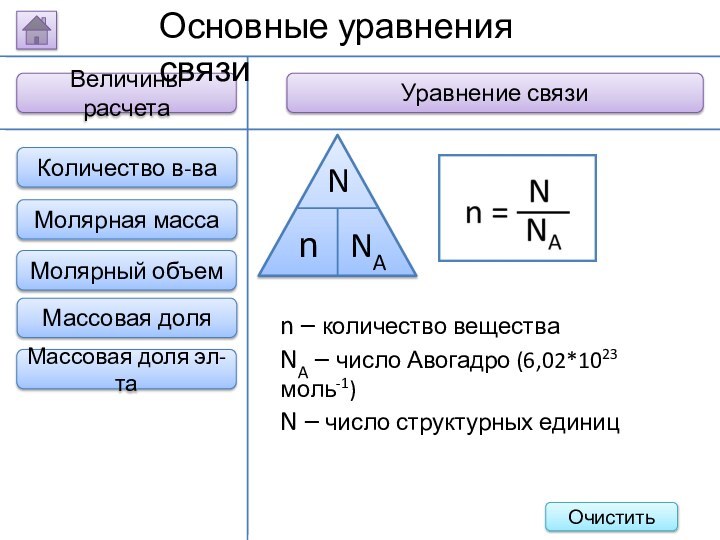
Величины расчета
Уравнение связи
Основные уравнения связи
n – количество вещества
NA
– число Авогадро (6,02*1023 моль-1)
N – число структурных единиц
Молярная
масса
Молярный объем
Количество в-ва
Массовая доля
Массовая доля эл-та
Очистить
Слайд 19
Величины расчета
Уравнение связи
Основные уравнения связи
M – молярная масса
(г/моль)
n – количество вещества (моль)
m – масса (г)
Молярная
масса
Молярный объем
Количество в-ва
Массовая доля
Массовая доля эл-та
Очистить
Слайд 20
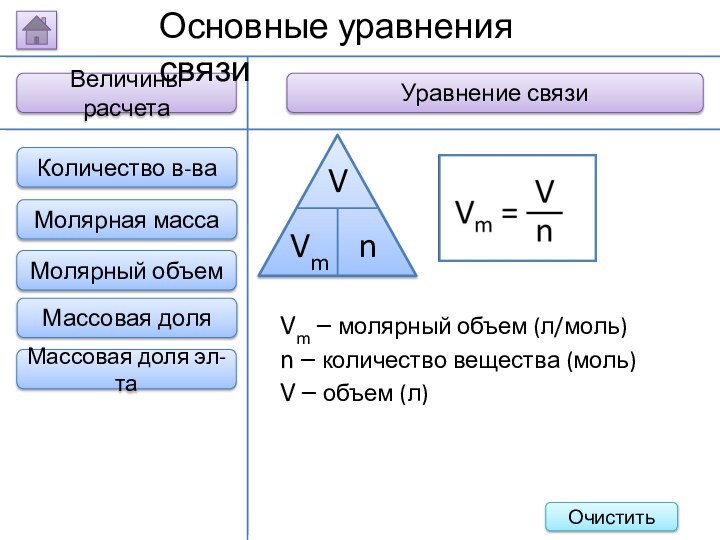
Величины расчета
Уравнение связи
Основные уравнения связи
Vm – молярный объем
(л/моль)
n – количество вещества (моль)
V – объем (л)
Молярная
масса
Молярный объем
Количество в-ва
Массовая доля
Массовая доля эл-та
Очистить
Слайд 21
Величины расчета
Уравнение связи
Основные уравнения связи
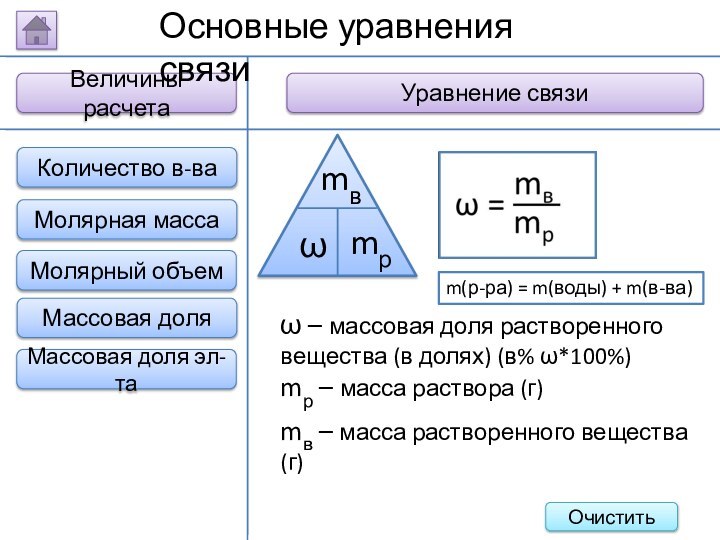
m(р-ра) = m(воды) +
m(в-ва)
ω – массовая доля растворенного вещества (в долях)
(в% ω*100%)
mр – масса раствора (г)
mв – масса растворенного вещества (г)
Молярная масса
Молярный объем
Количество в-ва
Массовая доля
Массовая доля эл-та
Очистить
Слайд 22
Величины расчета
Уравнение связи
Основные уравнения связи
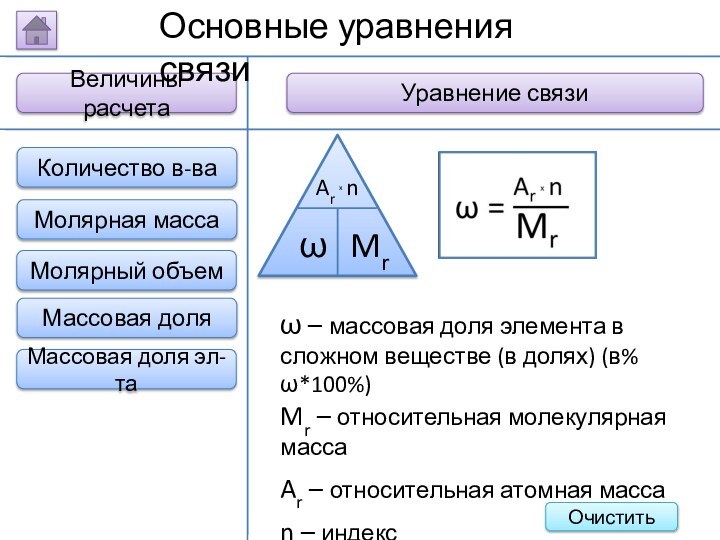
ω – массовая доля
элемента в сложном веществе (в долях) (в% ω*100%)
Mr –
относительная молекулярная масса
Ar – относительная атомная масса
n – индекс
Молярная масса
Молярный объем
Количество в-ва
Массовая доля
Массовая доля эл-та
Очистить
Слайд 23
Задания с выбором ответа (A15)
Дано:
Найти:
Решение:
Ответ:
Определите массовую долю
углерода в карбонате кальция (CaCO3).
w(C) - ?
CaCO3
)
Найдем относительную молекулярную массу CaCO3:
Mr(CaCO3) = 40+12+3*16 = 100
) Найдем массовую долю углерода:
w(C) = 12/100 = 0,12, или 12%
0,12, или 12%
0,12, или 12%
Список задач
Слайд 24
Задания с выбором ответа(A15).
Задача №1
Задача №2
Задача
№3
Задача №4
Задача №5
Задача №6
Задача №7
Задача №8
Задача №9
Задача №10
Слайд 25
Задача №1
Определите массовые доли элементов в оксиде
меди (II).
w(Cu) = 80%, w(O) = 20%
w(Cu) =
70%, w(O) = 30%
w(Cu) = 55%, w(O) = 45%
w(Cu) = 63%, w(O) = 37%.
Список задач
Слайд 26
Задача №2
Массовая доля кислорода в сульфите магния
равна:
w(O) = 13,3%
w(O) = 15,4%
w(O) = 40,0%
w(O) = 46,2%.
Список
задач
Слайд 27
Задача №3
Массовая доля калия в сульфате калия
равна:
w(K) = 22,4%
w(K) = 28,9%
w(K) = 44,8%
w(K) = 49,4%.
Список
задач
Слайд 28
Задача №4
Массовая доля углерода в карбонате аммония
равна:
w(С) = 12,5%
w(C) = 32,6%
w(C) = 41,8%
w(C) = 46,4%.
Список
задач
Слайд 29
Задача №5
Массовая доля азота в нитрате кальция
равна:
w(N) = 9,3%
w(N) = 17,1%
w(N) = 34,2%
w(N) = 39,4%.
Список
задач
Слайд 30
Задача №6
Массовая доля водорода в гидроксиде алюминия
равна:
w(H) = 3,8%
w(H) = 9,8%
w(H) = 28,0%
w(H) = 4,5%.
Список
задач
Слайд 31
Задача №7
Массовая доля кислорода в аммиачной селитре
равна:
w(H) = 30%
w(H) = 60%
w(H) = 43,75%
w(H) = 50%.
Список
задач
Слайд 32
Задача №8
Массовая доля воды в кристаллической соде
(декагидрат карбоната натрия) равна:
w(H2O) = 6,4%
w(H2O) = 62,9%
w(H2O) =
21,4%
w(H2O) = 68,4%.
Список задач
Слайд 33
Задача №9
Массовая доля азота в аммофосе (эквимолекулярная
смесь гидрофосфата и дигидрофосфата аммония) равна:
w(H) = 17,0%
w(H) =
21,13%
w(H) = 28,19%
w(H) = 12,17%.
Список задач
Слайд 34
Задача №10
Определите форму гипса, если известно, что
в его состав входит 20,93% воды:
CaSO4 * 5H2O
CaSO4 *
H2O
CaSO4 * 2H2O
2CaSO4 * H2O
Список задач
Слайд 35
Задания с развернутым ответом (С2). Тип 1.
Дано:
Найти:
Решение:
Ответ:
SO3 +
2KOH = K2SO4 + H2O
M(SO3) = 32+48 = 80
г/моль
n(SO3) = 8 г : 80 г/моль = 0,1 моль
=> n(K2SO4) = 0,1 моль
M(K2SO4) = 78+32+64 = 174 г/моль
m(K2SO4) = 174 г/моль * 0,1 моль = 17,4 г
w(K2SO4) = 17,4 г : 174 г = 0,1 = 10%
w(K2SO4) - ?
При взаимодействии 8,0 г. оксида серы (VI) с избытком раствора гидроксида калия получили
174 г. раствора средней соли. Вычислите массовую долю соли в полученном растворе.
w(K2SO4) = 0,1 = 10%
Список задач
m(SO3) = 8 г
mр-ра(K2SO4) = = 174 г
Слайд 36
Задания с развернутым ответом (С2). Тип 1.
Задача №1
Задача №2
Задача №3
Задача №4
Задача №5
Задача
№6
Задача №7
Задача №8
Задача №9
Слайд 37
Задача №1
Список задач
При добавлении к раствору серной
кислоты с массовой долей 10% избытка раствора нитрата бария
образовался осадок массой 11,65 г. Определите массу исходного раствора серной кислоты.
Ответ: m(H2SO4) = 49 г.
Слайд 38
Задача №2
Список задач
К 100 г 5%-ного раствора
серной кислоты прилили избыток раствора хлорида бария. Определите массу
образующегося осадка.
Ответ: m(BaSO4) = 11, 65 г.
Слайд 39
Задача №3
Список задач
При пропускании 4,48 л. углекислого
газа (н.у.) через раствор гидроксида бария с массовой долей
12% образовался карбонат бария. Вычислите массу исходного раствора гидроксида бария.
Ответ: m(Ba(OH)2) = 285 г.
Слайд 40
Задача №4
Список задач
При добавлении к раствору гидроксида
натрия с массовой долей 10% избытка раствора сульфата меди
(II)образовался осадок массой 4,9 г. Определите массу исходного раствора щёлочи.
Ответ: m(NaOH) = 20 г.
Слайд 41
Задача №5
Список задач
При добавлении 6,3%-ного раствора азотной
кислоты к оксиду меди (II) было получено 75,2 г
соответствующей соли определите массу использованного раствора азотной кислоты.
Ответ: m(HNO3) = 400 г.
Слайд 42
Задача №6
Список задач
Вычислите массу хлорида калия, полученного
при взаимодействии соляной кислоты со 100 г раствора гидроксида
калия с массовой долей 10%.
Ответ: m(KCl) = 13,4 г.
Слайд 43
Задача №7
Список задач
Какую массу раствора с массовой
долей гидроксида натрия 20% надо прилить к раствору сульфата
железа (III) чтобы получить гидроксид железа (III) массой 25г?
Ответ: m(NaOH) = 138 г.
Слайд 44
Задача №8
Список задач
Вычислите массу раствора серной кислоты
(массовая доля кислоты 9,8%), которую необходимо взять для реакции
с раствором хлорида бария, чтобы получилось 233 г сульфата бария.
Ответ: m(H2SO4) = 980 г.
Слайд 45
Задача №9
Список задач
К 200 г раствора с
массовой долей серной кислоты 0,02 прилили избыток раствора хлорида
бария. Осадок отфильтровали, высушили и взвесили. Какую массу имеет осадок?
Ответ: m(BaSO4) = 116,5 г.
Слайд 46
Задания с развернутым ответом (С2). Тип 2.
Дано:
Найти:
Решение:
Ответ:
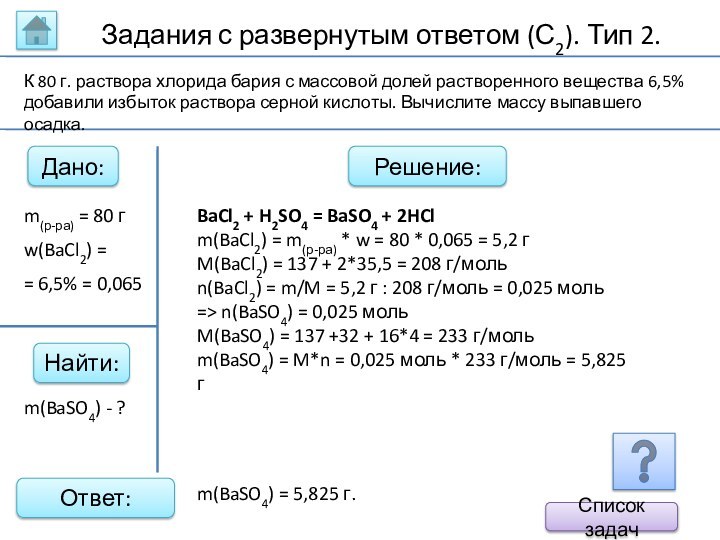
BaCl2 +
H2SO4 = BaSO4 + 2HCl
m(BaCl2) = m(р-ра) * w
= 80 * 0,065 = 5,2 г
M(BaCl2) = 137 + 2*35,5 = 208 г/моль
n(BaCl2) = m/M = 5,2 г : 208 г/моль = 0,025 моль
=> n(BaSO4) = 0,025 моль
M(BaSO4) = 137 +32 + 16*4 = 233 г/моль
m(BaSO4) = M*n = 0,025 моль * 233 г/моль = 5,825 г
m(BaSO4) - ?
К 80 г. раствора хлорида бария с массовой долей растворенного вещества 6,5% добавили избыток раствора серной кислоты. Вычислите массу выпавшего осадка.
m(BaSO4) = 5,825 г.
Список задач
m(р-ра) = 80 г
w(BaCl2) =
= 6,5% = 0,065
Слайд 47
Задания с развернутым ответом (С2). Тип 2.
Задача №1
Задача №2
Задача №3
Задача №4
Задача №5
Задача
№6
Задача №7
Задача №8
Задача №9
Задача №10
Слайд 48
Задача №1
В 73 г. соляной кислоты с
массовой долей HCl 5% поместили избыток цинка. Вычислите объем
выделившегося газа.
Ответ: V(H2) = 1,12 л.
Список задач
Слайд 49
Задача №2
К раствору карбоната калия массой 27,6
г. и массовой долей 20% прилили избыток раствора нитрата
кальция. Вычислите массу образовавшегося осадка.
Ответ: V(CaCO3) = 4 г.
Список задач
Слайд 50
Задача №3
Рассчитайте массу осадка, который выпадет при
взаимодействии избытка карбоната калия с 17,4 г. раствора нитрата
бария с массовой долей последнего 15%.
Ответ: m(BaCO3) = 1,97 г.
Список задач
Слайд 51
Задача №4
Определите объем (н.у.) углекислого газа, выделяющегося
при растворении 110 г. Известняка, содержащего 92% карбоната кальция,
в избытке азотной кислоты.
Ответ: m(CO2) =22,67 г.
Список задач
Слайд 52
Задача №5
В избытке соляной кислоты растворили 1,506
г руды, содержащей 77% карбоната железа (II). Определите объем
углекислого газа, выделившегося при этом.
Ответ: V(CO2) = 0,224 л.
Список задач
Слайд 53
Задача №6
Рассчитайте массу осадка, который выпадет при сливании
500 г. 2%-ного раствора иодида калия с избытком раствора
нитрата свинца.
Ответ: m(PbI2) = 13,9 г.
Список задач
Слайд 54
Задача №7
Вычислите массу хлорида калия, полученного при взаимодействии
соляной кислоты со 100 г. раствора гидроксида калия с
массовой долей его 10%.
Ответ: m(KCl) = 13,34 г.
Список задач
Слайд 55
Задача №8
К 200 г. 12,25%-ного раствора серной кислоты
прилили избыток раствора нитрата бария. Определите массу выпавшего осадка.
Ответ:
m(BaSO4) = 58,25 г.
Список задач
Слайд 56
Задача №9
Какой объем сероводорода (н.у) образуется при взаимодействии
сульфида железа (II) с раствором соляной кислоты массой 250
г. с массовой долей хлороводорода 25%.
Ответ: V(H2S) 19,2 л.
Список задач
Слайд 57
Задача №10
Какой объем (н.у.) оксида углерода (IV) выделится
при взаимодействии 25 г. карбоната натрия, содержащего 5% примесей,
с соляной кислотой.
Ответ: V(CO2) = 5,0 л.
Список задач
Слайд 58
Задания с развернутым ответом (С2). Тип 3.
Дано:
Найти:
Решение:
Ответ:
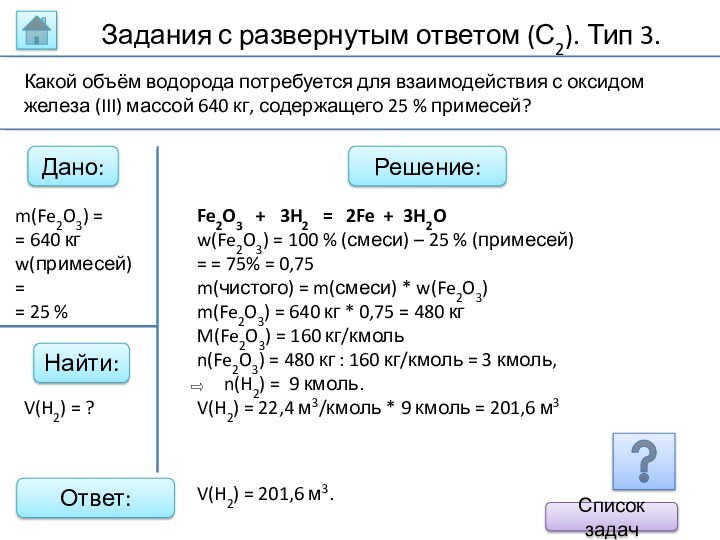
m(Fe2O3) =
= 640 кг
w(примесей) =
= 25 %
Fe2O3 + 3H2 = 2Fe + 3H2O
w(Fe2O3) = 100 % (смеси) – 25 % (примесей) = = 75% = 0,75
m(чистого) = m(смеси) * w(Fe2O3)
m(Fe2O3) = 640 кг * 0,75 = 480 кг
M(Fe2O3) = 160 кг/кмоль
n(Fe2O3) = 480 кг : 160 кг/кмоль = 3 кмоль,
n(H2) = 9 кмоль.
V(H2) = 22,4 м3/кмоль * 9 кмоль = 201,6 м3
V(H2) = ?
Какой объём водорода потребуется для взаимодействия с оксидом железа (III) массой 640 кг, содержащего 25 % примесей?
V(H2) = 201,6 м3.
Список задач
Слайд 59
Задания с развернутым ответом (С2). Тип 3.
Задача №1
Задача №2
Задача №3
Задача №4
Задача №5
Задача
№6
Задача №7
Задача №8
Задача №9
Слайд 60
Рассчитайте, сколько чистого оксида железа содержится в железой
руде, если масса железной руды с примесью 12 %
равна 250 г.
Ответ: m(Fe2O3) = 220 г.
Задача №1
Список задач
Слайд 61
При взаимодействии 10,79 г кальцинированной соды с избытком
соляной кислоты получили 2,24 л (при н. у.) углекислого
газа. Вычислите массовую долю примесей в соде.
Ответ: w(примесей) = 1,8 %
Задача №2
Список задач
Слайд 62
При растворении 226 г образца алюминия в соляной
кислоте выделилось 268,8 л водорода. Определите массовую долю примесей
в данном образце алюминия.
Ответ: w(примесей) = 4,42 %
Задача №3
Список задач
Слайд 63
Из 30 г известняка под действием азотной кислоты
выделилось 5,6 л углекислого газа. Определите массу карбоната кальция
и массовую долю примесей в данном образце известняка.
Ответ: m(CaCO3) = 25 г; w(примесей) = 16,7 %
Задача №4
Список задач
Слайд 64
Рассчитайте объём кислорода, который потребуется для сжигания 550
г сероводорода, содержащего 5 % примесей?
Ответ:
V(O2) = 516 л.
Задача №5
Список задач
Слайд 65
Какой объем углекислого газа выделится (н.у.) при обжиге
известняка массой 250 кг, содержащего массовую долю примесей 20%?
Ответ:
V(CO2) = 44,8 м3
Задача №6
Список задач
Слайд 66
Рассчитайте сколько чистого оксида железа содержится в железой
руде, если масса железной руды с примесью 12 %
равна 250 г.
Ответ: m(Fe2O3) = 220 г.
Задача №7
Список задач
Слайд 67
Вычислите объём аммиака, который можно получит при синтезе
из водорода и 30 г азота, содержащего 2% примесей.
Определите количество вещества израсходованного водорода.
Ответ: V(NH3) = 47 л; n(H2) = 3,15 моль.
Задача №8
Список задач
Слайд 68
Вычислите массу оксида магния, которая получается при обжиге
карбоната магния массой 252 кг с массовой долей примесей
в нем 3%.
Ответ: m(MgO) = 116,4 кг
Задача №9
Список задач
Слайд 69
Справочный материал
Селитры – это нитраты щелочных металлов, кальция
и аммония. Нитрат аммония (аммиачная селитра) — химическое соединение NH4NO3,
соль азотной кислоты.
Слайд 70
Справочный материал
Экви - значит «равное». Это
значит два или несколько веществ взяты с одинаковым количеством
молей (молекул). Эквимолекулярная смесь гидрофосфата и дигидрофосфата аммония состоит из NH4H2PO4 и (NH4)2HPO4.
Слайд 71
Справочный материал
Кальцинированная сода (кристаллическая) - Na2CO3·10H2O
(декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды).
M(Na2CO3·10H2O) = 46+12+48+10*(2+16)
= 286 г/моль.