уравнений химических реакций
Усвоение учащимися закона и его применения
Воспитание положительного
отношения к знаниям, патриотизма, трудолюбия
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть



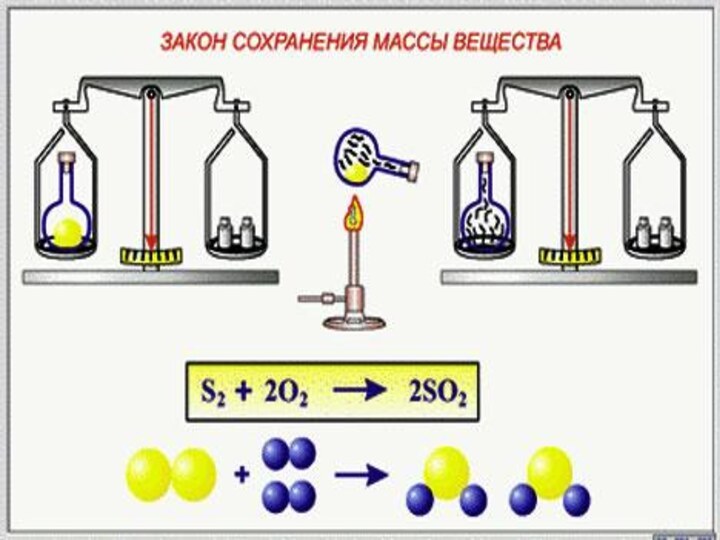


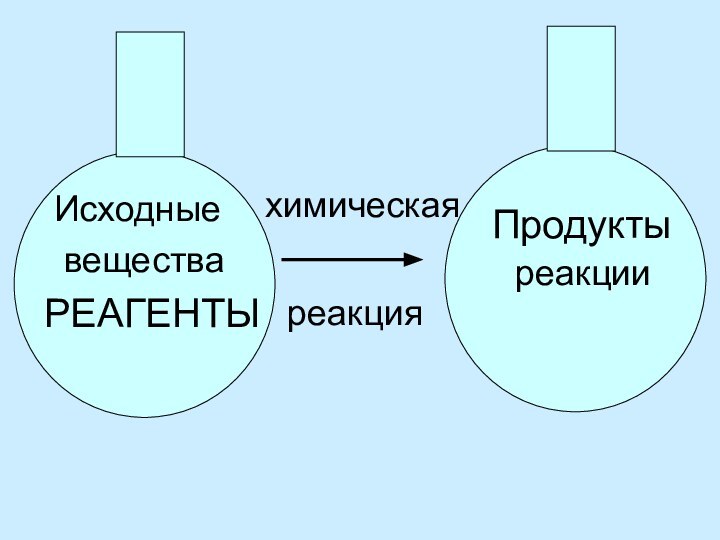


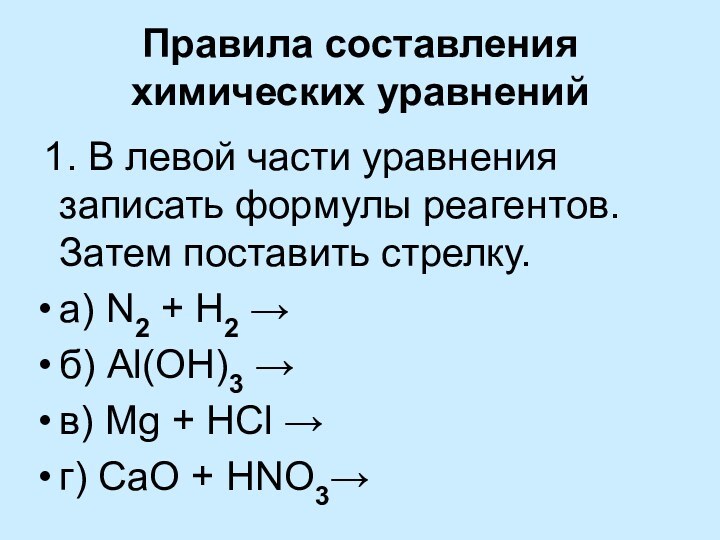
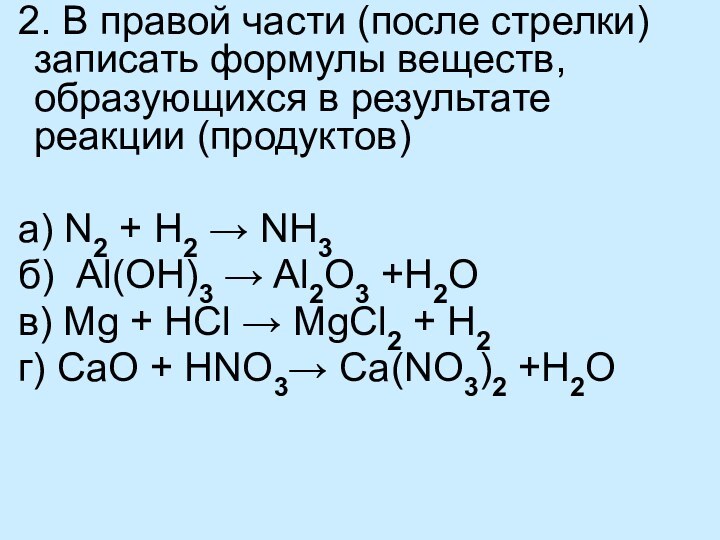



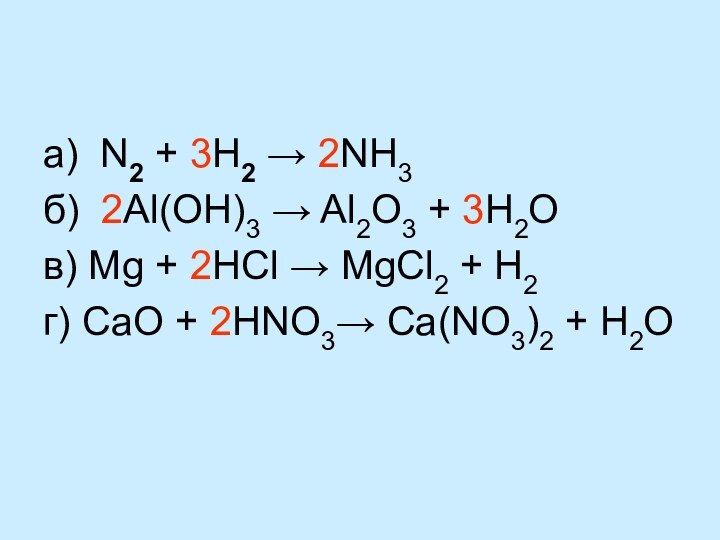


Выводы: