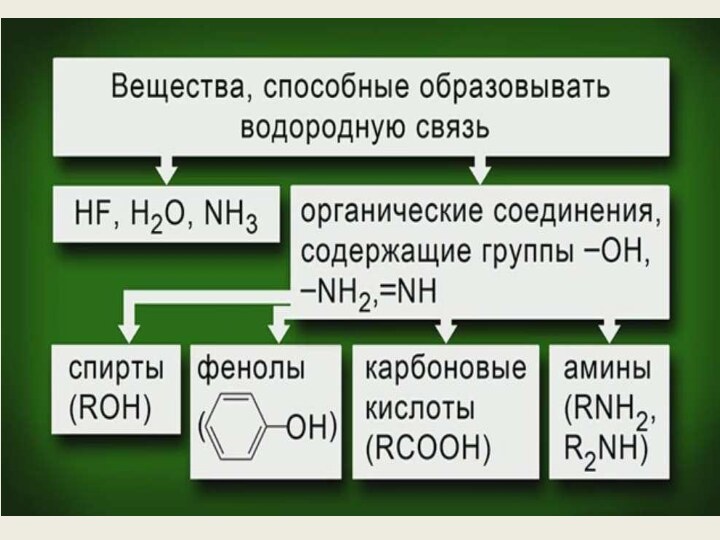
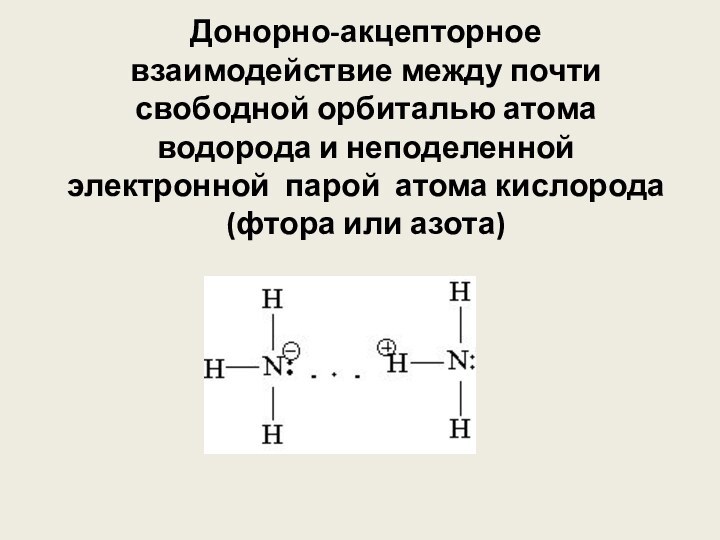
её части) и атомами наиболее электоротрицательных элементов (фтор, кислород,
азот) другой молекулы (или её части) называют водородной.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть









Н δ+ – Fδ⁻ . . . Hδ+ – F δ-
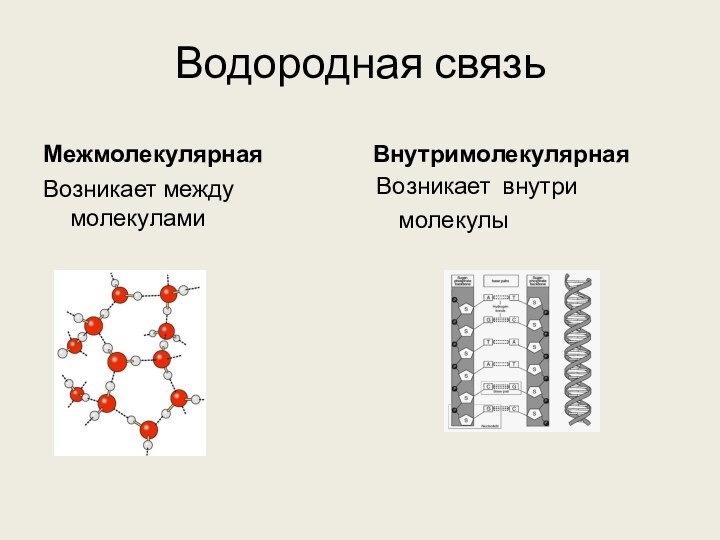
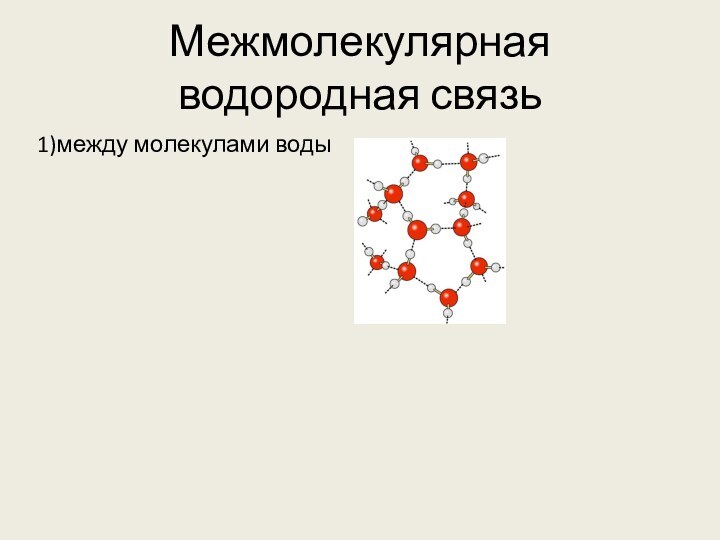
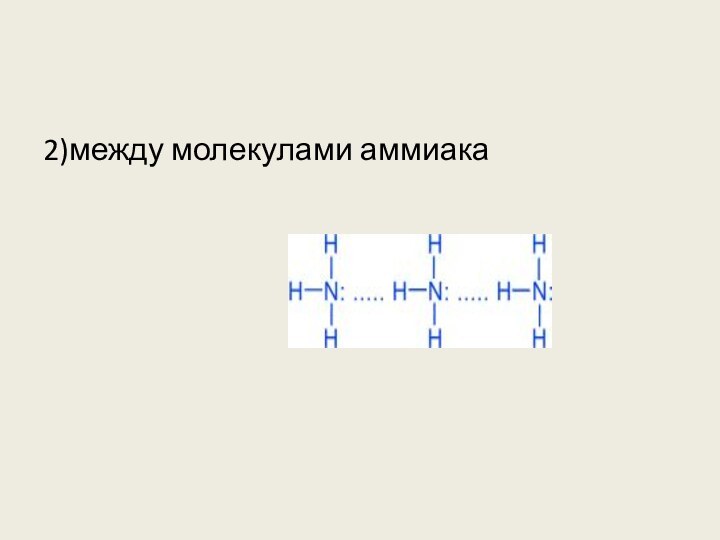
4. Водородные связи образуются между молекулами
1) метанола
2) метана
3) ацетилена
4) метилформиата
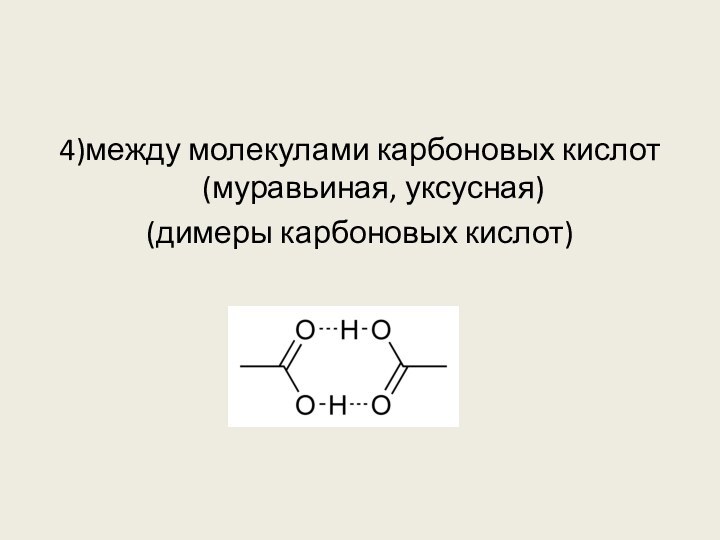
5. Водородная связь образуется между молекулами
1) этана
2) бензола
3) водорода
4) этанола
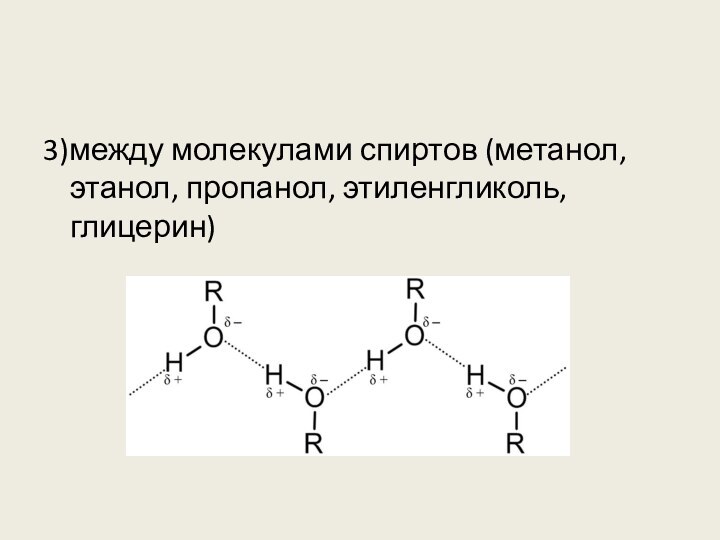
3. Водородные связи образуются между молекулами
1) глицерина
2) этилена
3) пропина-1
4) толуола
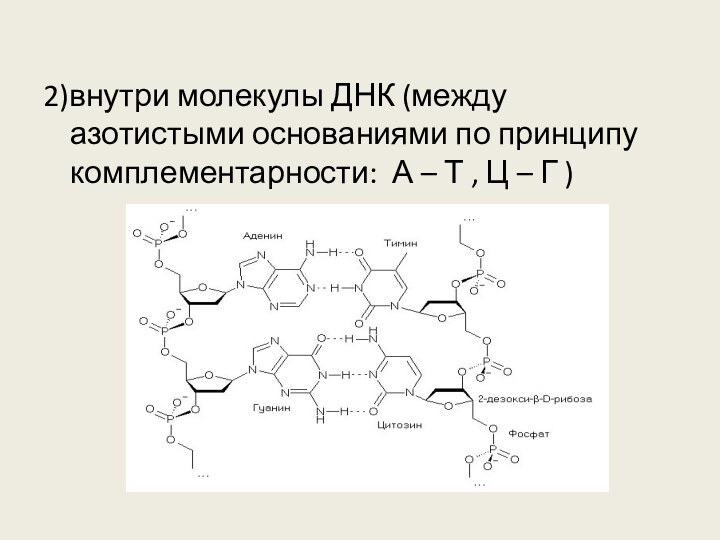
6. Водородная связь характерна для
1) алкенов
2) простых эфиров
3) первичных спиртов
4) аренов