14ē , 2ē
Характерные степени окисления
Fe+2
+2 -1
+2 -1 FeCl2 Fe(OH)2
Fe+3
+3 -1 +3 -1
FeCl3 Fe(OH)3
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть














Fe+3
+3 -1 +3 -1
FeCl3 Fe(OH)3
подробнее
подробнее
подробнее
подробнее
Далее
возврат
возврат
возврат
Fe2O3 · n H2O
возврат
FeS2
- плотность железа - 7,87 г/см3
- обладает сильными магнитными свойствами (ферромагнетик), хорошей тепло- и электропроводностью.
FeCl2 = Fe2+ + 2Cl-
0
0
2ē
t
+3 -1
Хлорид железа (III)
0
0
6ē
t
FeO·Fe2О3
Железная окалина
-2
+2
-2
0
2ē
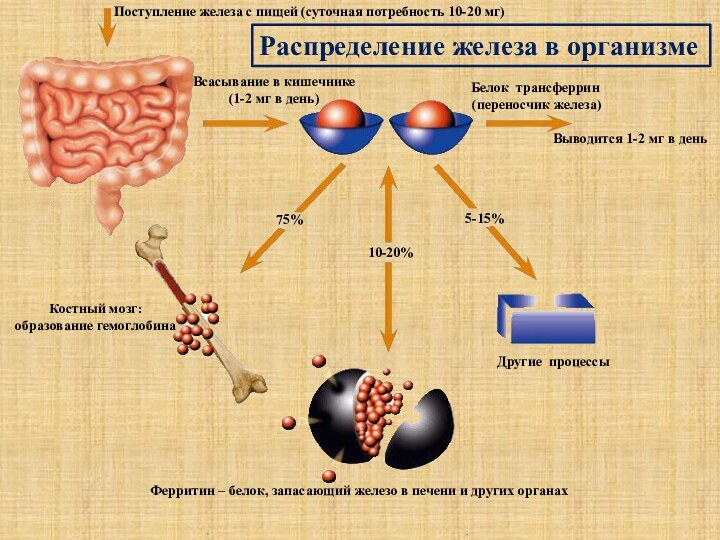
Другие процессы
Ферритин – белок, запасающий железо в печени и других органах
Костный мозг:
образование гемоглобина
75%
10-20%
5-15%
Распределение железа в организме