Слайд 2
«Ни одна наука не нуждается в эксперименте в
такой степени, как химия. Её основные законы, теории и
выводы опираются на факты. Поэтому постоянный контроль опытом необходим».
М. Фарадей
Слайд 3
«Свои способности, человек может узнать только попытавшись приложить
их.»
Сенека Младший
Слайд 4
Аристотель считал воду одним из «элементов» мироздания.
Российский
геохимик, академик Александр Евгеньевич Ферсман назвал воду самым важным
«минералом» на Земле.
Гимном этому веществу стали слова писателя Антуана Сент-Экзюпери:
«Вода – у тебя нет цвета, ни вкуса, ни запаха, тебя невозможно описать, тобою наслаждаются, не ведая, что ты такое. Нельзя сказать, что ты необходима для жизни. Ты сама – жизнь».
На Земле имеется громадное количество воды, человек непосредственно может использовать не более 0,05% общего количества воды.
Воды морей и океанов содержат в среднем 3,5% растворённых веществ.
Это соли – хлориды и сульфаты магния, которые находятся в морской воде в виде ионов.
Морская вода содержит 35г соли на 1 литр. Морская вода содержит растворённые газы и органические соединения.
Речные воды содержат ионы, нейтральные молекулы, взвешенные частицы, солей в них гораздо меньше.
Историческая справка.
Слайд 5
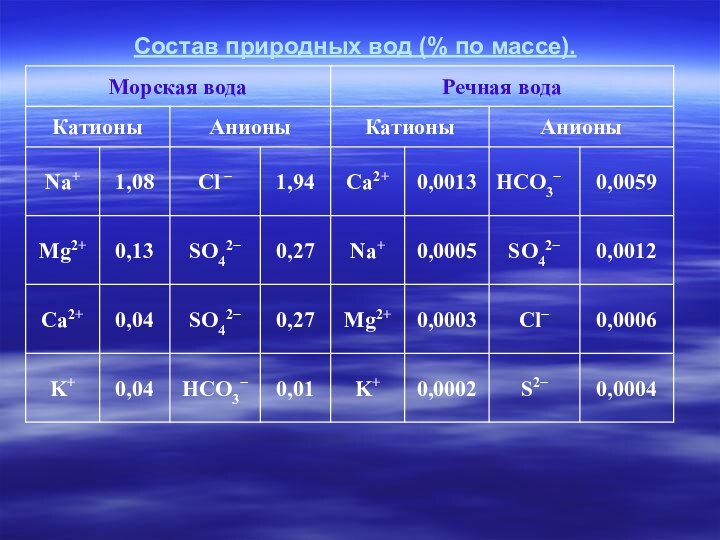
Состав природных вод (% по массе).
Слайд 6
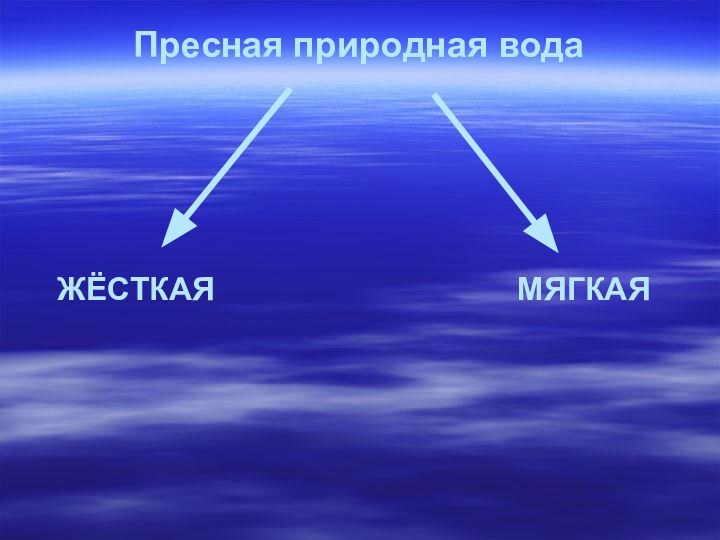
Пресная природная вода
ЖЁСТКАЯ
МЯГКАЯ
Слайд 7
Жёсткая вода непригодна:
Для питания паровых котлов
Для применения в
химической технологии
В производстве керамике, бетонных смесей, затворение глин
Приводит к
нарушению работ теплосетей
В жёсткой воде:
Мыло не образует пену
Плохо развариваются овощи
Не заваривается чай
Слайд 8
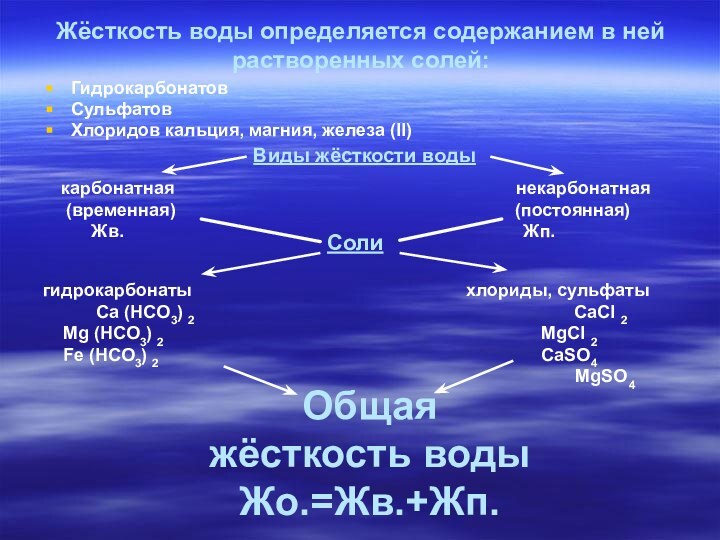
Жёсткость воды определяется содержанием в ней растворенных солей:
Гидрокарбонатов
Сульфатов
Хлоридов
кальция, магния, железа (II)
Виды жёсткости воды
карбонатная некарбонатная
(временная) (постоянная)
Жв. Жп.
Соли
гидрокарбонаты хлориды, сульфаты
Ca (HCO3) 2 CaCl 2
Mg (HCO3) 2 MgCl 2
Fe (HCO3) 2 CaSO4
MgSO4
Общая жёсткость воды
Жо.=Жв.+Жп.
Слайд 9
Методы определения жёсткости воды
Карбонатная жёсткость (временная) [Жв.] –
метод кислотно-основного титрования
Общая жёсткость [Жо.] –
метод
комплексонометрии
Некарбонатная (постоянная) [Жп.] –
определяют по разности между
Ж общая - Ж временная
Жв. (постоянная) = Ж общая - Ж временная
Слайд 10
Ваши опыты были успешны и
не причинили вред
вашему здоровью –
ПОМНИТЕ:
Совет 1:
Работай строго по инструктивной карточке!
Совет 2:
Не пробуй вещества на вкус!
Совет 3:
Используй точно указанное в инструкции количество вещества!
Совет 4:
Работай аккуратно с растворами кислот (щелочей)!
Совет 5:
Окончив работу – наведи порядок на рабочем столе!
Совет 6:
Тщательно вымой руки!
Проветрите помещение!
Инструкция по проведению следственного эксперимента
Слайд 11
Следственный эксперимент
Экспертные группы
Химический анализ
I гр. Водопроводная вода
II
гр. Родниковая вода
III гр. Снеговая (талая) вода
IV гр. Прудовая
вода (водоём «Копань», район ОАО «Биосинтез»)
V гр. Морская вода
VI гр. Вода и моющие средства
VII гр. Общая жёсткость воды
Слайд 12
Инструкция по проведению следственного эксперимента
№1 Определение жесткости водопроводной
воды
№2 Определение жесткости родниковой воды
№3 Определение жесткости снеговой (талой)
воды
№4 Определение жесткости воды водоёма (Копань район ОАО «Биосинтез»)
№5 Определение жесткости морской (искусственной) воды
№6 Вода и МС (мыло, стиральный порошок)
№7 Общая жёсткость воды (водопроводная, морская)
Слайд 13
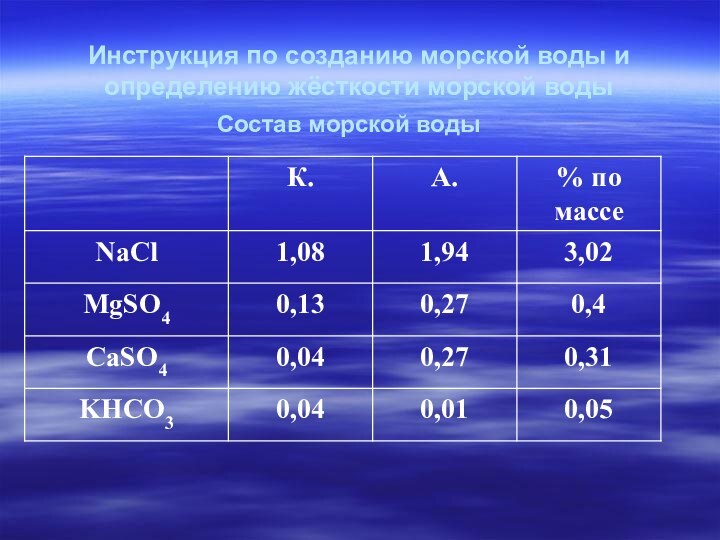
Инструкция по созданию морской воды и
определению жёсткости
морской воды
Состав морской воды
Слайд 14
Определение жёсткости морской воды
Рассчитать весовые части солей морской
воды
3,02: 0,4: 0,31: 0,05
60,4: 8 : 6,2 : 1 весовые части: MgSO 4 – 8г
CaSO4 – 6г
NaCl – 60г
KHCO3 – 1г
Отмерить (взвесить) на весах соли:
NaCl
MgSO4
CaSO4
KHCO3
Отмерить воду дист. объёмом 100 см3
Растворить соли в воде дист., тщательно перемешать
Добавить в морскую воду 3 капли индикатора метилоранж
Оттитровать стандартным раствором соляной кислоты (С=0,1 моль/л) до изменения окраски индикатора
Определить объём израсходованной кислоты. Анализ проводим 3 раза!
Оформить отчёт в таблицу «Определение жёсткости воды»
Слайд 15
Определение жёсткости воды
Примечание:
Количество (ммоль) израсходованное на титрование соляной
кислоты равно количеству (ммоль) солей, обуславливающих карбонатную жёсткость, содержащихся
в титруемом объёме воды.
За единицу карбонатной жёсткости воды принят один ммоль солей содержащихся в 1л воды.
Слайд 16
Вычисления:
Карбонатная жёсткость:
Жк. =C(HCl)*V(HCl)*1000
V
(H2O)
V (H2O) – объём воды, взятый на титрование
1000 –
1л воды, в котором по ГОСТУ определяют жёсткость воды.
Жёсткость воды
Мягкая ≤4
Средне жёсткая 4─8
Жёсткая 8─12
Очень жёсткая ≥12
Слайд 17
Инструкция по проведению химического анализа
Влияние жёсткости воды на
МС
Цель: выяснить действия различной воды на моющие средства
А) мыло
Б)
стиральный порошок
проанализировать информацию о жёсткости воды
Слайд 18
Информация к размышлению:
Жёсткость воды влияет на пенообразование МС
(мыла, стирального порошка).
Оценить это качество воды можно по
количеству пены, появляющиеся при встряхивании образцов воды с добавкой раствора моющего средства (мыла. стирального порошка).
Слайд 19
Ход работы
Оборудование:
Штатив с одинаковыми пробирками, стеклянные палочки,
ложки, линейка, резинки аптечные, часы песочные 1мин.
Реактивы:
мыло, стиральный
порошок
вода: водопроводная
родниковая
снеговая
прудовая
морская
Слайд 20
Порядок действий
Пронумерованные пробирки заполните на 1/5 их объёма
исследуемой водой.
Добавьте в каждую пробирку:
а) кусочек мыла размером с
горошину
б) 1 ложечку стирального порошка
Тщательно перемешайте стеклянными палочками и закройте пробками.
Соединив пробирки вместе аптечной резинкой, одновременно встряхивайте в течение 1 минуты.
Измерьте линейкой высоту пены в каждой пробирке и оформите отчёт в таблицу.
Слайд 21
Жесткость воды и моющие средства
Слайд 22
Примечание: чтобы мыло было удобно резать на равные
части, его следует размягчить:
кусочек мыла следует обернуть мокрой салфеткой,
поместить на сутки в по лиэтиленовый пакет.
Нарезать кусочки одинакового размера.
Анализ результатов жёсткости воды по количеству пены.
Слайд 23
Химическая экспертиза
(в хим. лабораториях)
Установлено:
Iгр.
Водопроводная вода Жводы =
IIгр.
Родниковая вода Жводы =
IIIгр. Снеговая (талая) вода Жводы =
IVгр. Прудовая вода Жводы =
Vгр. Морская вода Жводы =
Слайд 24
Общая жёсткость воды
Определяется Жо. воды – методом комплексонометрии
- титриметрический метод, основан на реакциях взаимодействия определяемых ионов
с некоторыми органическими реагентами. Ионы металлов практически мгновенно взаимодействуют с комплексонами с образованием растворимых малодиссоциированных соединений постоянного состава.
Комплексон (III) (трилон Б) со многими катионами образует прочные растворимые в воде внутрикомплексные соли:
Трилон Б определяют ионы: Ca 2+, Mg 2+, Br 2+, Cu 2+ , Zn 2+, Ni 2+, Al 3+, Cr 3+, Co 3+.
Грамм – эквивалент металла, независимо от степени окисления связывает один грамм – эквивалент комплексона.
Слайд 25
Порядок действий
Исследуемую воду объём 10 мл поместить в
колбу.
Анализируемую воду подщелочить до pH=10, прибавляя аммонийную буферную смесь.
Добавить
индикатор хромоген чёрный.
Титровать трилоном Б (титр установлен ранее).
Появление синей окраски раствора указывает на окончание реакции.
Определить Жо. Воды по формуле.
Ж=Cn (Na [H2Tr])*V (Na2 [H2Tr])*1000/V(H2O)
Где Cn (Na [H2Tr]) – нормальность трилона Б
V (H2O) – объём анализируемой воды
V (Na2 [H2Tr]) – объём трилона Б, пошедший на титрование
C (трилон Б)= 0,1 моль/л
Слайд 26
Общая жёсткость воды
(Метод комплексонометрии) – титриметрический метод, основан
на реакциях взаимодействия определяемых ионов с некоторыми органическими реагентами.
Ионы
металлов практически мгновенно взаимодействуют с комплексонами с образованием растворимых мало диссоциированных соединений постоянного состава.
Комплексон III (трилон Б) со многими катионами образует прочные растворимые в воде внутрикомплексные соли. Трилон Б – определяют ионы Ca 2+, Mg 2+, Co 3+, Cu 2+, Zn 2+, Ni 2+, Al 3+, Cr 3+, PO43-.
Грамм – эквивалент металла, независимо от степени окисления, связывает один грамм – эквивалент комплексона.
Общая жёсткость воды показывает содержание мили/моль гидрокарбонатов, сульфатов и хлоридов кальция и магния в 1л воды.
Слайд 27
Ход работы
Цель: определить Жо. воды водопроводной
Оборудование: бюретка, колба,
химический стакан
Реактивы: вода водопроводная, аммонийная буферная смесь (100мл 20%
раствора NH4Cl и 100мл 20% раствора NH3), индикатор хромоген чёрный, трилон Б (0,1н)
Отмерить объём исследуемой воды (водопроводной) 100см3 или 100мл
Добавить 5см3 аммонийной буферной смеси
5-7 капель спиртового индикатора хромогена чёрного
Титровать трилоном Б (комплексон III) (по каплям встряхивать)
Появление синей окраски раствора указывает на окончание реакции.
Слайд 29
Жо=Cn (Na [H2Tr])*V (Na2[H2Tr])*1000/V(H2O)
Где Cn (Na [H2Tr])
– нормальность трилона Б
V (H2O) – объём анализируемой воды
V
(Na2[H2Tr]) – объём трилона Б, пошедший на титрирование
или Жо = С(1/2 Na2H2Tr)*V(Na2H2Tr)*1000
100
Жо – [ммоль/л]
Расход трилона больше 5см3 на 100см3
Суммарное содержание кальция, магния c (1/2 Ca 2+, Mg 2+) больше 0,5 ммоль/л. титрование повторить, взяв меньший объём воды.
Нечёткое уменьшение окраски раствора в точке эквивалентности указывает на присутствие в воде катионов Cu 2+, Zn 2+, Mn 2+.





![ЖЕСТКОСТЬ ВОДЫ Методы определения жёсткости воды Карбонатная жёсткость (временная) [Жв.] – метод](/img/tmb/11/1043808/c0846c5ec3646dc29b03e77ae97ea4e2-720x.jpg)


















![ЖЕСТКОСТЬ ВОДЫ Жо=Cn (Na [H2Tr])*V (Na2[H2Tr])*1000/V(H2O)Где Cn (Na [H2Tr]) – нормальность трилона Б V](/img/tmb/11/1043808/26657032736a989e6982bbd25ba1bb98-720x.jpg)
