Слайд 2
История
Николай Михайлович Ице́нко (1889—1954) — советский невролог. Родился
17 (29) декабря 1889 года в селе Софиевка (ныне посёлок городского типа
Днепропетровской области Украины).
В 1907 году поступил на экономическое отделение Санкт-Петербургского университета, которое в 1909 году оставил и поступил в ВМА.
В 1913 году в академической газете «Студенческие годы» появились его статьи «К реформе Военно-медицинской академии 1913 года» и «На перепутье», в которых автор резко критиковал существующую в то время систему обучения. После этого Н. М. Иценко был вынужден покинуть академию и перевестись на медицинский факультет Юрьевского университета, который окончил в 1914 году.
Слайд 3
Научная деятельность
В 1924 году в «В Юго-Восточном вестнике

здравоохранения» (№№ 3—4, с. 136) Н. М. Иценко печатает
работу «Tumor hypophisis с полигляндулярным симптомокомплексом, в связи с обозрением вопроса о центральной иннервации вегетативных функций». В ней автор описывает случай опухоли головного мозга с богатой вегетативной и эндокринной симптоматикой, которая представляет собой совокупность отдельтных синдромов: адипозно-генитального ожирения, гипотиреоза, надпочечникового гирсутизма, панастении, «высокой рефлекторной возбудимости всех анализаторов», а также своеобразно проявляющихся «эпилептоидных припадков». Автор подчёркивает, что объяснить эти изменения только патологией гипофиза «было бы искусственно», так как именно в гипоталамусе находятся центры водного, жирового, углеводного обменов. Именно отсюда идут эндокринное ожирение, несахарный диабет, половые, трофические расстройства и другие нарушения желез внутренней секреции. В этой работе Н. М. Иценко впервые обосновывает мысль, что эта «Сложная запутанная картина нарушения обмена веществ» не может быть обусловлена только патологией гипофиза, а является результатом «участия центра вегетации» — гипоталамуса, здесь же лежит исходная точка своеобразных эпилептоидных припадков, входящих в комплекс вегетативных нарушений.
Слайд 4
Харви Уильямс Ку́шинг — известный нейрохирург и пионер
хирургии мозга. Он внёс огромный вклад в развитие нейрохирургии
и его часто называют «отцом современной нейрохирургии».
Этот человек внес легендарный вклад во всю историю развития медицины.
В 1932 году Х. Кушинг на основе исследований 1912 года опубликовал работу, в которой, обобщив литературные сообщения, проведя анализ своих наблюдений, пришёл к выводу, что некоторые опухоли гипофиза могут давать определенный клинический синдром, отличный от эозинофильной аденомы, и назвал его «питуитарный базофилизм». В этой работе, вышедшей в свет лишь спустя несколько лет после работы Н. М. Иценко (1924), синдром «питуитарного базофилизма» с выраженными нарушениями вегетативных функций объясняется не только гипофизарными нарушениями, но и поражением гипоталамуса. Гипоталамо-гипофизарный синдром носит название болезни Иценко-Кушинга.
Слайд 5
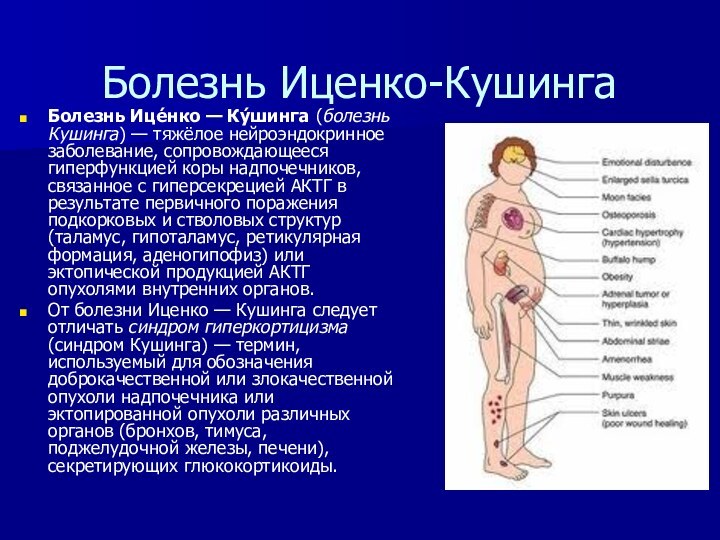
Болезнь Иценко-Кушинга
Болезнь Ице́нко — Ку́шинга (болезнь Кушинга) — тяжёлое нейроэндокринное
заболевание, сопровождающееся гиперфункцией коры надпочечников, связанное с гиперсекрецией АКТГ
в результате первичного поражения подкорковых и стволовых структур (таламус, гипоталамус, ретикулярная формация, аденогипофиз) или эктопической продукцией АКТГ опухолями внутренних органов.
От болезни Иценко — Кушинга следует отличать синдром гиперкортицизма (синдром Кушинга) — термин, используемый для обозначения доброкачественной или злокачественной опухоли надпочечника или эктопированной опухоли различных органов (бронхов, тимуса, поджелудочной железы, печени), секретирующих глюкокортикоиды.
Слайд 6
Болезнь Иценко-Кушинга – тяжелая нейроэндокринная патология гипоталамо-гипофизарного генеза,

патогенетической основой которой является формирование кортикотропиномы или гиперплазии кортикотрофов
гипофиза, сочетающееся с повышением порога чувствительности гипоталамо-гипофизарной системы к ингибирующему влиянию глюкокортикоидов, что приводит к нарушению суточной динамики секреции АКТГ с развитием вторичной двусторонней гиперплазии коры надпочечников и клинически проявляется синдромом тотального гиперкортицизма и снижением секреции лютеинизирующего, фолликулостимулирующего, тиреотропного
Синдром Иценко-Кушинга
1. Опухоль:
• надпочечника (кортикостерома, злокачественная кортикостерома, аденома, аденокарцинома);
• эктопическая (АКТГ- или кортикотропин-рилизинг-гормон-продуцирующая опухоль);
• гонад (липидноклеточные опухоли).
2. Двусторонняя (реже односторонняя) АКТГ-независимая нодулярная гиперплазия коры надпочечников.
3. Прием с лечебной целью глюкокортикоидов или, реже, препаратов АКТГ (ятрогенный, или экзогенный, синдром Иценко-Кушинга).
Слайд 7
Этиология: этиология болезни Иценко — Кушинга не установлена. В
анамнезе пациентов обоего пола встречаются ушибы головы, сотрясение мозга,
черепно-мозговые травмы, энцефалиты, арахноидиты и другие поражения ЦНС (кортикотропинома). У женщин болезнь Иценко — Кушинга чаще возникает после родов.
Эпидемиология: встречается с частотой 1:100 000 — 1:1 млн населения в год, чаще развивается в возрасте от 20 до 45 лет, иногда в детском возрасте, чаще отмечается у женщин (8:1) в возрасте 20-40 лет. В детском возрасте случаи болезни Иценко-Кушинга выявляют крайне редко. 90% случаев синдрома Иценко-Кушинга в детском возрасте были обусловлены злокачественными опухолями коры надпочечников.
Слайд 8
Патогенез
Патогенетическая основа болезни Иценко — Кушинга — изменение механизма контроля

секреции АКТГ. В результате снижения дофаминовой активности, ответственной за
ингибирующее влияние на секрецию кортикотропин-рилизинг гормона (КРГ, кортиколиберина) и адренокортикотропного гормона (АКТГ) и повышение тонуса серотониновой системы, нарушается механизм регуляции функции гипоталамо-гипофизарно-надпочечниковой системы и суточный ритм секреции КРГ—АКТГ—кортизола; перестаёт действовать механизм «обратной связи» с одновременным повышением концентрации АКТГ, гиперпродукцией кортизола, кортикостерона, альдостерона, андрогенов корой надпочечников; пропадает реакция на стресс — повышение уровня кортизола на фоне воздействия инсулиновой гипогликемии. Хроническая длительная кортизолемия ведёт к развитию симптомокомплекса гиперкортицизма.
В большинстве случаев обнаруживают аденому гипофиза. Макроаденомы встречаются в 10 % случаев, остальные представлены микроаденомами гипофиза, которые визуализируются только с помощью компьютерной томографии или хирургической диагностической аденомэктомии (у небольшой части пациентов опухоль не обнаруживается — гистологическое исследование обнаруживает только гиперплазию базофильных клеток гипофиза). В настоящее время окончательно не доказано являются ли аденомы гипофиза при болезни Иценко — Кушинга первичным поражением аденогипофиза или их развитие связано с расстройствами вышележащих отделов ЦНС.
Слайд 9
Клиническая картина
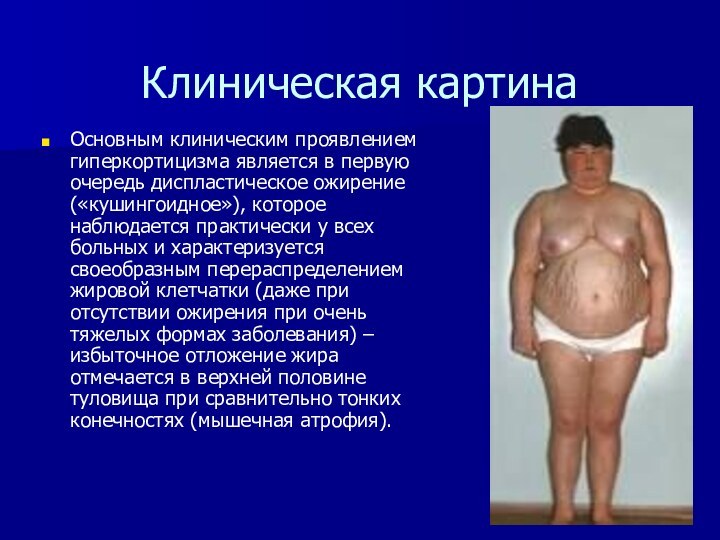
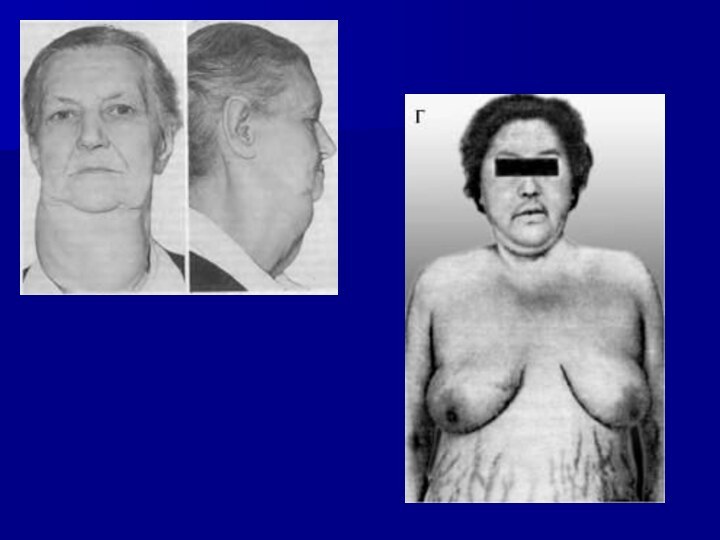
Основным клиническим проявлением гиперкортицизма является в первую
очередь диспластическое ожирение («кушингоидное»), которое наблюдается практически у всех
больных и характеризуется своеобразным перераспределением жировой клетчатки (даже при отсутствии ожирения при очень тяжелых формах заболевания) – избыточное отложение жира отмечается в верхней половине туловища при сравнительно тонких конечностях (мышечная атрофия).
Слайд 10
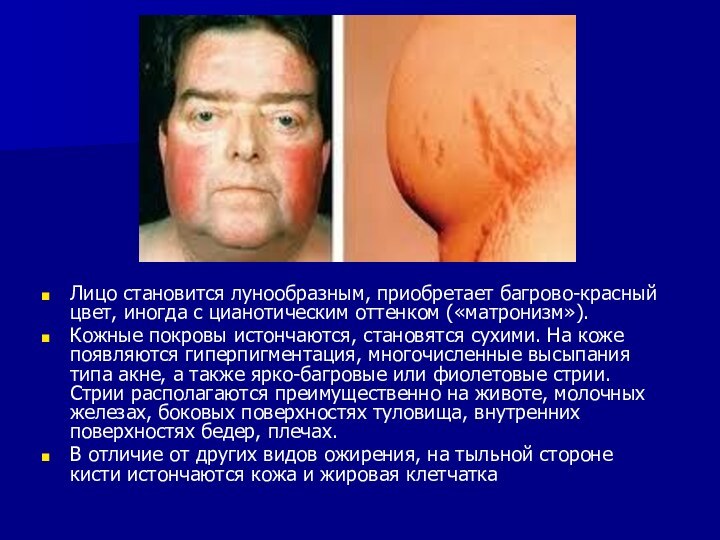
Лицо становится лунообразным, приобретает багрово-красный цвет, иногда с
цианотическим оттенком («матронизм»).
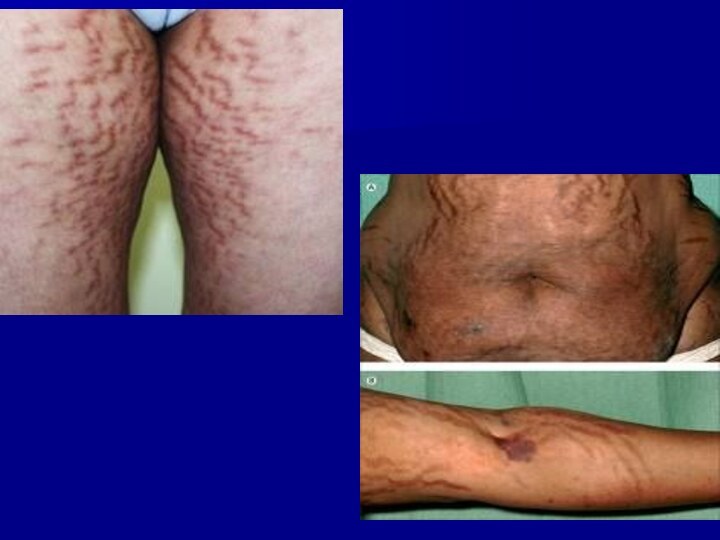
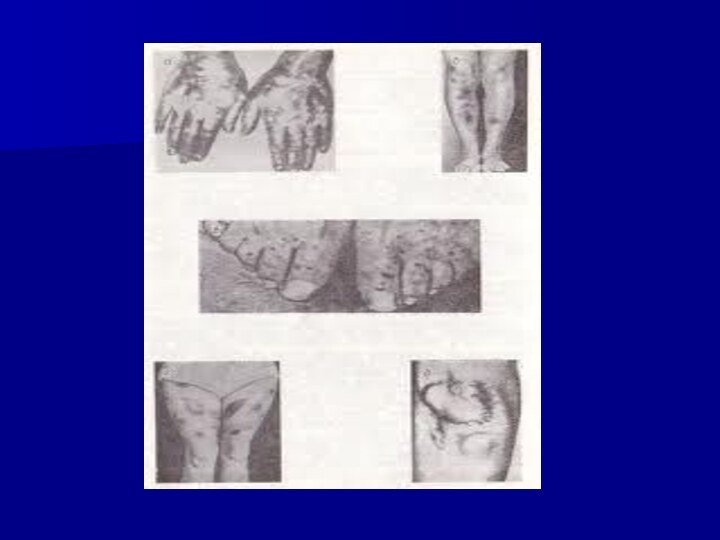
Кожные покровы истончаются, становятся сухими. На
коже появляются гиперпигментация, многочисленные высыпания типа акне, а также ярко-багровые или фиолетовые стрии. Стрии располагаются преимущественно на животе, молочных железах, боковых поверхностях туловища, внутренних поверхностях бедер, плечах.
В отличие от других видов ожирения, на тыльной стороне кисти истончаются кожа и жировая клетчатка
Слайд 14
У женщин вследствие избытка половых стероидов отмечают избыточное
оволосение, аменорею.
Слайд 15
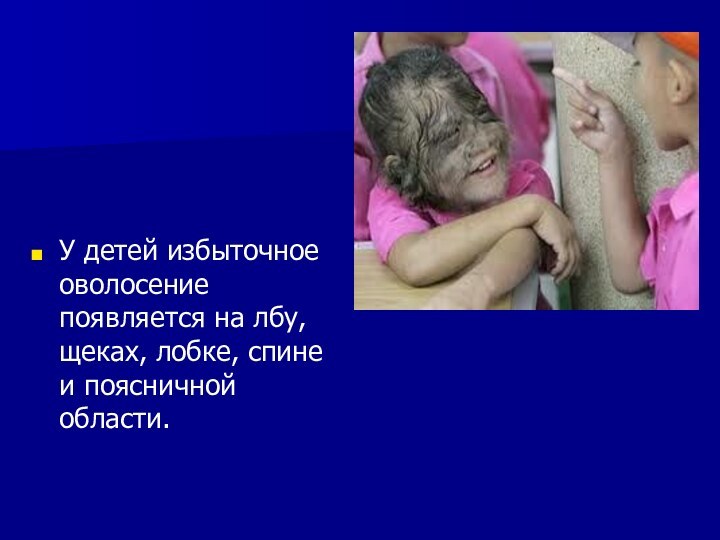
У детей избыточное оволосение появляется на лбу, щеках,
лобке, спине и поясничной области.
Слайд 16
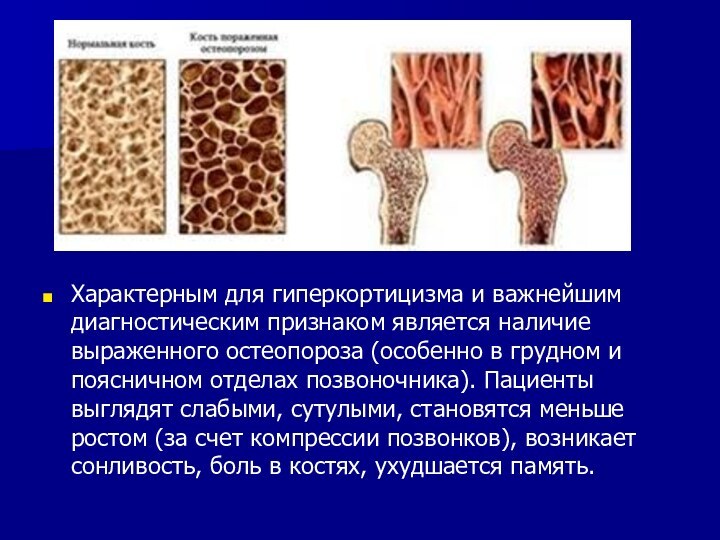
Характерным для гиперкортицизма и важнейшим диагностическим признаком является
наличие выраженного остеопороза (особенно в грудном и поясничном отделах
позвоночника). Пациенты выглядят слабыми, сутулыми, становятся меньше ростом (за счет компрессии позвонков), возникает сонливость, боль в костях, ухудшается память.
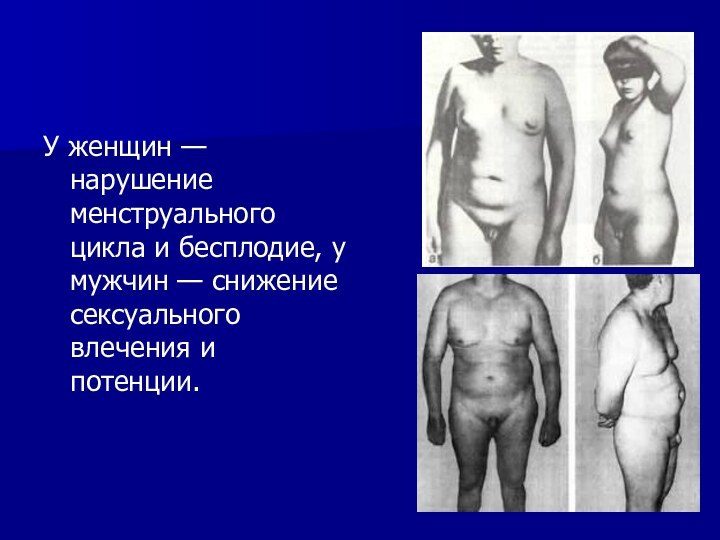
Слайд 17
У женщин — нарушение менструального цикла и бесплодие, у
мужчин — снижение сексуального влечения и потенции.
Слайд 18
Повышается артериальное давление.
Нарушение чувствительности к инсулину и развитие
сахарного диабета.
Возможно развитие мочекаменной болезни.
Иногда возникают нарушение сна, эйфория,
депрессия.
Снижение иммунитета. Проявляется образованием трофических язв, гнойничковых
Гипокалиемия различной степени выраженности. Стероидная миопатия и кардиопатия.
Количество эритроцитов, гемоглобина и холестерина увеличено.
Психические нарушения (депрессия, эйфория).
Слайд 19
Различают легкую, средней тяжести и тяжелую формы заболевания; течение
может быть прогрессирующим (развитие всей симптоматики за 6–12 мес) и торпидным
(симптомы постепенно нарастают в течение 3–10 лет).
Слайд 20
Постановка диагноза
Диагноз основывается на следующих данных: увеличение содержания 17-ОКС

в суточной моче, кортизола и АКТГ в плазме крови (наиболее достоверно ночное
повышение); при макроаденомах гипофиза — увеличение размеров турецкого седла;
остеопороз позвоночника и других костей скелета; поданным оксисупраренографии или компьютерной томографии-увеличение обоих надпочечников, а при наличии опухоли надпочечника видно ее изображение на соответствующей стороне; по данным сцинтиграфии надпочечников после введения 19-йод-холестерина отмечается увеличение контуров двух надпочечников, при наличии опухоли — одного. Диагностическими тестами для исключения опухоли коры надпочечников являются пробы с дексаметазоном, метопироном и АКТГ: при наличии опухоли надпочечника содержание 17-ОКС в суточной моче при введении этих веществ не изменяется, а при двусторонней гиперплазии уровень 17-ОКС снижается после введения дексаметазона (более чем на 50%) и повышается после введения АКТГ и метопирона (в 2–3 раза от исходного уровня).
Слайд 21
Лечение
Разработка и внедрение новых методов диагностики, а также

новых методов визуализации гипофиза и надпочечников (ультразвуковое исследование, компьютерная,
магнитно-резонансная томография) в настоящее время позволяют установить точную локализацию опухоли, ее размеры, взаимоотношения с окружающими тканями, направление роста и выбрать оптимальный метод лечения в каждом конкретном случае. Терапию при болезни Иценко-Кушинга рекомендуется проводить в условиях специализированного эндокринологического стационара.
Наиболее оптимальным методом лечения болезни Иценко-Кушинга на сегодня остается селективная транссфеноидальная аденомэктомия. Показанием для проведения нейрохирургической операции служит четко локализованная аденома гипофиза (по данным компьютерной или магнитно-резонансной томографии). Противопоказание – крайне тяжелая форма болезни Иценко-Кушинга или наличие у пациента тяжелых соматических заболеваний. При четко локализованной опухоли гипофиза независимо от ее размеров транссфеноидальная аденомэктомия дает положительные результаты у большинства больных, не требует продолжительной заместительной терапии и обеспечивает относительно быстрое восстановление гипоталамо-гипофизарных взаимоотношений. После проведения аденомэктомии в 70-80% случаев наступает ремиссия заболевания, в 12-20% может возникнуть рецидив.
Слайд 22
В последние годы применяют метод деструкции надпочечных желез,

который предполагает разрушение гиперплазированного вещества надпочечника путем введения склерозирующих
веществ под контролем ультразвукового исследования или компьютерной томографии (селективная флебография, реже – чрескожно). В качестве склерозирующего вещества обычно используют смесь 96% раствора этанола и 76% раствора урографина в соотношении 3:1. Количество вводимой жидкости определяется степенью гиперплазии надпочечника и его объемом. Как правило, деструкция надпочечников не применяется в качестве самостоятельного метода лечения (обычно в сочетании с лучевой терапией или аденомэктомией).
При отсутствии данных, подтверждающих наличие аденомы гипофиза, считается целесообразным проведение протонотерапии на область гипофиза, которую часто сочетают с односторонней адреналэктомией.
Медикаментозная терапия при болезни Иценко-Кушинга заключается в применении препаратов, подавляющих секрецию АКТГ (центрального действия – вещества дофаминергического действия, антисеротониновые ГАМК-эргические препараты) и блокаторов биосинтеза стероидных гормонов в надпочечниках. Последние подразделяют на средства, которые блокируют биосинтез кортикостероидов и вызывают деструкцию кортикальных клеток (производные орто-пара-дифенилдихлорэтана) и которые блокируют только синтез стероидных гормонов (производные аминоглютетимида).
Слайд 23
Следует отметить, что ингибиторы стероидогенеза назначают сразу же

после подтверждения диагноза болезни Иценко-Кушинга (как перед операцией, так
и после проведения протонотерапии либо хирургического вмешательства).
На фоне лечения основного заболевания обязательно проводится симптоматическая терапия:
– гипотензивными лекарственными средствами (ингибиторы АПФ, спиронолактон);
– препаратами калия;
– сахароснижающими препаратами (в случае необходимости);
– средствами для лечения остеопороза (препараты, снижающие резорбцию костной ткани – кальцитонины) и бисфосфонатами (этидронат-ксидифон, памидронат, клодронат); активными формами витамина D; препаратами, стимулирующими костеобразование, анаболическими стероидами;
– антидепрессантами, седативными средствами (при необходимости);
– витаминотерапия.
Проведение двусторонней адреналэктомии (которая используется в последние годы реже, однако абсолютным показанием для ее выполнения является тяжелое течение заболевания и невозможность компенсировать состояние другими имеющимися способами) ведет к возникновению у пациента хронической недостаточности надпочечников, которая требует пожизненной заместительной терапии глюко- и минералокортикоидами. Больные нуждаются в динамическом наблюдении эндокринолога, им рекомендуется избегать тяжелой физической нагрузки, работы в ночную смену.
Слайд 24
Двусторонняя адреналэктомия может осложниться (в 10-50%) синдромом Нельсона

– сочетанием первичной хронической недостаточности надпочечников (после хирургического лечения
или длительного применения хлодитана) с прогрессирующей кортикотропиномой гипофиза. Для синдрома Нельсона характерны все признаки первичного гипокортицизма на фоне высокого уровня секреции АКТГ. Магнитно-резонансное исследование подтверждает наличие быстро растущей макроаденомы гипофиза. Методами выбора являются транссфеноидальная аденомэктомия либо протонотерапия на область гипофиза. Для заместительного лечения целесообразно назначение дексаметазона в невысоких дозах (0,125-0,25 мг) в сочетании с преднизолоном или кортизоном. Во всех случаях необходимо применять мощный минералокортикоидный препарат 9-альфа-фторкортизол. Следует отметить, что в клинической практике отмечают случаи индивидуальной восприимчивости пациента к тому или иному препарату, применяемому для заместительной терапии. К сожалению, в аптечной сети не всегда можно найти лекарственное средство, которое подходит конкретному больному и при применении которого достигается наилучшая как клиническая, так и метаболическая компенсация недостаточности надпочечников, поскольку не все препараты этой группы зарегистрированы в Украине.
При наличии опухоли надпочечника проводят хирургическое удаление пораженной железы с последующей временной заместительной терапией. При злокачественной опухоли, если не выявлено метастазов или обнаружены единичные метастазы, осуществляют удаление надпочечника с последующим назначением хлодитана в течение длительного времени (при необходимости – в сочетании с глюкокортикоидами). После хирургического вмешательства все больные нуждаются в длительном наблюдении эндокринолога, кардиолога, невролога, гинеколога.