Слайд 2
Лекцію підготував кандидат біологічних наук
доцент Павліченко Віктор Іванович
medbio@zsmu.zp.ua
Запоріжжя
2017
Слайд 3
Лекція № 9. ХРОМОСОМНІ ХВОРОБИ.
ЦИТОГЕНЕТИЧНИЙ МЕТОД ЇХ
ДІАГНОСТИКИ
1) Цитогенетичний метод
а) каріотипування
б) метод статевого хроматину
3)
Хромосомні хвороби
4). Медико – генетичне консультування. Профілактика спадкових хвороб
Слайд 4
Цитогенетичний метод
Цитогенетичний аналіз дозволяє записувати діагноз спадкового захворювання
у вигляді каріотипічної формули.
Цитогенетичний метод (метод хромосомного аналізу) ґрунтується
на мікроскопічному дослідженні структури й кількості хромосом. Він набув широкого застосування в 20-х роках ХХ ст., коли було отримано перші відомості про кількість хромосом у людини. У 30-х роках були ідентифіковані перші 10 пар хромосом.
У 1956 р. шведські вчені Дж.Тийо і А.Леван вперше довели, що в людини 46, а не 48 хромосом.
Слайд 7
Набір хромосом (праворуч) і систематизований жіночий каріотип 46
XX (ліворуч). Одержано методом спектрального каріотипування.
Слайд 9
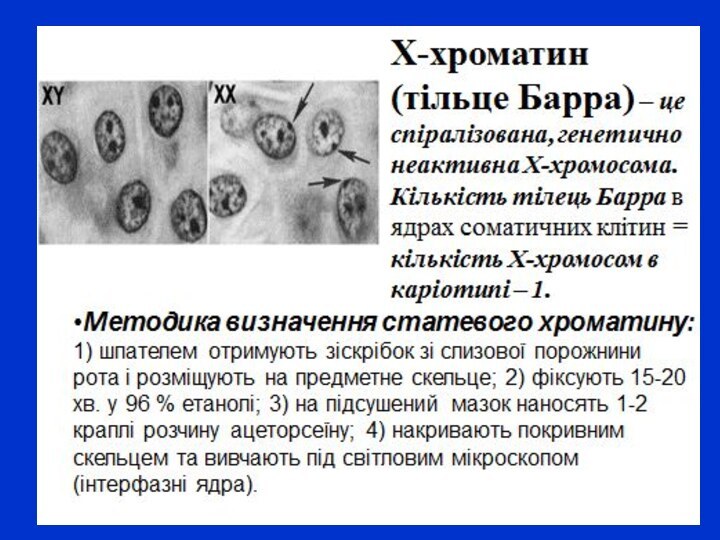
Метод статевого хроматину
Поряд з вивченням мітотичних хромосом певного

діагностичного значення набуває спостереження інтерфазних клітин. Відмінною ознакою жіночої
статі є вміст в інтерфазних ядрах статевого хроматину або тілець Барра. У 1949 р. Барр і Бертрам при вивченні нервових клітин кішки виявили в ядрах невеличке інтенсивно забарвлене тільце. Пізніше було доведено, що воно міститься тільки в ядрах клітин самок і його можна розглядати як ознаку, що відрізняє клітини самок від клітин самців. Це тільце отримало назву статевий хроматин або тільце Барра. Статевий хроматин міститься тільки в ядрах клітин самок тварин, які мають Х-хромосоми. Після забарвлення ця грудочка хроматину розташована поблизу ядерця, біля ядерної оболонки або лежить вільно в каріоплазмі. Локалізація статевого хроматину всередині ядра відносно постійна для клітин певного типу тканин. Встановлено, що статевий хроматин є не що інше, як одна із Х-хромосом, яка під час інтерфази перебуває в гетеропікнотичному стані. На стадії бластоцисти одна із Х-хромосом, материнського або батьківського походження, інактивується..
Слайд 12
Хромосомні хвороби – це велика група спадкових хвороб, основою
яких є хромосомні або геномні мутації.
Етіологічними чинниками хромосомної патології є
всі види хромосомних мутацій і деякі геномні мутації. У людини виявлені тільки три типи геномних мутацій: тетраплоїдія, триплоїдія та анеуплоїдія.
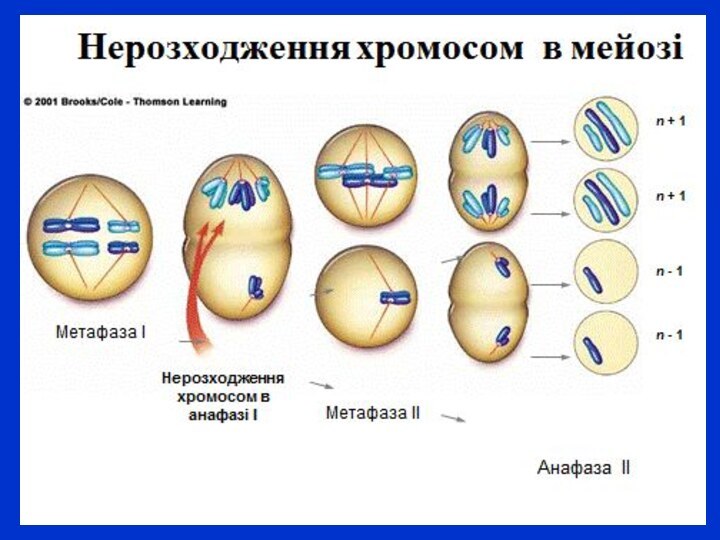
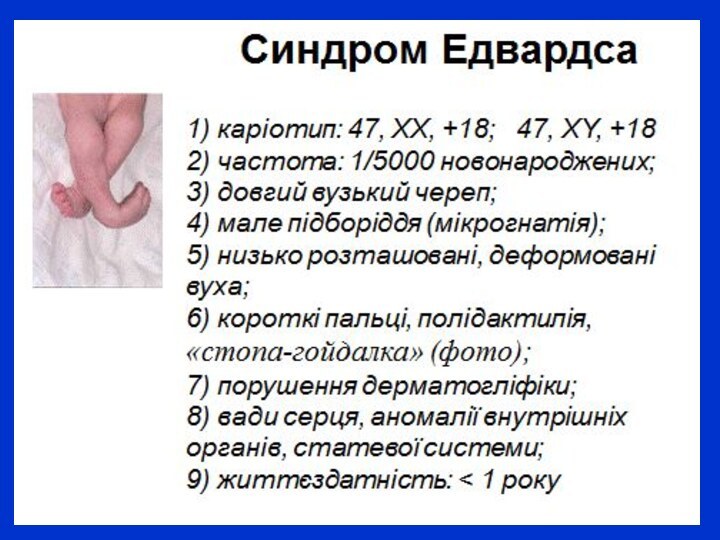
Хромосомні хвороби поділяються залежно від типу мутацій, на синдроми, зумовлені числовими (поліплоїдії, анеуплоїдії) або структурними змінами (делеції, інверсії, транслокації, дуплікації) хромосом.
Хромосомні хвороби характеризуються множинними ураженнями без певної патогенетичної ланки.
Якщо мутація виникла в зародкових клітинах, тоді виділяють повну форму хвороби, якщо нерозходження хромосом або структурна аберація з’явилися на різних стадіях дроблення зиготи, – розвиваються мозаїчні форми.
Слайд 16
Частота трисомії 21 серед новонароджених становить 1:650-1:800, у
популяції – 1:4000. Це найчастіша трисомія за автосомами серед
життєздатних новонароджених. Синдром Дауна складає від 5 до 15 % хворих з розумовою відсталістю. Співвідношення хворих хлопчиків та дівчаток дорівнює 1:1. Частота захворювання дітей з синдромом Дауна залежить від віку матері. У жінок після 35 років суттєво зростає частота народження дітей із трисомією 21.
За літературними даними протягом 15 років (1982-1997 роки) у зв’язку із зменшенням у 2 рази числа жінок, що народжували після 35 років, у Білорусії та Росії кількість дітей із синдромом Дауна зменшилась на 17-20 %. На частоту народження пацієнтів з трисомією 21 не впливають статеві, расові, географічні та популяційні відмінності.
Слайд 18
Критерії діагностики синдрому Дауна:
• Сплющення профілю обличчя 90
%.
• Відсутність рефлексу Моро 85 %.
• М'язова гіпотонія
80 %.
• Монголоїдний розріз очей 80 %.
• Надлишок шкіри на шиї 80 %.
• Гіперрухомість суглобів 80 %.
• Диспластичний таз 70 %.
• Диспластичні вуха 60 %.
• Клинодактилія мізинця 60 %.
• Чотирипальцева згинальна складка долоні 45 %.
Слайд 20
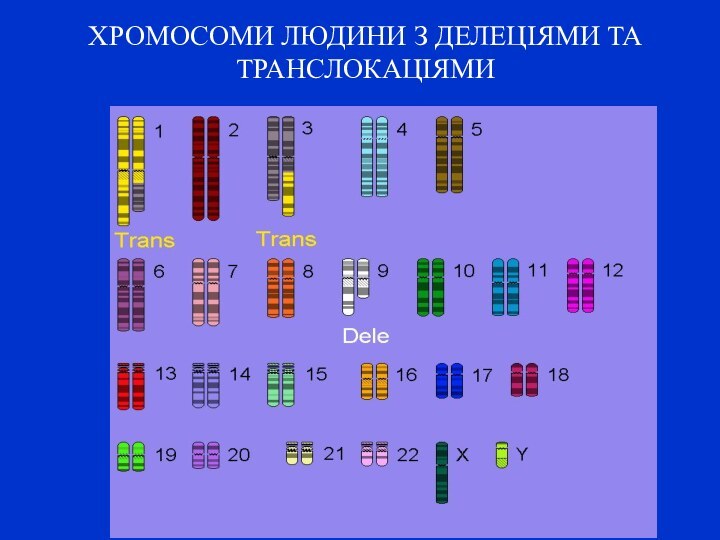
ХРОМОСОМИ ЛЮДИНИ З ДЕЛЕЦІЯМИ ТА ТРАНСЛОКАЦІЯМИ
Слайд 22
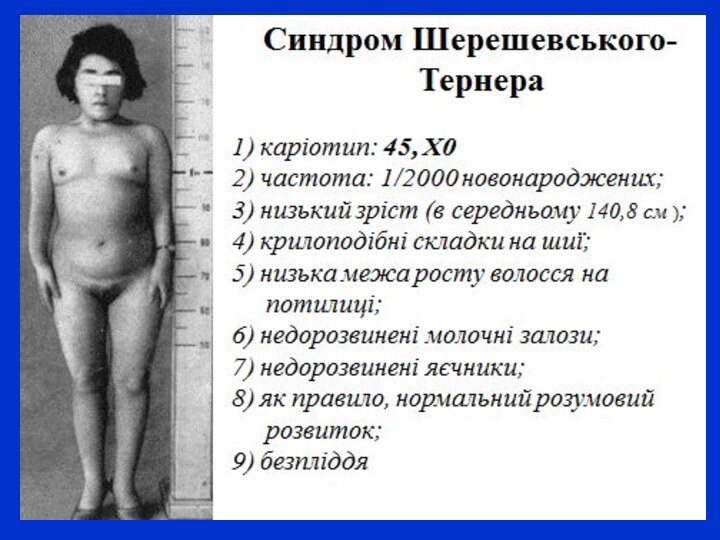
Синдром Шерешевського-Тернера характеризується каріотипом 45,XO. Це єдина форма моносомії, яка
сумісна з життям у людини. Частота синдрому серед новонароджених
дівчаток становить 1:2000. Захворювання описали М.О. Шерешевський у 1925 р. та Тернер у 1938 році.
Хворіють тільки особи жіночої статі. З боку статевої системи спостерігається відсутність або недорозвинені яєчники (аплазія, гіпоплазія гонад), гіпоплазія матки та маткових труб, первинна амеорея, недорозвинені молочні залози, збільшена відстань між сосками. Хворі мають характерний вигляд: коротка шия з двобічними крилоподібними складками, у новонароджених лімфатичний набряк стоп , гомілок, китиць та передпліч. Характерний в’ялий вираз обличчя, напівопущені повіки і кути рота (“обличчя сфінкса”). Ріст жінок на 20-30 см нижче середнього. Хворі з синдромом Шерешевського-Тернера є безплідними.
Слайд 27
Профілактика спадкових захворювань
Під первинною профілактикою розуміють такі заходи, які повинні
запобігти зачаттю та народженню хворої дитини. Основні напрямки:
1. Охорона
довкілля дозволить зменшити кількість спонтанних та індукованих мутацій (радіаційної, хімічної та біологічної природи).
2. Здоровий спосіб життя, зокрема не вживання алкоголю, зменшить кількість генеративних мутацій що призводять до неповноцінності гамет.
3. Поширення медико-генетичниз знань серед лікарів та населення дозволить вчасно діагностувати та направляти хворих у медико-генетичні консультації.
4. Заборона родинних шлюбів. В таких сім’ях частіше народжуються діти із рецесивними генними захворюваннями, оскільки більшість генів у нащадків переходить у гмозиготний стан.
5. Народжувати дітей у віці до 35 років рекомендується у зв’язку із збільшенням ризику ймовірності народженя хворої дитини у жінок з хромосомними захворюваннями, у чоловіків з деякими генними хворобами (ахондроплазія, синдром Марфана).
Слайд 28
Профілактика спадкових захворювань
(продовження)
6. Обстеження сімей, де є народжені
діти із спадковою патологією у медичних консультаціях з наступною
рекомендацією щодо подальшого планування народжуваності.
7. Пренатальна діагностика спадкових захворювань шляхом УЗД, амніоцентезу, визначення концентрації а-фетопротеїну у сироватці вагітної (вона знижена в крові жінок, що виношують плід із синдромом Дауна).
8. Преімплантаційна діагностика при якій за допомогою маткового лаважа отримують ще не імплантований зародок в період 90-130 годин після запліднення. Після імплантації зародка в матку успішна вагітність можлива у 50 %.
9. Відмова від народження дитини при високому (20 %) ризику народженя хворої дитини.