Слайд 2
Апоптоз
Регуляция клеточной пролиферации и дифференцировки, поддержание клеточного равновесия,
элиминация дефектных клеток и клеток, достигших стадии терминальной дифференцировки,
осуществляются способностью кроветворных клеток к программируемой смерти (апоптозу).
Термин “апоптоз” предложил в 1972 г. J.K. Кеп (греч. Аро - полное, ptosis - падение), заимствовав его у Гиппократа, использовавшего его для обозначения “осеннего листопада”.
Слайд 3
Основной закон клеточной кинетики состоит в том, что
в единицу времени рождается и умирает одно и то
же количество клеток. Различают два вида клеточной смерти: некроз и апоптоз.
Для первого необходимо прямое воздействие разрушающих (токсических) факторов, реализация второго требует слаженного участия целого комплекса внутриклеточных взаимодействий на уровне генов и кодируемых ими белков.
Слайд 4
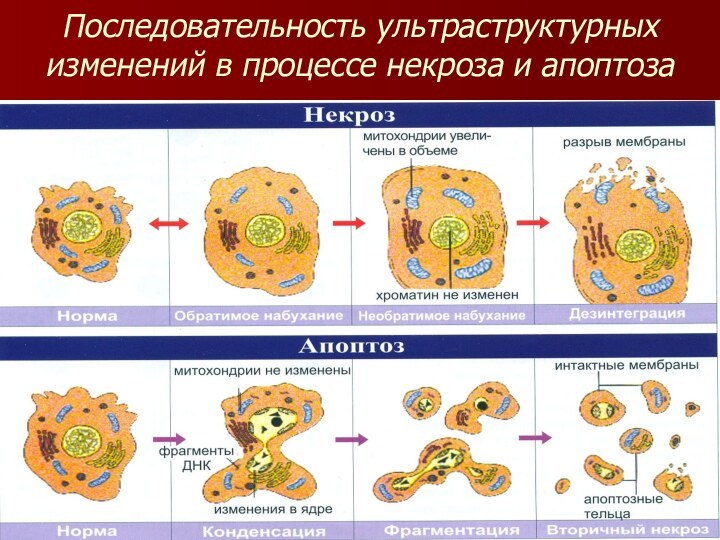
Морфологические признаки апоптоза
Морфологическими признаками апоптоза являются:
конденсация хроматина,
фрагментация ядра,
буллезное (пузырчатое) выпячивание цитоплазматической мембраны.
Наибольшие изменения
при апоптозе претерпевает ядро:
уменьшается в размере (пикноз),
хроматин конденсируется, сжимаясь в глыбки неправильной формы, уплотняется и подвергается фрагментации (кариорексис).
Эндонуклеазами расщепляются двойные цепочки ДНК на фрагменты, которые хорошо выявляются с помощью гель-электрофореза в виде дискретных полос, что используется для идентификации апоптоза.
Слайд 5
Последовательность ультраструктурных изменений в процессе некроза и апоптоза
Слайд 6
Морфологические признаки апоптоза
Клетки разрушаются до апоптозных телец различного
размера, сохраняющих целостность своей мембраны.
В некоторых таких тельцах
нет ядерного компонента, в других есть, причем хроматин всегда плотный, четко ограничен и сконденсирован у ядерной мембраны.
Процесс конденсации цитоплазмы и ее распад на апоптозные тельца осуществляется в течение нескольких минут.
Апоптозные тельца быстро поглощаются расположенными вблизи макрофагами.
Фагоцитоз протекает также быстро, из-за чего процесс апоптоза часто остается гистологически незаметным.
При апоптозе удаление умирающих клеток происходит безболезненно для окружающей ткани, которая не пропитывается внутриклеточным содержимым и, таким образом, не создаются условия для развития воспаления.
Слайд 7
Биологическая роль апоптоза
Апоптоз играет биологически полезную роль в
элиминации тех клеток, необходимость в которых отпала или выживание
которых вредно для организма в целом, например, клеток-мутантов или вирусинфицированных клеток.
Апоптоз стимулируется при лечении опухоли химиопрепаратами.
Уничтожение пораженных вирусом клеток путем апоптоза обеспечивает минимальное повреждение ткани по сравнению с другими механизмами смерти.
Биологический смысл фрагментации ДНК - предупреждение переноса генетического материала при фагоцитировании апоптозных телец.
Слайд 8
Молекулярные механизмы апоптоза
Слайд 9
Молекулярные механизмы апоптоза
Выделяют 2 типа сигнальных путей, вызывающих
апоптоз – повреждение ДНК, радиация и другие факторы, активирующие
каспазы-9 и сигналы, возникающие при активации Fas-рецептора с последующей активацией каспазы-8.
Повреждение ДНК вызывает активацию гена р53, сигнал проходит через активацию генов семьи Bcl-2 (Bax и Bid). Белки этих генов вызывают повреждение мембраны митохондрий и выход в цитозоль цитохрома С, активирующего белок Apaf-1, образуя апоптосому, где и происходит активация каспазы-9. Последняя активирует каспазу-3 и вместе с другими каспазами, протеазами, ДНК-азами вызывает апоптоз.
Слайд 10
Регуляция апоптоза
Множество генов участвуют в регуляции апоптоза.
Ведущую
роль в осуществлении апоптоза играют ферменты - каспазы.
Ключевым
фактором в его реализации является индуктор - белок р53, относящийся к группе генов-супрессоров опухоли. Кроме того, р53 участвует в управлении клеточным циклом, вызывая блок в делении клеток при повреждении ДНК.
Генетические дефекты, связанные с мутацией гена р53, приводят к образованию злокачественных опухолей с пониженной способностью к апоптозу.
Одним из основных ингибиторов апоптоза считается продукт гена bcl-2. В то же время сверхпродукция белка гена bcl-2 тормозит апоптоз в клетке, что наблюдается, например, при В-клеточной фолликулярной лимфоме.
Слайд 11
Пролиферация и дифференцировка стволовых и коммитированных клеток-предшественников в
нормальном кроветворении способна осуществляться только в условиях их выживания,
для чего необходимо воздействие антиапоптотических факторов.
Среди последних наиболее значимыми являются ростовые факторы, большинство из которых препятствуют апоптозу:
фактор стволовых клеток,
тромбопоэтин,
эритропоэтин,
колониестимулирующие факторы,
ИЛ-2,
ИЛ-3,
ИЛ-6 и др.
Слайд 12
Ростовые факторы действуют на зрелые клетки, обеспечивая их
выживание и нормальное функционирование.
Воздействие ростовых факторов происходит через
специфические рецепторы - FAS-R (CD95/APO-l) - это поверхностные рецепторы клетки, передающие сигнал апоптоза, под действием которого активируются каспазы (семейство цистеиновых протеаз), эндонуклеазы, другие ядерные белки.
Уровень экспрессии FAS/APO-l наиболее выражен в зрелых гранулоцитах, моноцитах и минимален в бластных клетках.
Биологический биологический смысл:
для клетки в конечной стадии дифференцировки облегчаются условия запуска апоптоза, в то время как для бластов вероятность программированной гибели оказывается низкой. Обратная зависимость наблюдается в экспрессии bcl-2.
Изучение механизмов апоптоза и его регуляции имеет большое значение в изучении онкогенеза, поиске новых путей ингибиции опухолевого роста.
Слайд 13
Некроз
При некрозе гибель клеток происходит в результате физической
или химической травмы, ишемии, гипертермии и других факторов.
В
клетке рано возникают изменения формы, функции митохондрий, сморщивание органелл, дезинтеграция цитоплазмы, повреждается большая часть цитоплазматической мембраны, что приводит к высвобождению лизосомных ферментов.
На поздней стадии ядерный хроматин исчезает, т. е. имеет место кариолизис.
Некроз сопровождается экссудативным воспалением, и, если в процесс вовлечено большое количество клеток, образованием рубца