Слайд 2
Похідні піримідину і тіазолу
Молекула піримідино-тіазолових
вітамінів (вітамінів В1 - тіамінів) складається з двох гетероциклів
- піримідину (А) і тіазолу (Б), з'єднаних між собою метиленовою групою:
У медичній практиці використовуються тіаміну гідробромід, тіаміну гідрохлорид, дифосфатний естер тіаміну гідрохлориду (кокарбоксилаза).
Слайд 3
Препарати вітамінів групи В1
Тіаміну гідробромід (Thiamini hydrobromidum) (ДФУ)
3-[(4-Аміно-2-метил-
піримідин-5-іл)метил]-5-(2-гідроксіетил)-4-метилтіазолій броміду гідробромід
Тіаміну гідрохлорид (Thiamini hydrochloridum)
(ДФУ)
3-[(4-Аміно-2-метил-
піримідин-5-іл)метил]-5-(2-гідроксіетил)-4-метилтіазолій хлориду гідрохлорид
Слайд 4
Вітамін В1 є першим вітаміном, відкриття якого поклало
початок науки вітамінології.
Вперше його виділили з рисових висівок
(Функ в 1912 р.). Ця речовина в малих дозах вилікувала голубів від поліневриту і через те, що містить в своїй структурі атом сірки, названа тіаміном.
Найбільше міститься в злакових (зернових) рослинах, дріжджах, жовтках, воловій печінці. З природних джерел добувається важко і з малим виходом (з 1 т дріжджів – 0,25 г вітаміну В1).
Для лікувальної мети одержують синтетично, добуваючи спочатку окремо піримідинову та тіазолову сполуки, які потім конденсують.
Тіамін належить до аміноспиртів гетероциклічного ряду (наявність карбінольної та амінної груп).
Слайд 5
Властивості тіамінів
Тіаміну гідробромід
Кристалічний порошок білого або
білого з жовтавим відтінком кольору зі специфічним запахом. Легко
розчинний у воді, мало розчинний у 96 %-ному спирті, практично не розчинний в ефірі.
Тіаміну гідрохлорид
Кристалічний порошок білого або майже білого кольору чи безбарвні кристали. Легко розчинний у воді, розчинний у гліцерині, малорозчинний у 96 %-ному спирті. Гігроскопічний.
Стійкі тільки в кислому середовищі. У нейтральному та лужному середовищах розкладаються з розривом тіазольного циклу і утворенням меркаптогрупи.
Слайд 6
Ідентифікація тіамінів
Тіаміну гідробромід
ІЧ-спектрофотометрія.
Тіохромна проба.
Реакції на броміди.
Тіаміну гідрохлорид
ІЧ-спектрофотометрія.
Тіохромна проба.
Реакції
на хлориди.
Нефармакопейні реакції
а) З розчинами FeCl3 та K3[Fe(CN)6] утворюється
синє забарвлення берлінської блакиті.
б) При зтопленні з кристалічним NaOH або металічним натрієм утворюються сульфід-іони, які виявляють реакцією з нітропрусидом натрію (червоно-фіолетове забарвлення).
в) Тіамін з розчинів кількісно осаджується деякими загальноалкалоїдними реактивами (реактиви Драгендорфа, Бертрана, Шейблера, пікринова кислота, п-аміноацетофенон, сіль Рейнеке).
Слайд 7
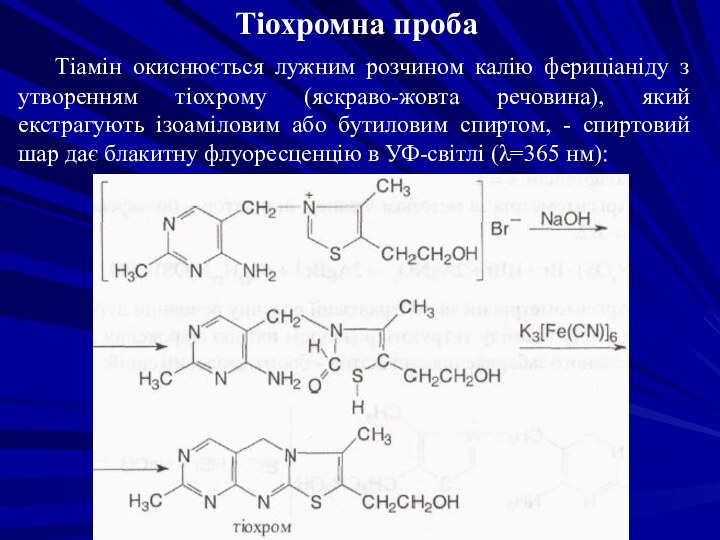
Тіохромна проба
Тіамін окиснюється лужним розчином калію фериціаніду з утворенням
тіохрому (яскраво-жовта речовина), який екстрагують ізоаміловим або бутиловим спиртом, - спиртовий шар дає блакитну флуоресценцію в УФ-світлі (λ=365 нм):
Слайд 8
Кількісне визначення тіаміну гідроброміду та гідрохлориду
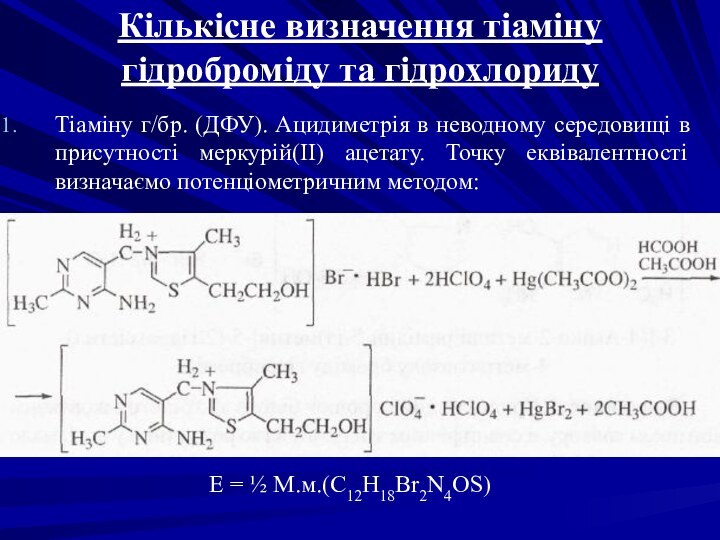
Тіаміну г/бр. (ДФУ).
Ацидиметрія в неводному середовищі в присутності меркурій(II) ацетату. Точку
еквівалентності визначаємо потенціометричним методом:
Е = ½ М.м.(C12H18Br2N4OS)
Слайд 9
Тіаміну г/хл. (ДФУ). Алкаліметрія у суміші 0,01 М
розчину кислоти хлоридної і 96 %-ного спирту. Титрант 0,1
М розчин NaOH. Точку еквівалентності визначають потенціометрично. У розрахунок беруть об’єм титранту між двома стрибками потенціалів на кривій титрування. Е = ½ М.м.
Тіаміну г/хл.(ДФУ додаток 1). Ацидиметрія в неводному середовищі у суміші кислоти форміатної і оцтового ангідриду. Точку еквівалентності визначають потенціометрично. Е = ½ М.м.
Слайд 10
Гравіметрія після осадження лікарського препарату кремнійвольфрамовою кислотою. Склад
осаду: SiO2•12WO3• 2C12H17BrN4OS або SiO2•12WO3• 2C12H17ClN4OS.
Алкаліметрія, пряме титрування, індикатор-бромтимоловий
синій або фенолфталеїн. Е=М.м.
Аргентометрія за методом Фаянса, індикатор - бромфеноловий
синій. Е=1/2 М.м.
Флуориметрія (за інтенсивністю флуоресценції тіохрому).
Аргентометрія після нейтралізації розчину речовини лугом. Наважку тіаміну броміду титрують розчином натрію гідроксиду до блакитно-зеленого забарвлення, індикатор - бромтимоловий синій.
Потім розчин підкислюють кислотою нітратною, додають індикатор - ферум(III) амоній сульфат і 0,1 мл 0,1М розчину амоній тіоціанату - з'являється червоне забарвлення внаслідок утворення ферум(III) тіоціанату:
Слайд 11
Реакційну суміш титрують 0,1 М
розчином аргентум нітрату:
Слайд 12
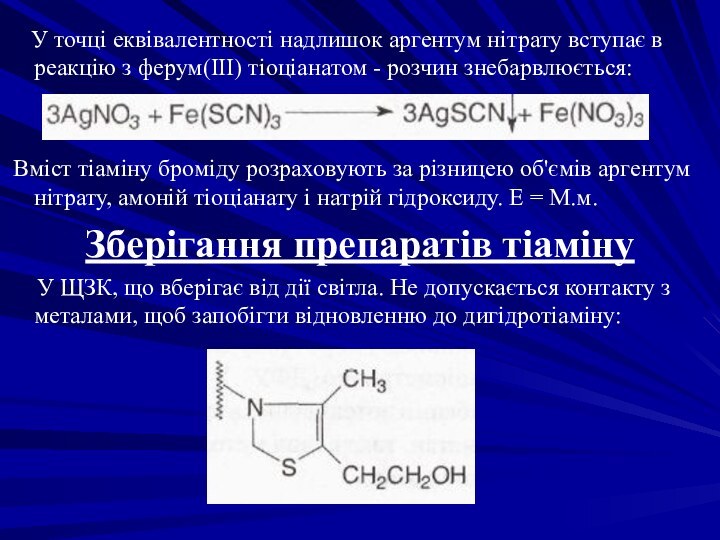
У точці еквівалентності надлишок аргентум нітрату
вступає в реакцію з ферум(III) тіоціанатом - розчин знебарвлюється:
Вміст тіаміну броміду розраховують за різницею об'ємів аргентум нітрату, амоній тіоціанату і натрій гідроксиду. Е = М.м.
Зберігання препаратів тіаміну
У ЩЗК, що вберігає від дії світла. Не допускається контакту з металами, щоб запобігти відновленню до дигідротіаміну:
Слайд 13
Застосування препаратів тіаміну
В1 відіграє важливу роль в організмі
людини. Є складовою частиною коферменту – кокарбоксилази. При нестачі
вітаміну В1 виникають розлади вуглеводневого обміну, в тканинах накопичуються молочна та піровиноградна кислоти, у зв’язку з чим можуть виникати неврити та розлади роботи серця. Впливає на білковий та ліпідний обміни, бере участь у регулюванні водного обміну.
Денна потреба 2 мг (1 мг препарату – 330 МО).
Авітаміноз – хвороба бері-бері, гіповітаміноз – розлади нервової системи.
Застосовують для лікування гіпо- і авітамінозів даного вітаміну та захворювань, пов'язаних з порушенням функції нервової системи.
Слайд 14
Тіаміну гідробромід в зв'язку з його більшою молекулярною
масою приймають у більших дозах (1 мг тіаміну гідрохлориду
відповідає за активністю 1,29 мг тіаміну гідроброміду).
Випуск: Тіаміну гідрохлорид – драже по 0,002 г, амп. 5%-1,0 №10; тіаміну гідробромід – драже по 0,0026 г №50.
Входить до складу полівітамінів та препаратів вітамінів групи В (неуробекс, нейрон, нейровітан, нейрорубін, мульти-табс В-комплекс).
Не рекомендується вводити одночасно парентерально вітаміни В1 з В6 (затримка естерифікації тіаміну фосфатною кислотою) і В12 (посилює алергічну дію тіаміну), а також змішувати в одному шприці вітамін В1 з пеніцилінами або стрептоміцином (розклад антибіотиків) і нікотиновою кислотою (розклад тіаміну).
Слайд 15
Кокарбоксилаза
(Cocarboxylasum) ККБ
Гідрохлорид дифосфатного естеру тіаміну
ККБ
– ліофілізована суха пориста маса білого кольору зі слабким
специфічним запахом, гіркувато-кисла на смак. Легко розчинна у воді, мало розчинна в етанолі.
Розкладається при нагріванні до температури вище 35°С.
Зберігають в темному місці, при температурі менше 5°С.
Слайд 16
ККБ – кофермент ферментів, які беруть участь в
обміні вуглеводів. У сполуці з білками та іонами магнію
входить до складу ферменту карбоксилази, яка каталізує карбоксилювання і декарбоксилювання α-кетокислот.
В зв’язку з нестачею ККБ при захворюваннях на бері-бері α-кетокислоти (особливо піровиноградна кислота СН3СОСООН) нагромаджуються в тканинах.
Призначають її при аритмії, недостатності коронарного кровообігу та інших серцево-судинних захворюваннях, цукровому діабеті та різних патологічних процесах, пов'язаних з погіршенням вуглеводного обміну.
Вводять в/м, в/в, п/ш по 0,05-0,1 г 1 раз на добу.
Випуск: запаяні ампули по 0,05 г стерильного порошку, який перед застосуванням (ex tempore) розчиняють в 0,5% розчині новокаїну або 0,9% розчині натрію хлориду.
Слайд 17
Похідні птерину
Птеринові вітаміни, до числа яких належить кислота
фолієва (вітамін Вс), містяться в зеленому листі шпинату, петрушки,
салату; в бобових і злакових культурах (пшениця, жито, кукурудза), а також у дріжджах, печінці.
В основі хімічної структури даних вітамінів лежить птеридинове ядро, яке є конденсованою системою піримідинового (А) і піразинового (В) циклів. Похідне птеридину 2-аміно-4-оксиптеридин називають птерин.
Слайд 18
Кислота фолієва
(Acidum folicum), вітамін Вс (ДФУ)
(2S)-2-[[4-[[(2-Аміно-4-окси-птеридин-6-іл)метил]аміно]бензоїл]аміно]пентандіонова кислота
Назва вітаміну походить від латинського слова folium –
листок. Фолієва кислота є в природі як у вільному стані так і у вигляді поліглютамінатів, в яких є додаткові залишки глютамінової кислоти.
Слайд 19
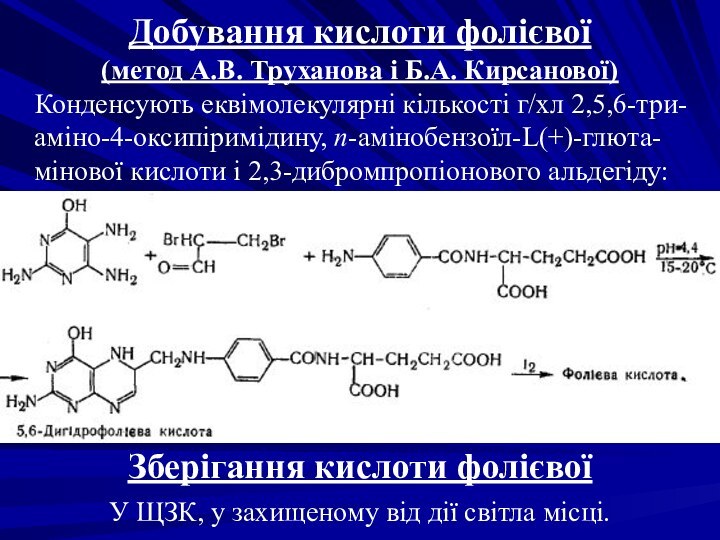
Добування кислоти фолієвої
(метод А.В. Труханова і Б.А.
Кирсанової)
Конденсують еквімолекулярні кількості г/хл 2,5,6-три-аміно-4-оксипіримідину, п-амінобензоїл-L(+)-глюта-мінової кислоти
і 2,3-дибромпропіонового альдегіду:
Зберігання кислоти фолієвої
У ЩЗК, у захищеному від дії світла місці.
Слайд 20
Властивості кислоти фолієвої
Кристалічний порошок жовтуватого або оранжевого кольору.
Практично не розчинний у воді і в більшості органічних
розчинників (відмінність від інших вітамінів). Розчиняється в розведених кислотах (наявність атомів нітрогену амінного характеру) і розчинах лугів (наявність вільної карбоксильної групи). Розкладається під дією світла, гігроскопічний.
Молекула кислоти фолієвої складається з трьох основних частин: 2-аміно-4-оксиптеридину (птерин), n-амінобензойної кислоти і зв'язаного з нею залишку глютамінової кислоти.
Кислота фолієва є амфотерною сполукою: основні властивості зумовлені атомами Нітрогену молекули птеридину, кислі - карбоксильними групами і гідроксильною групою у положенні 4.
Слайд 21
Ідентифікація кислоти фолієвої
За фізико-хімічними константами: питоме обертання, методом
рідинної хроматографії, методом ТШХ.
Нефармакопейні реакції:
а) при додаванні до
розчину препарату в хлоридній кислоті калій перманганату (з наступним виділенням його надлишку гідроген пероксилом) утворюються п-амінобензоїлглютамінова та птеридин-6-карбонова (птеринова) кислоти. Остання має значно сильнішу
синю флуоресценцію, ніж фолієва
кислота, і тому її застосовують для
флуориметричного кількісного
визначення препарату.
Слайд 22
б) визначення УФ-спектральних характеристик фолієвої кислоти.
в) завдяки кислотним властивостям кислота
фолієва з солями важких металів утворює нерозчинні забарвлені комплекси;
із CuSO4 - зелений осад, з Co(NO3)3 - темно-жовтий осад, з FeCl3 - червоно-жовтий. Загальна формула цих солей:
Слайд 23
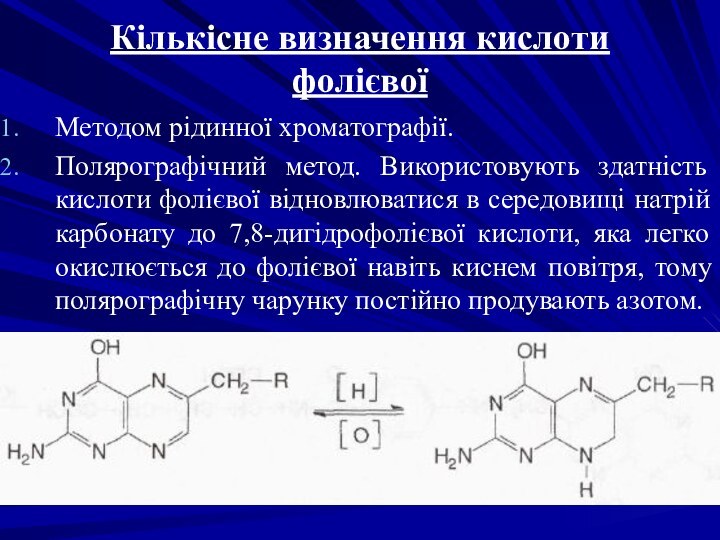
Кількісне визначення кислоти фолієвої
Методом рідинної хроматографії.
Полярографічний метод. Використовують
здатність кислоти фолієвої відновлюватися в середовищі натрій карбонату до
7,8-дигідрофолієвої кислоти, яка легко окислюється до фолієвої навіть киснем повітря, тому полярографічну чарунку постійно продувають азотом.
Слайд 24
Фотоколориметричний метод. В основі методики лежить окиснення кислоти
фолієвої калій перманга-натом з утворенням n-амінобензоїлглютамінової кислоти, її діазотування
та азосполучення з N-(1-нафтил)-етилендіаміну дигідрохлоридом. У результаті утворюється забарвлений у фіолетовий колір азобарвник, інтенсивність забарвлення якого в розчині визначають фотоколориметром при λ=550 нм.
Слайд 26
Застосування кислоти фолієвої
Кислота фолієва бере участь в процесі
кровоутворення, тому її називають антианемічним фактором. Разом з вітаміном
В12 вона стимулює еритропоез, бере участь у синтезі амінокислот (метіоніну, серину тощо), нуклеїнових кислот, пуринів і піримідинів і в обміні холіну. В організмі відновлюється до тетрагідрофолієвої кислоти – коферменту, який бере участь у різних метаболічних процесах.
Денна потреба кислоти фолієвої для здорової людини становить 0,2 - 1 мг. Її нестача призводить до анемій.
Для профілактики нестачі кислоти фолієвої при незбалансованому чи незадовільному харчуванні її приймають всередину по 20-50 мгк щоденно; при вагітності - по 400 мкг на день, при лактації – по 300 мкг.
Випуск: табл. по 0,001 г і 0,005 г № 50.
Застосовують для посилення еритропоезу, при деяких видах анемій, у тому числі при анеміях і лейкопеніях, викликаних ліками та іонізуючою радіацією, хронічних гастроентеритах і туберкульозі кишківника.
Слайд 27
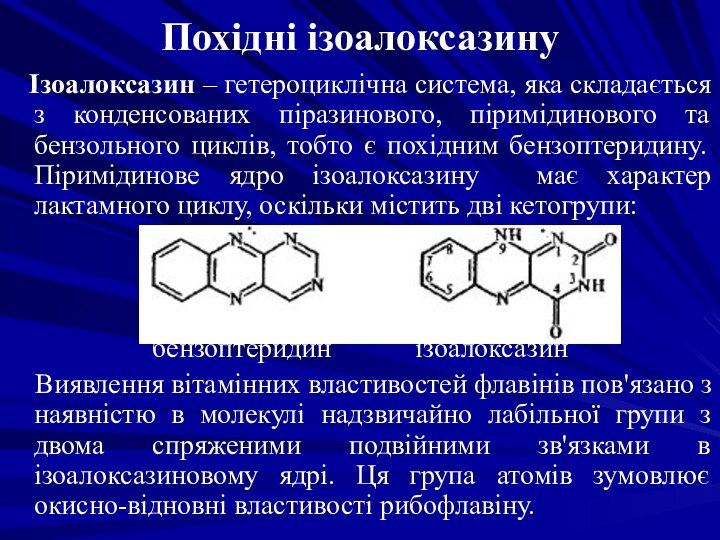
Похідні ізоалоксазину
Ізоалоксазин – гетероциклічна система, яка
складається з конденсованих піразинового, піримідинового та бензольного циклів, тобто
є похідним бензоптеридину. Піримідинове ядро ізоалоксазину має характер лактамного циклу, оскільки містить дві кетогрупи:
бензоптеридин ізоалоксазин
Виявлення вітамінних властивостей флавінів пов'язано з наявністю в молекулі надзвичайно лабільної групи з двома спряженими подвійними зв'язками в ізоалоксазиновому ядрі. Ця група атомів зумовлює окисно-відновні властивості рибофлавіну.
Слайд 28
Рибофлавін (Riboflavinum)
вітамін В2 (ДФУ)
7,8-Диметил-10-[(2S,3S,4R)-2,3,4,5-тетрагідрокси-пентил] бензо[g]птеридин-2,4(ЗH,10H)-діон,
або
6,7-диметил-9-(1’-D-рибітил)-ізоалоксазин
Уперше ізоалоксазинові вітаміни (вітамін В2) було виділено з
молочної сироватки (тому його ще називають “лактофлавін”). Назва вітаміну В2 "рибофлавін" походить від того, що він містить залишок багатоатомного спирту, похідного рибози, а його розчини мають жовтий колір (лат. flavus - жовтий).
Слайд 29
Рибофлавін дуже поширений як в рослинних, так і
в тваринних продуктах: міститься в сироватці молока, печінці, нирках,
пекарських і пивних дріжджах; у злаках - пшоні, ячмені; у овочах - шпинаті і томатах.
Для добування 1 г препарату треба переробити 5,4 т молочної сироватки, тому тепер синтезують вітамін В2 з D-рибози, о-4-ксилідину та барбітурової кислоти.
Властивості. Кристалічний порошок жовтого або оранжево-жовтого кольору. Дуже мало розчинний у воді, практично не розчинний у 96 %-ному спирті, ефірі, ацетоні, хлороформі. Легко розчинний в хлоридній (утворює солі) та ацетатній кислотах. Розчини розкладаються під дією світла, особливо в присутності лугу. Виявляє поліморфізм.
Слайд 30
Ідентифікація рибофлавіну
За фізико-хімічними константами: питоме обертання, ІЧ-спектроскопія, ТШХ.
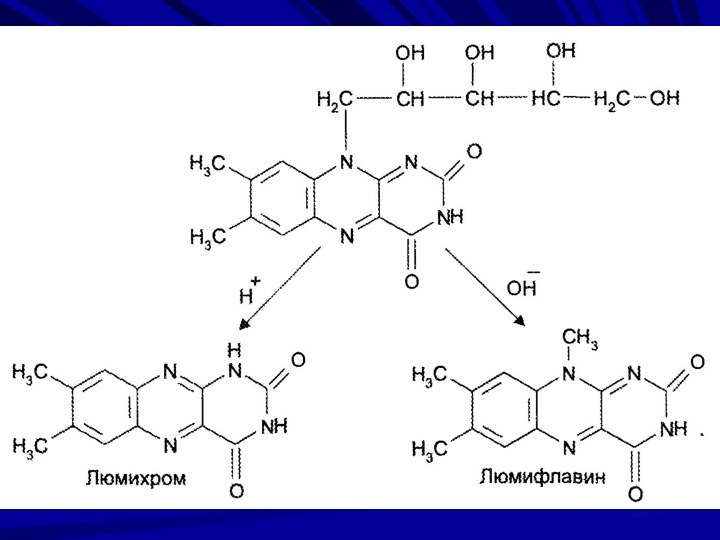
Розчин
субстанції у світлі, що проходить, має блідо-зеленувато-жовте забарвлення, а
у відбитому світлі - інтенсивну жовтувато-зелену флуоресценцію, яка зникає при додаванні мінеральних кислот або лугів (у кислому середовищі на світлі рибофлавін утворює люміхром (6,7-диметилалоксазин)- безбарвну речовину, яка розкладається в етанолі і хлороформі з виникненням блакитної флуоресценції; у лужному середовищі на світлі рибофлавін утворює люміфлавін (6,7,9-триметилізоалоксазин), який в розчинах має забарвлення і флуоресценцію аналогічно рибофлавіну, але розчиняються у хлороформі).
Слайд 32
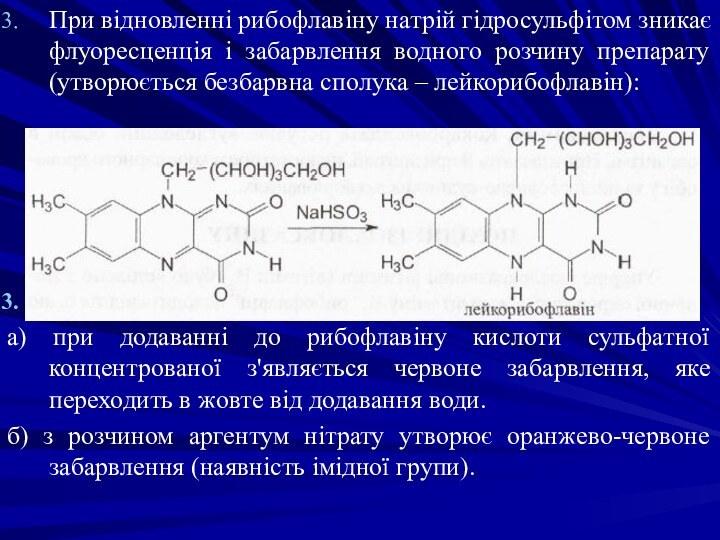
При відновленні рибофлавіну натрій гідросульфітом зникає флуоресценція і
забарвлення водного розчину препарату (утворюється безбарвна сполука – лейкорибофлавін):
Нефармакопейні
реакції:
а) при додаванні до рибофлавіну кислоти сульфатної концентрованої з'являється червоне забарвлення, яке переходить в жовте від додавання води.
б) з розчином аргентум нітрату утворює оранжево-червоне забарвлення (наявність імідної групи).
Слайд 33
Визначають люміфлавін, який утворюється внаслідок змін у хімічній
будові речовини під дією світла і лужного середовища.
Визначення домішки
люміфлавіну ґрунтується на розчинності його в хлороформі (рибофлавін у хлороформі нерозчинний) - забарвлення фільтрату не повинно перевищувати еталон (ДФУ).
Визначення домішки люміфлавіну проводять методом тонкошарової хроматографії (ДФУ, доповнення).
Зберігання рибофлавіну
У ЩЗК, у захищеному від дії світла місці.
Випробування на чистоту
Слайд 34
Кількісне визначення рибофлавіну
УФ-спектрофотометрія (ДФУ). Визначення оптичної густини проводять
при ослабленому світлі, у водному розчині, підкисленому ацетатною кислотою,
при λ=444 нм. Вміст рибофлавіну обчислюють, використовуючи питомий показник поглинання, що дорівнює 328.
Фотоколориметрія.
Флуориметрія.
Алкаліметрія за замісником після взаємодії з розчином аргентуму нітрату. Е = М.м.
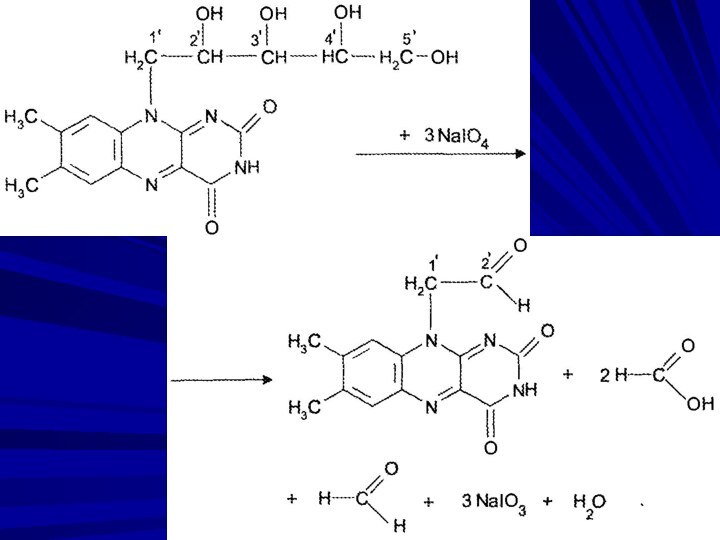
Перйодатне окиснення (реакція Малапрада). Методика базується на окисненні рибітильного фрагмента молекули рибофлавіну з утворенням форміатної кислоти.
Слайд 36
Форміатну кислоту,
що виділилася в результаті реакції, відтитровують алкаліметричним методом:
НСООН +
NaOH → НСООNa + Н2О
За іншою методикою після дії перйодатом до розчину додають натрій йодид і кислоту сульфатну:
5 NaI + NaIO3 + 3 H2SO4 → 3 I2 + 3 Na2SO4 + 3 H2O
Йод, що виділився в результаті реакції відтитровують стандартним розчином натрій тіосульфату.
Естерифіфкація концентрованою сульфатною кислотою. За рахунок гідроксильних груп утворюються моно-, ди-, три-, тетрасульфоксилові естери. Потім потенціометричним титруванням розчином КОН визначають надлишок сульфатної кислоти. Реакція протікає стехіометрично у співвідношенні 1 : 3.
Слайд 37
Застосування рибофлавіну
Відіграє важливу фізіологічну роль, бо входить до
складу оксидаційних ферментів клітин у вигляді рибофлавін-фосфатного естеру. Денна
потреба – 2 мг. Гіпорибофлавіноз характеризується погіршенням апетиту, схудненням, виразками в кутиках рота; арибофлавіноз – кон’юнктивіти, помутніння рогівки і кришталика ока тощо.
Вітамін В2 застосовують орально в дозах по 5-10 мг на день (залежно від ступеня захворювання) при арибофлавінозі, кон’юнктивітах, іритах, кератитах, променевій хворобі, спру.
Випуск: табл. по 0,002 г; 0,005 г; 0,01 г; 0,01% очні краплі; входить до складу рибофлавінмононуклеотиду (рибофлавін-5’-монофосфат натрію) – амп. 1%-1,0 №10.
Слайд 38
Похідні корину
Коринові вітаміни (групи В12) було виявлено в
природних продуктах тваринного походження, головним чином у внутрішніх органах.
Так, найбагатшим джерелом вітаміну В12 є нутрощі риб, високий його вміст у печінці кита і ще більший у м'ясі молюсків. В організмі людини і тварин В12 синтезується мікрофлорою кишковика і накопичується в печінці, нирках, стінках кишковика.
Вітамін В12 (ціанокобаламін) добувають з відходів при виробництві антибіотиків стрептоміцину і хлортетрацикліну. Інше джерело – стічні води (продукти життєдіяльності актиноміцетів, бактерій, синьо-зелених водоростей), звідки вітамін В12 виділяють адсорбцією або екстракцією.
Слайд 39
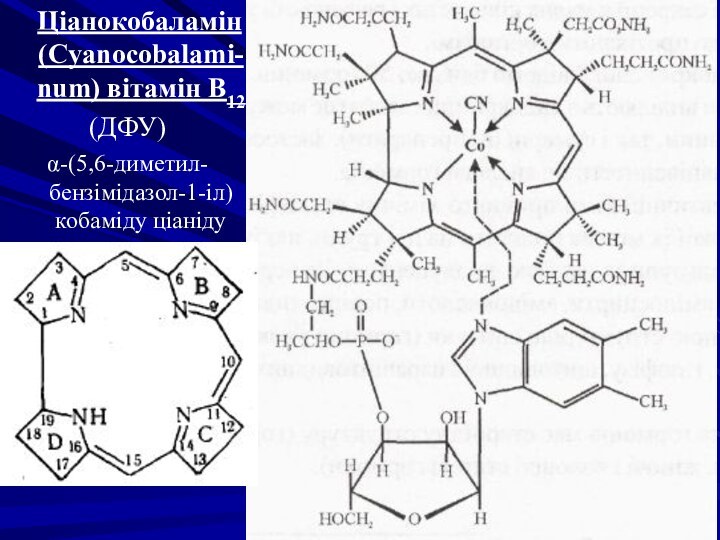
Ціанокобаламін (Cyanocobalami-num) вітамін В12
(ДФУ)
α-(5,6-диметил-бензімідазол-1-іл)кобаміду ціаніду
Корин
Слайд 40
Молекула ціанокобаламіну складається з двох основних частин. Перша
- нуклеотид, що містить 5,6-диметилбензімідазол, зв'язаний з D-рибофуранозою, яка,
у свою чергу, зв'язана ефірним зв'язком з кислотою фосфатною. Нуклеотид з'єднаний з макроциклічною кориновою системою (друга частина) пептидним зв'язком. Атом азоту 5,6-диметилбензімідазолу в положенні 3 зв'язаний координаційним зв'язком з атомом кобальту. Кобальт утворює хелатну сполуку з ціаногрупою і з атомами нітрогену гідрованих пірольних циклів коринової системи.
Позитивний заряд іона кобальту нейтралізується негативно зарядженим аніоном фосфатної кислоти. Тому ціанокобаламін є не тільки хелатною сполукою, але і внутрішньою сіллю.
Слайд 41
Властивості ціанокобаламіну
Кристалічний порошок темно-червоного кольору, без запаху, гігроскопічний.
Помірно розчинний у воді, розчинний у 95 %-ному спирті,
практично не розчинний в ефірі, хлороформі, ацетоні. Безводна субстанція дуже гігіроскопічна.
При нагріванні понад 300°С розкладається . Стійкий при рН=4-6. Легко розкладається в лужному середовищі.
Групу СN в молекулі вітаміну В12 можна замінити на групу ОН (оксикобаламін) або NO2 (нітрокобаламін). Обидва продукти перетворення належать до групи вітамінів В12.
При нагріванні ціанокобаламіну з розчином НСl утворюється амоній хлорид, 5,6-диметилбензімідазол, аміноізопропанол, кобальт хлорид, ціанідна кислота.
Антианемічна дія пов'язана з наявністю в структурі молекули 5,6-диметилбензімідазолу.
Слайд 42
Ідентифікація ціанокобаламіну
Визначення УФ-спектральних характеристик.
ТШХ.
Іони кобальту визначають після мінералізації
шляхом сплавлення з калій гідросульфатом та взаємодією з натрію
1-нітрозо-2-нафтол-3,6-дисульфонатом - з'являється червоне забарвлення внутрішньо-комплексної солі кобальту.
Слайд 43
Іон кобальту можна також виявити після випарювання і
прокалювання 0,25 мг ціанокобаламіну з 10 мг калій сульфату
і 2 краплями 15 % сульфатної кислоти. До залишку добавляють насичений розчин амоній тіоціанату в ацетоні; з’являється синьо-зелене забарвлення:
Со2+ + 2 NH4SCN → Со(SCN)2 + 2 NH4+
Виявлення ціаногрупи. Наважку ціанокобаламіну нагрівають у пробірці з кислотою оксалатною, під дією якої виділяється кислота ціанідна, яку виявляють за допомогою фільтрувального паперу, змоченого розчином бензидину і купрум(ІІ) ацетатом, в результаті чого утворюється забарвлена в синій колір комплексна сполука.
Слайд 44
Кількісне визначення
Метод УФ-спектрофотометрії.
Зберігання
У ЩЗК, у захищеному від світла
місці.
Застосування ціанокобаламіну
Вітамін В12 є фактором росту, необхідним для нормального
кровотворення і дозрівання еритроцитів. Він бере участь в утворенні холіну, метіоніну, нуклеїнових кислот, виявляє сприятливий вплив на функції печінки і нервової системи.
Денна потреба здорової людини – 10-20 мкг. Така кількість вітаміну не утворюється в кишківнику і її треба доповнювати продуктами тваринного походження.
Застосовують при злоякісному недокрів'ї, різноманітних видах анемій, захворюваннях печінки, нервової системи, захворюваннях шкіри та ін.
Випуск: р-н д/ін. 200 мкг (0,02%) або 500 мкг (0,05%) 1,0 №10
Слайд 45
Полівітамінні лікарські препарати
В природі вітаміни зустрічаються звичайно
у вигляді різних поєднань. Рослинні продукти часто містять вітаміни
групи В, вітамін С та ін. Поєднання вітамінів знаходиться також і в продуктах тваринного походження.
В багатьох випадках вітаміни взаємно підсилюють фізіологічні ефекти, які вони виявляють. Наприклад, вплив вітаміну Р на проникність судин підсилюється аскорбіновою кислотою; взаємно підсилюється вплив на кровотворення фолієвої кислоти та ціанокобаламіну.
В деяких випадках токсичність вітамінів зменшується при їх комбінованому застосуванні. Наприклад, токсичність вітаміну D зменшується під впливом вітаміну А. Вітаміни можуть виявляти і антагоністичну дію (нікотинова кислота сповільнює ліпотропну дію холіну).
Активно беручи участь в різних біохімічних процесах, вітаміни при їх поєднанні виявляють сильнішу і комплексну біологічну дію, що і послужило для їх комбінованого застосування як з профілактичною так і з лікувальною метою.
Слайд 46
Полівітамінні лікарські препарати є різного складу (одні вітаміни
і в поєднанні з мікроелементами) та випускаються у вигляді
різних лікарських форм: таблеток, “шипучих” таблеток (упсавіт, супрадин), таблеток для розжовування (мульти-табс, джунглі), драже (ревіт), сиропів (кідді, мультивітамол), гелів (кіндер-біовіталь), розчинів для ін'єкцій (нервіплекс (В1, В6, В12)).
Вітчизняні полівітамінні препарати: ревіт (А, В1, В2, С), гексавіт (ревіт + В6, РР), ундевіт (гексавіт + Е, Р, Вс, В3), декамевіт (А, В1, В2, В6, В12, РР, С, Е, Р, Вс, метионін), комплевіт (В1, В2, В6, В12, РР, С, Е, Вс), квадевіт (декамевіт + В3, кислота глутамінова, фітин, KCl. CuSO4), вітам (В1, В2, В6, РР, В3, мефенамова кислота, Fe, Zn, Mn, Cu, Co, Cr).
Полівітамінні препарати, іноземного виробництва: вітруми (кідс, юніор, б’юті, пренатал, енерджі, кардіо та ін.), центруми, мульти-табси, дуовіт, піковіт, джунглі, юнікап, прегнавіт, оліговіт, теравіт, супрадин, кіндер-біовіталь та ін.


![Вітаміни гетероциклічного ряду: піримідинотіазолу, птерину, ізоаллоксазину, корину. Властивості, вимоги до якості Препарати вітамінів групи В1Тіаміну гідробромід (Thiamini hydrobromidum) (ДФУ) 3-[(4-Аміно-2-метил- піримідин-5-іл)метил]-5-(2-гідроксіетил)-4-метилтіазолій](/img/tmb/15/1458822/6f46c1054da0bf4ee15bb3a4a9da1901-720x.jpg)











![Вітаміни гетероциклічного ряду: піримідинотіазолу, птерину, ізоаллоксазину, корину. Властивості, вимоги до якості Кислота фолієва (Acidum folicum), вітамін Вс (ДФУ)(2S)-2-[[4-[[(2-Аміно-4-окси-птеридин-6-іл)метил]аміно]бензоїл]аміно]пентандіонова кислота Назва вітаміну](/img/tmb/15/1458822/d05cb306e3e914f59540a46ec6d3407f-720x.jpg)






![Вітаміни гетероциклічного ряду: піримідинотіазолу, птерину, ізоаллоксазину, корину. Властивості, вимоги до якості Рибофлавін (Riboflavinum) вітамін В2 (ДФУ) 7,8-Диметил-10-[(2S,3S,4R)-2,3,4,5-тетрагідрокси-пентил] бензо[g]птеридин-2,4(ЗH,10H)-діон, або 6,7-диметил-9-(1’-D-рибітил)-ізоалоксазинУперше ізоалоксазинові](/img/tmb/15/1458822/652bc998e3a92ec6627897a4d36f772c-720x.jpg)