- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Доклад на тему Доброкачественные новообразования пищевода.
Содержание
- 2. Доклад на тему «Доброкачественные новообразования пищевода. Подготовил студент 6-ого курса Лысенко Андрей
- 3. Доброкачественные новообразования пищевода редкая патология (около 0,5-5%)
- 4. Гистологически доброкачественные опухоли пищевода делят на:Nemir’s классификация включает эпителиальные, неэпителиальные и гетеротопические опухоли
- 5. По характеру роста доброкачественные опухоли делят на:1.
- 6. Клиника:Часто безсимптомно и обнаруживают случайноВ клинически выраженных
- 7. Диагностика«Золотым» стандартом диагностики доброкачественных опухолей пищевода является
- 8. При рентген-контрастном исследовании выделяют следующие признаки: 1.
- 9. Компьютерная томография пищевода и средостенияПозволяет выяснить соотношение
- 10. Лечение доброкачественных опухолейОПЕРАТИВНОЕ. Лекарственное неэффективно!Применяют основных пять
- 11. Метод удаления зависит от размера и гистологического
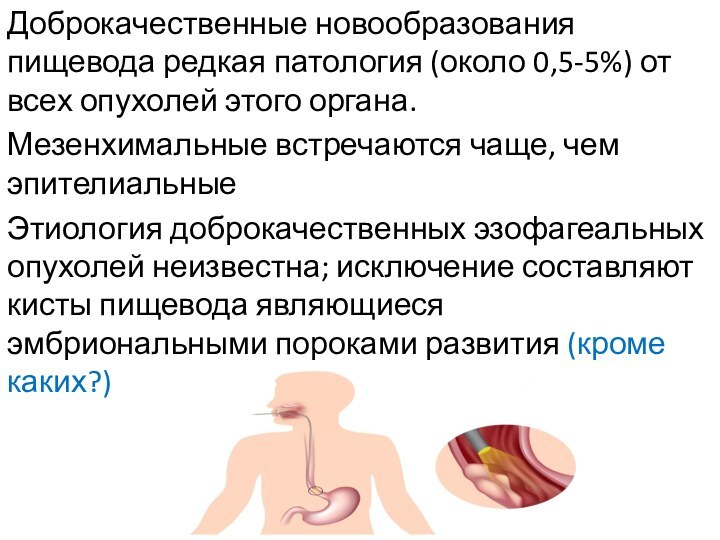
- 12. Иссечение опухоли с участком стенки пищевода применяют
- 13. 1, 2 — энуклеация опухоли; 3, 4, 5 — иссечение с участком стенки.
- 16. Лейомиомы По частоте составляет 50—95% всех доброкачественных
- 17. Солитарные лейомиомы Округлые образования различных размеров, с
- 20. Лечение лейомиомВ последние годы осуществляется с применением
- 21. При открытой хирургической энуклеации опухоли классически выполняют
- 22. Алгоритмы лечения лейомиом (2015)1. Ramos Diego, Priego
- 24. Фиброма и липома пищевода Фиброма развивается в
- 25. Аденомы и полипы Могут располагаться в любом
- 26. Гиперпластический полип пищевода Характеризуется наличием смешанных воспалительных инфильтратов
- 27. Гиперпластический полип
- 28. Гиперпластический полип лечениеЛечение гиперпластических полипов схоже с
- 29. Папилломы Приобретенные папилломы развиваются на фоне хронического
- 30. Этиологические теории папилломы Этиология до конца не
- 32. Гранулярно-клеточная опухоль2-ая по частоте среди неэпителиальных опухолей
- 33. Наиболее распространенной теорией является неврогенное происхождение опухоли
- 34. Fanburg-Smith et al. предложили 6 гистологических критериев
- 35. Nasser et al. предложили более простые и
- 36. Эндоскопическую резекцию при гранулярно-клеточных опухолях рекомендуют в
- 37. Гранулярно-клеточная опухоль пищевода
- 38. ГемангиомаРаспространенность гемангиом пищевода около 0,04% на основе
- 40. Кисты пищевода По происхождению делят на: 1)
- 41. Причиной образования приобретенных (ретенционных) кист является закупорка
- 42. Врожденные кисты формируются из остатков зародышевого эпителия.
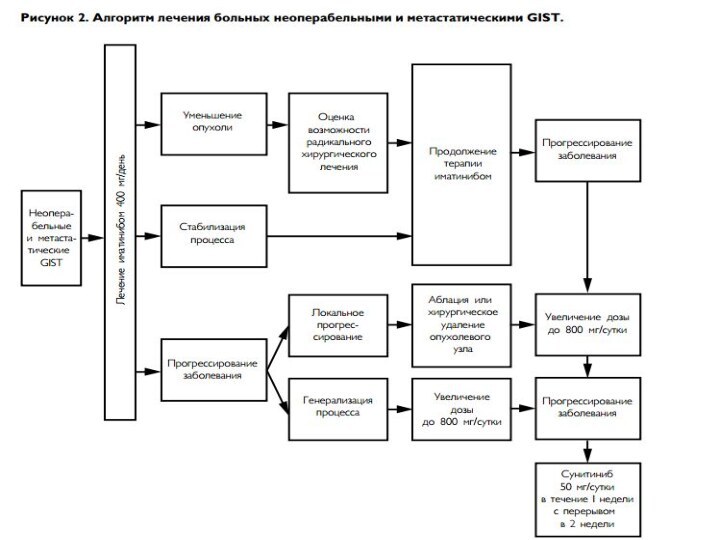
- 43. Гастроинтестинальные стромальные опухоли (ГИСО)Локализация в пищеводе крайне
- 44. С внедрением тонкоигольных пункций возможности диагностики НЭО
- 46. Стадирование ГИСОДолжна быть использована система TNM с
- 50. Скачать презентацию
- 51. Похожие презентации
Доклад на тему «Доброкачественные новообразования пищевода. Подготовил студент 6-ого курса Лысенко Андрей























![Доклад на тему Доброкачественные новообразования пищевода. Fanburg-Smith et al. предложили 6 гистологических критериев злокачественности гранул.-клет. опухолей[1]: увеличение ядерно-цитоплазматического](/img/tmb/14/1338982/5eec7820e304e6f088cdb402e628bc7e-720x.jpg)





![Доклад на тему Доброкачественные новообразования пищевода. Гастроинтестинальные стромальные опухоли (ГИСО)Локализация в пищеводе крайне редка (< 1%). [1]Согласно рекомендациям](/img/tmb/14/1338982/056cf37a9e032c4bf5813953ab8865f5-720x.jpg)



Слайд 2
Доклад на тему «Доброкачественные новообразования пищевода.
Подготовил студент
6-ого курса Лысенко Андрей
Слайд 3 Доброкачественные новообразования пищевода редкая патология (около 0,5-5%) от
всех опухолей этого органа.
Мезенхимальные встречаются чаще, чем эпителиальные
Этиология доброкачественных
эзофагеальных опухолей неизвестна; исключение составляют кисты пищевода являющиеся эмбриональными пороками развития (кроме каких?)
Слайд 4
Гистологически доброкачественные опухоли пищевода делят на:
Nemir’s классификация включает
эпителиальные, неэпителиальные и гетеротопические опухоли
Слайд 5
По характеру роста доброкачественные опухоли делят на:
1. На
внутристеночные (эндофитные, интрамуральные) - лейомиомы, кисты, сосудистые опухоли. Обычно
локализуются в средней и нижней трети пищевода2. Внутрипросветные (экзофитные) — фибромы, липомы, аденомы, папилломы. Растут на ножке или на широком основании. Обычно локализуются в начальном и терминальном отделах пищевода
Слайд 6
Клиника:
Часто безсимптомно и обнаруживают случайно
В клинически выраженных случаях
основными симптомами являются дисфагия, боли за грудиной или в
эпигастральной области, диспепсические явления , респираторные нарушения (кашель, одышка, боли в области сердца, частые воспалительные заболевания бронхов и легких)Клиника пищеводного кровотечения разной интенсивности (при гемангиомах и полипах);
Сдавление органов средостения растущей опухолью с возникновением сердцебиения, болей в сердце и одышки (редко)
Слайд 7
Диагностика
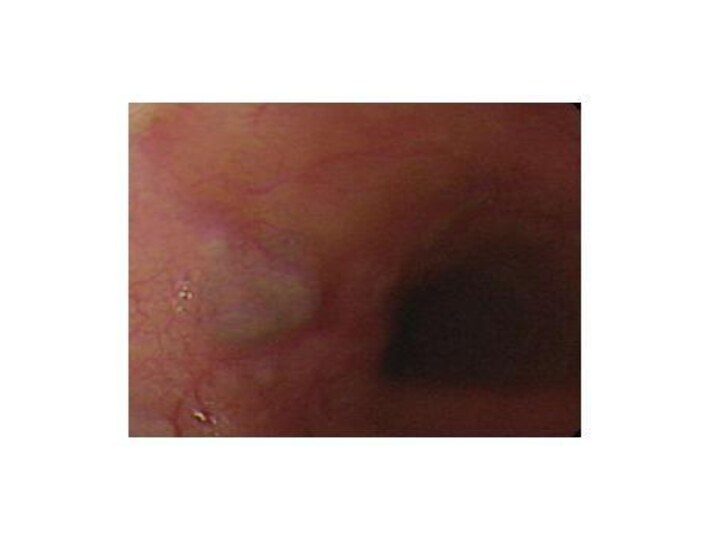
«Золотым» стандартом диагностики доброкачественных опухолей пищевода является ЭФГДС.
При исследовании слизистая оболочка над опухолью при захвате щипцами
легко смещается (симптом шатра)
Слайд 8
При рентген-контрастном исследовании выделяют следующие признаки:
1. ровные
и четкие контуры;
2. округлая или овальная форма;
3. сохраненный
рельеф слизистой оболочки с симптомом «обтекания»;4. эластичность стенок пищевода в области опухоли;
5. отчетливая демаркация (граница) между опухолью и нормальной стенкой пищевода.
Диагностика
Слайд 9
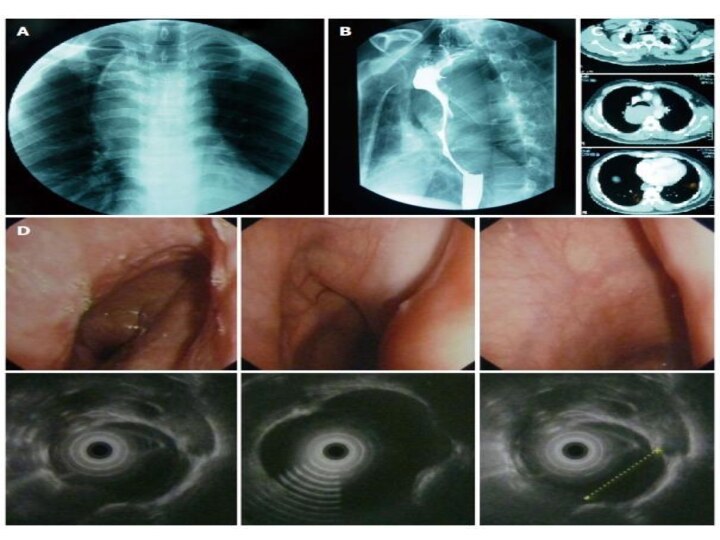
Компьютерная томография пищевода и средостения
Позволяет выяснить соотношение опухоли
со стенкой пищевода и окружающими органами средостения, состояние лимфатических
узлов средостения, что особенно важно при подозрениии на злокачественный процесс.Диагностика
Слайд 10
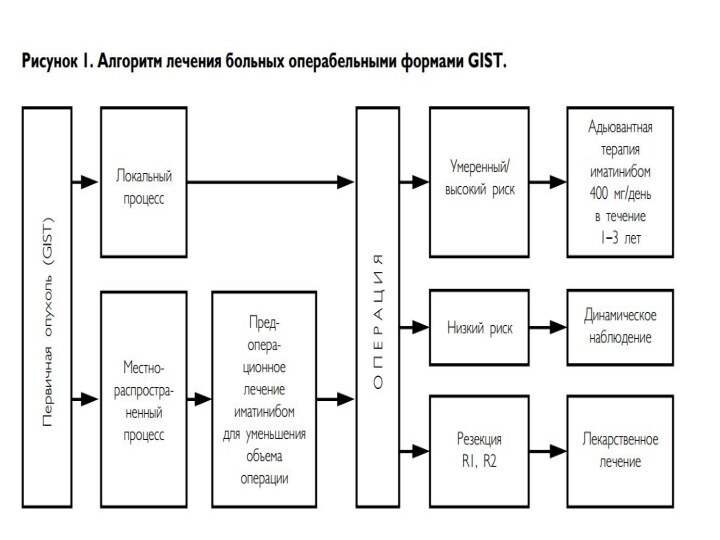
Лечение доброкачественных опухолей
ОПЕРАТИВНОЕ. Лекарственное неэффективно!
Применяют основных пять видов
операций:
1) удаление опухоли через рот;
2) эндоскопическое удаление
опухоли; 3) энуклеацию опухоли;
4) иссечение опухоли с участком стенки пищевода;
5) резекцию пищевода.
Слайд 11 Метод удаления зависит от размера и гистологического типа
опухоли.
Внутрипросветные опухоли на ножке удаляются эндоскопически с применением диатермокоагуляции
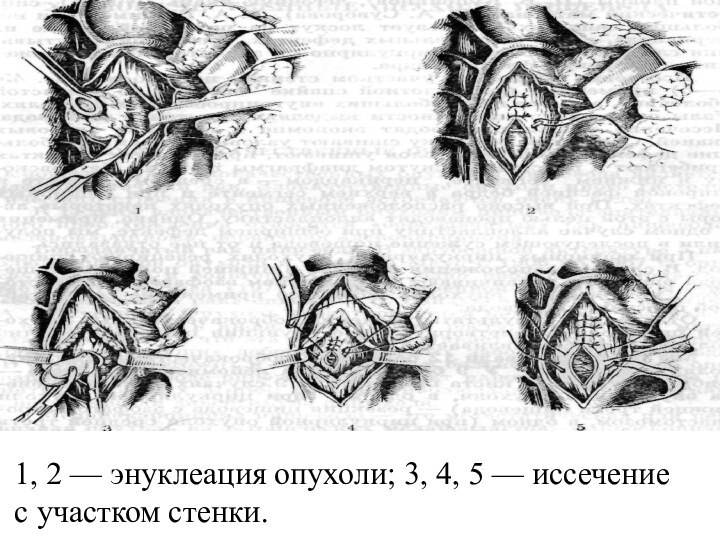
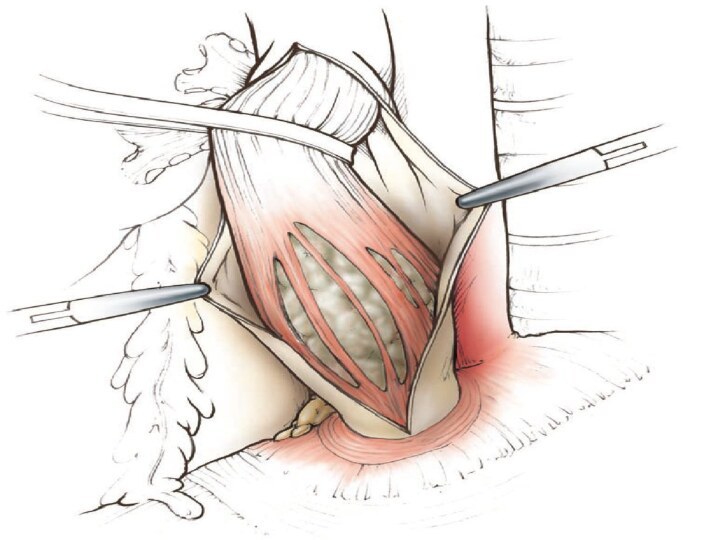
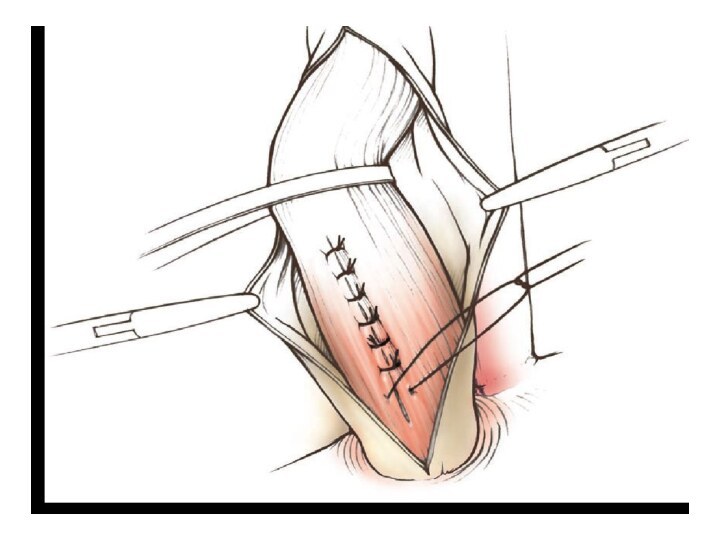
(с петлей). Основным принципом оперативного лечения доброкачественных интрамуральных опухолей является органосохраняющий - вылущивание опухоли без вскрытия слизистой оболочки с последующим ушиванием мышечного слоя отдельными швами. Доступы: заднебоковая торакотомия или видеоассистируемая торакоскопии.
Лечение доброкачественных опухолей
Слайд 12 Иссечение опухоли с участком стенки пищевода применяют при
плотной спайке опухоли со слизистой оболочкой.
Узлы опухоли выделяют
из стенки пищевода. Иссечение стенки производят в пределах здоровых тканей. Слизистую оболочку сшивают узловыми швами.В случае расположения опухоли в нижней половине пищевода операцию заканчивают наложением эзофагогастроанастомоза; при высоких опухолях возможно применение сегментарной пластики пищевода.
Слайд 16
Лейомиомы
По частоте составляет 50—95% всех доброкачественных опухолей
пищевода;
Чаще бывает у мужчин;
Макроскопически: плотная опухоль, покрытая соединительнотканной капсулой;
Выделяют
4 вида - солитарная, узловато-множественная, распространенный и диффузный лейомиоматоз.Микроскопически состоит из гладких мышечных волокон различной толщины, расположенных беспорядочно в виде завихрений.
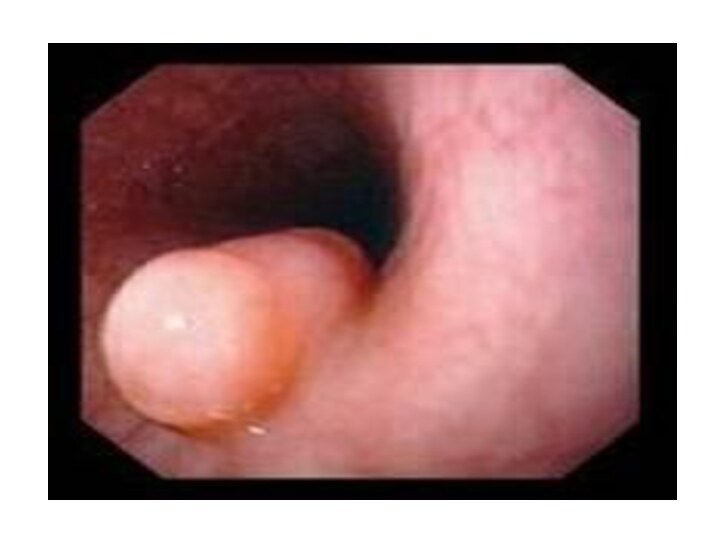
Слайд 17
Солитарные лейомиомы
Округлые образования различных размеров, с ровной поверхностью.
Четко
отграниченные от окружающих тканей.
Плотноэластическая, обычно гомогенная, белого, серого
или желтоватого цвета. Слизистая оболочка пищевода остается интактной, но при поражении циркулярного мышечного слоя могут наблюдаться ее изъязвление.
При больших опухолях наступает выраженное истончение мышечного слоя.
Чаще развиваются в нижней трети пищевода, который имеет гладкую мускулатуру
Слайд 20
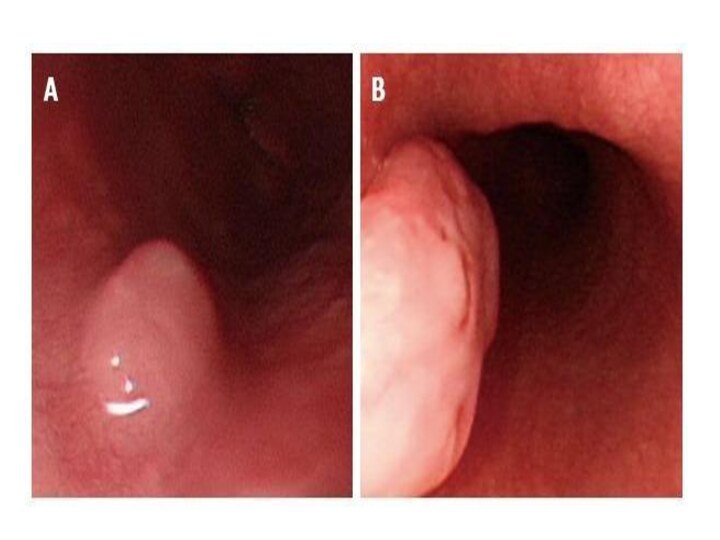
Лечение лейомиом
В последние годы осуществляется с применением малоинвазивных
вмешательств - видеоторакоскопии с миниторакотомным доступом длиной 3 см,
лапароскопии, лапароскопии с использованием «руки помощи», трансхиатально. Преимущественно производится видеоторакоскопическая энуклеация лейомиомы.Все шире применяется эндоскопическая энуклеация опухоли [1] и подслизистая туннельная эндоскопическая резекция [2].
Прогноз после хирургического лечения, как правило, благоприятный и рецидивов не наблюдается.
30. Guo J, Liu Z, Sun S, Liu X, Wang S, Ge N. Ligation-assisted endoscopic enucleation for treatment of esophageal subepithelial lesions originating from the muscularis propria: a preliminary study. Dis Esophagus. 2014:Epub ahead of print.
31. Ye LP, Zhang Y, Mao XL, Zhu LH, Zhou X, Chen JY. Submucosal tunneling endoscopic resection for small upper gastrointestinal subepithelial tumors originating from the muscularis propria layer. Surg Endosc. 2014;28:524–530.
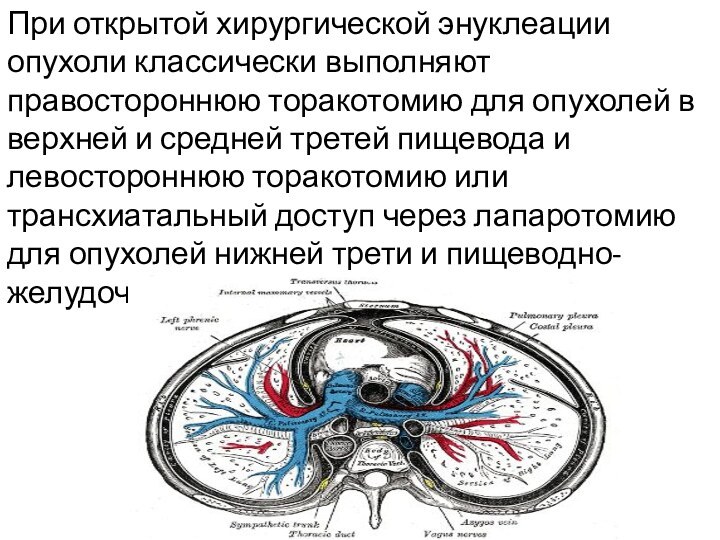
Слайд 21 При открытой хирургической энуклеации опухоли классически выполняют правостороннюю
торакотомию для опухолей в верхней и средней третей пищевода
и левостороннюю торакотомию или трансхиатальный доступ через лапаротомию для опухолей нижней трети и пищеводно-желудочного перехода
Слайд 22
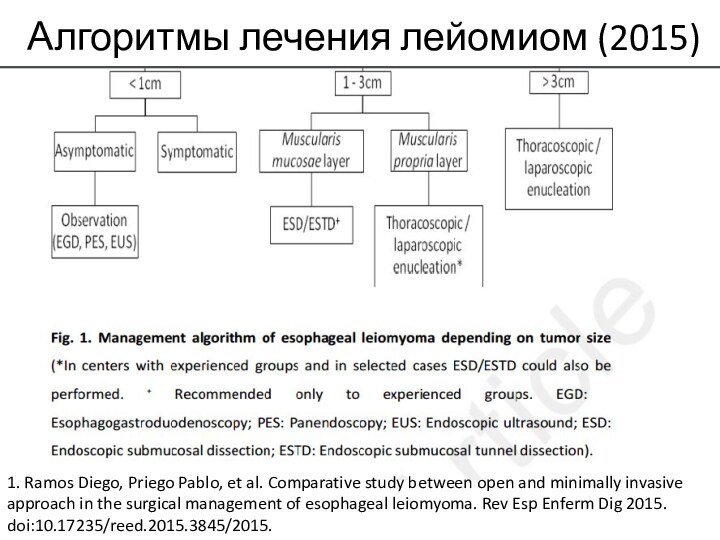
Алгоритмы лечения лейомиом (2015)
1. Ramos Diego, Priego Pablo,
et al. Comparative study between open and minimally invasive
approach in the surgical management of esophageal leiomyoma. Rev Esp Enferm Dig 2015. doi:10.17235/reed.2015.3845/2015.
Слайд 24
Фиброма и липома пищевода
Фиброма развивается в подслизистом слое
и имеет признаки интрамуральной опухоли. В последующем может образовываться
ножка, достигающая длины всего пищевода - от входа до кардии. Поверхность опухоли может изъязвляться под действием механических факторов.Липома также располагается в подслизистом слое. Иногда на ножке. Состоят из жировой ткани со слабо выраженной стромой и дольчатостью. Характеризуются доброкачественным течением, медленным ростом, редко достигают больших размеров, не озлокачествляются.
Метод лечения: хирургический (энуклеация).
Слайд 25
Аденомы и полипы
Могут располагаться в любом участке
пищевода (чаще в шейном или абдоминальном отделе) Могут расти
на широком основании или длинной ножке.При эндоскопии красноватые, четко отграниченные от стенок пищевода, иногда с дольчатым строением.
Легко кровоточат при контакте.
Внутрипросветные полипы могут быть удалены эндоскопически (с применением термоабляции, лазерной или аргоноплазменной коагуляции)
Если полип достигает больших размеров –резекция участка пищевода.
Слайд 26
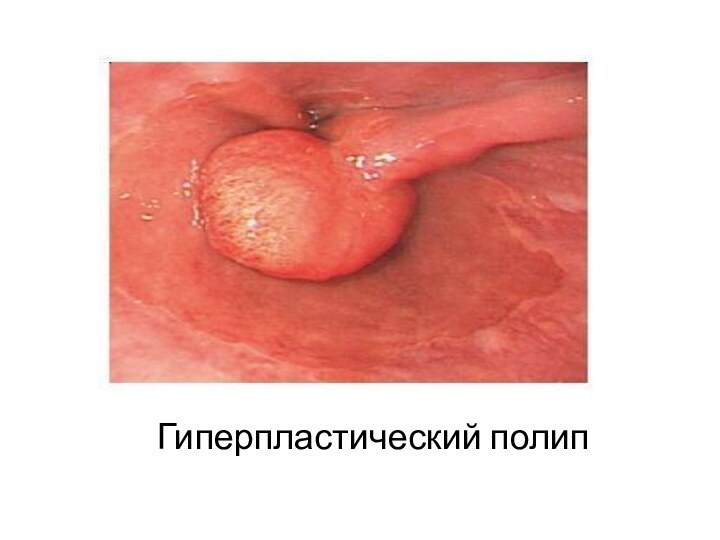
Гиперпластический полип пищевода
Характеризуется наличием смешанных воспалительных инфильтратов включающих
плазматические клетки, эозинофилы, фибробласты и воспаленную строму.
Они ассоциированы
с эрозивным гастритом в большинстве случаев.Однако есть и другие потенциальные этиологии, включающие лекарственно-индуцированный эзофагит, инфекции и полипэктомии или анастомозирование пищевода в анамнезе [1].
Результаты исследований показывают что в патогенезе образования участвует регенеративный ответ слизистой на ее повреждение [2].
1. Abraham SC, Singh VK, Yardley JH, Wu TT. Hyperplastic polyps of the esophagus and esophagogastric junction: histologic and clinicopathologic findings.Am J Surg Pathol. 2001;25:1180–1187.
2 Chang WH, Shih SC, Wang HY, Chang CW, Chen CJ, Chen MJ. Acquired hyperplastic gastric polyps after treatment of ulcer. J Formos Med Assoc.2010;109:567–573
Слайд 28
Гиперпластический полип лечение
Лечение гиперпластических полипов схоже с тактикой
при ГЭРБ. В исследованиях показан регресс ГП после проведенной
антисекреторной терапии ингибиторами протонной помпы.Необходим обязательный контроль слизистой без полипов для оценки ее клинико-патологического состояния. Если ГП обнаружен на фоне пищевода Баррета – рекомендована эндоскопическая слизистая резекция [1]
1. De Ceglie A, Lapertosa G, Blanchi S, Di Muzio M, Picasso M, Filiberti R, Scotto F, Conio M. Endoscopic mucosal resection of large hyperplastic polyps in 3 patients with Barrett’s esophagus. World J Gastroenterol. 2006;12:5699–5704.
Слайд 29
Папилломы
Приобретенные папилломы развиваются на фоне хронического эзофагита. Это
единичные или множественные образования на слизистой оболочке пищевода, растущие
на ножке или широком основании. Имеют ровные или бугристые контуры с различным рельефом - сосочковым, бородавчатым, шагреневым. Обычно внешне напоминают цветную капусту, беловато-розоватого цвета. Гистологически гиперпластическое разрастание покровного эпителия и подлежащей соединительной ткани. Имеют высокий индекс малигнизации!!!
Слайд 30
Этиологические теории папилломы
Этиология до конца не выяснена,
но существуют 2 гипотезы:
1. Хроническое раздражение (травма) слизистой;
2. Наличие папилломавирусной инфекции у человека. Гипотеза хронического воспаления (например при ГЭРБ) базируется на высокой частоте возникновения папиллом пищевода в нижней трети.
Poljak M, Orlowska J, Cerar A. Human papillomavirus infection in esophageal squamous cell papillomas: a study of 29 lesions. Anticancer Res. 1995;15:965–969.
Слайд 32
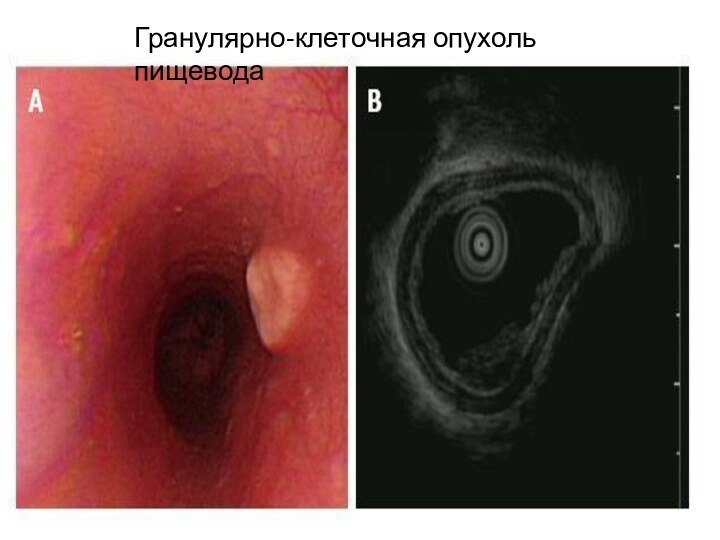
Гранулярно-клеточная опухоль
2-ая по частоте среди неэпителиальных опухолей пищевода
Протекает
зачастую безсимптомно.
При этом 1-3% малигнизируется и 5-летняя выживаемость =
< 35%. Микроскопические состоит из скоплений яйцевидных или полигональных клеток, разделенные коллагеновыми волокнами. Злокачественный потенциал высокий при наличии некрозов, увеличении митозов, увеличения ядрышек и высокий индекс Ki67.Резекция является основным лечением гранулярно-клеточной опухоли. Эндоскопическая слизистая резекция и эндоскопическая подслизистая диссекция является операциями выбора при опухолях в пределах субэпителиального или подслизистого слоя.
1. Fanburg-Smith JC, Meis-Kindblom JM, Fante R, Kindblom LG. Malignant granular cell tumor of soft tissue: diagnostic criteria and clinicopathologic correlation.Am J Surg Pathol. 1998;22:779–794.
Слайд 33 Наиболее распространенной теорией является неврогенное происхождение опухоли из
Шванновских клеток, которые являются частью подслизистого нервного сплетения пищевода
[1]. Хотя большинство гранулярно-клеточных опухолей являются доброкачественными, тем не менее некоторые опухоли имеют высокий риск малигнизации. Предложенные Fanburg-Smith критерии злокачественности являются очень спорными среди патологоанатомов, и единственным неоспоримым критерием считают наличие метастазов [2].1.Radaelli F, Minoli G. Granular Cell Tumors of the Gastrointestinal Tract: Questions and Answers. Gastroenterol Hepatol. 2009;5:798–800.
2. Nasser H, Danforth RD, Sunbuli M, Dimitrijevic O. Malignant granular cell tumor: case report with a novel karyotype and review of the literature. Ann Diagn Pathol. 2010;14:273–278.
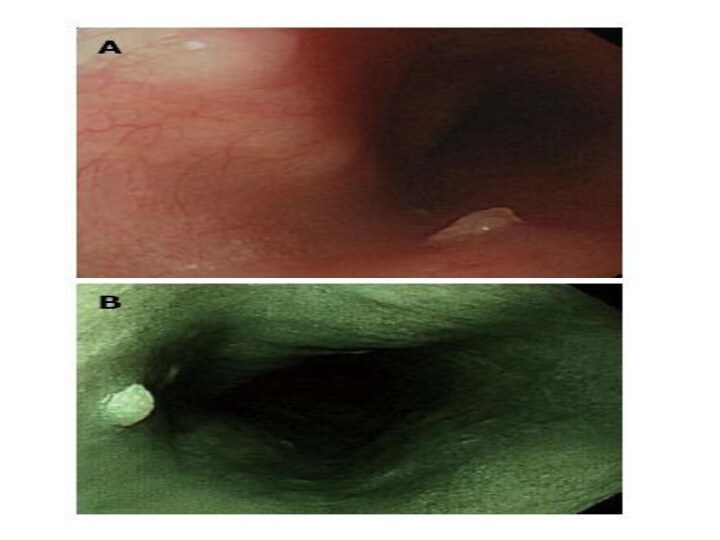
Слайд 34 Fanburg-Smith et al. предложили 6 гистологических критериев злокачественности
гранул.-клет. опухолей[1]: увеличение ядерно-цитоплазматического соотношения, полиморфизм ядер, некрозы, уменьшение
опухолевых клеток, везикулярные ядра с выраженными(выпуклыми) ядрышками и количество митозов больше 2 в 10 полях зрения. Они поделили гранулярно-клеточные опухоли на 3 группы:1. Доброкачественные (нет критериев или фокальный плейоморфизм)
2. Атипичные (1-2 критерия)
3. Злокачественные (3-6 критериев)
Fanburg-Smith JC, Meis-Kindblom JM, Fante R, Kindblom LG. Malignant granular cell tumor of soft tissue: diagnostic criteria and clinicopathologic correlation.Am J Surg Pathol. 1998;22:779–794.
Слайд 35 Nasser et al. предложили более простые и практичные
диагностические критерии. Они базируются на наличии некрозов (в одиночных
клетках или зоне) и/или митозы (согласно Fanburg-Smith критериям). Если нет ни одного из критериев то опухоль обозначают как доброкачественную. Если есть хоть один из критериев – опухоль с неопределенным потенциалом злокачественности. Они считали метастазы единственным знаменателем, демонстрирующим злокачественные опухолиNasser H, Ahmed Y, Szpunar SM, Kowalski PJ. Malignant granular cell tumor: a look into the diagnostic criteria. Pathol Res Pract. 2011;207:164–168
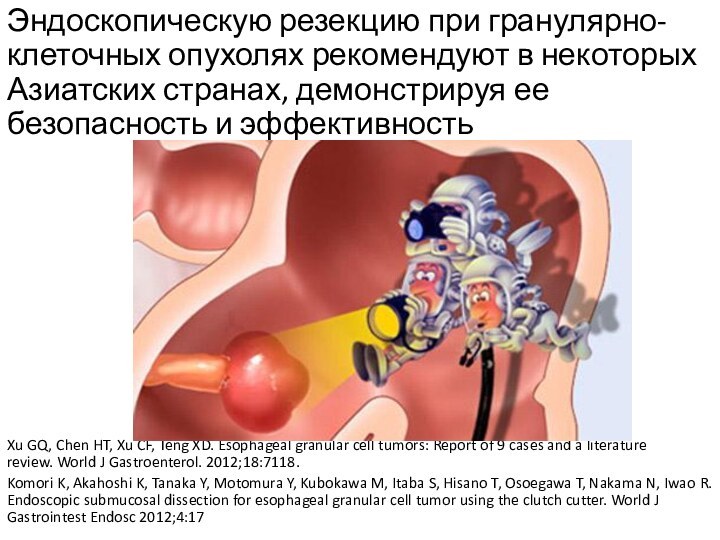
Слайд 36 Эндоскопическую резекцию при гранулярно-клеточных опухолях рекомендуют в некоторых
Азиатских странах, демонстрируя ее безопасность и эффективность
Xu GQ, Chen
HT, Xu CF, Teng XD. Esophageal granular cell tumors: Report of 9 cases and a literature review. World J Gastroenterol. 2012;18:7118.Komori K, Akahoshi K, Tanaka Y, Motomura Y, Kubokawa M, Itaba S, Hisano T, Osoegawa T, Nakama N, Iwao R. Endoscopic submucosal dissection for esophageal granular cell tumor using the clutch cutter. World J Gastrointest Endosc 2012;4:17
Слайд 38
Гемангиома
Распространенность гемангиом пищевода около 0,04% на основе данных
полученных при аутопсиях. Большинство из них являются кавернозными. Как
правило одиночные. Если клинически проявляются – то наиболее часто дебютируют с кровотечения и явлений дисфагии.Стандартов терапии нет ввиду редкости патологии и отсутствии достаточного количества научных публикаций. Часто применяют эндоскопические резекции.
Слайд 40
Кисты пищевода
По происхождению делят на:
1) ретенционные
кисты;
2) кистозный, или фолликулярный эзофагит;
3) редубликационные кисты;
4) кисты, образующиеся из островков желудочной слизистой оболочки;
5) энтерогенные кисты пищевода;
6) бронхогенные кисты пищевода;
7) дермоидные кисты;
8) паразитарные кисты.
Слайд 41 Причиной образования приобретенных (ретенционных) кист является закупорка выводных
протоков истинных желез пищевода вследствие хронического эзофагита или постоянной
микротравматизации слизистой оболочки пищевода.Внутренняя поверхность кисты выстлана эпителием из уплощенных клеток. Наружная поверхность представлена соединительнотканной оболочкой, беспорядочно распластанной в окружающих тканях.
Слайд 42 Врожденные кисты формируются из остатков зародышевого эпителия. Они
могут иметь выстилку дыхательного эпителия (бронхогенные кисты) или желудочно-кишечного
эпителия (энтерогенные кисты).Кисты располагаются в подслизистом слое и заполнены прозрачной тягучей жидкостью, иногда они содержат детрит (асептический распад) или гной. Возможными осложнениями кист могут быть - перфорация, нагноение, кровотечение, трансформация в рак
Слайд 43
Гастроинтестинальные стромальные опухоли (ГИСО)
Локализация в пищеводе крайне редка
(< 1%). [1]
Согласно рекомендациям международного соглашения 2005 г -
диагноз ГИСО должен быть установлен морфологически до начала лечения (хирургического или лекарственного) с обязательным иммунногистохимическим подтверждением.Сложности морфологической верификации до операции в связи с субэпителиальным расположением опухоли
Использование щипковой биопсии, как правило, не дает информации о гистологической структуре опухоли. Проведение расширенной биопсии чревато осложнениями (особенно на фоне кровотечения) или диссеминацией процесса в случае его злокачественной природы
Применение лучевых методов диагностики (транскутанное ультразвуковое исследование, КТ) ограничено из-за сложности визуализации образований малых размеров
1. Miettinen M, Lasota J. Gastrointestinal stromal tumors: pathology and prognosis at different sites. Semin Diagn Pathol. 2006;23:70–83
Слайд 44 С внедрением тонкоигольных пункций возможности диагностики НЭО расширились,
но она позволяет получить материал для гистологического и иммуногистохимического
исследования лишь в 60–80 % случаевВ настоящее время важнейшая роль в диагностике НЭО ЖКТ принадлежит стандартному эндоУЗИ, которое на основе анализа пятислойного строения стенки полого органа позволяет судить о локализации и структуре опухоли. Создание эндоскопов с ультразвуковым датчиком соединяет достоинства эндоскопического и ультразвукового методов.
Окончательный диагноз ГИСО может быть поставлен лишь на основании иммуногистохимического исследования
Слайд 46
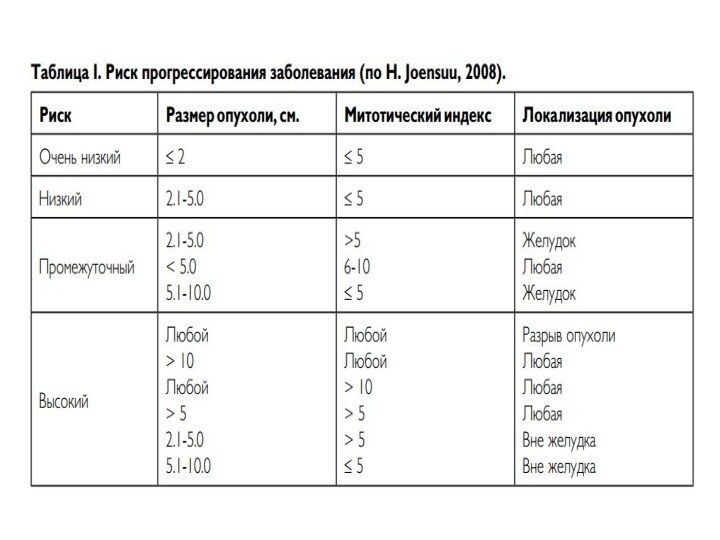
Стадирование ГИСО
Должна быть использована система TNM с последующей
группировкой по стадиям (7-е издание, 2010 г.).
В заключительном
гистологическом заключении указываются: • размер опухоли;
• локализация;
• морфологический вид;
• митотический индекс (количество митозов в 50 полях зрения при большом увеличении).
Иммуногистохимическое исследование опухоли с определением экспрессии CD 117 и/или DOG1 является необходимым при подтверждении диагноза





























