- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Обмен белков
Содержание
- 2. Обмен белков Белки, поступающие с пищей,
- 3. В желудке, в результате ферментативного гидролиза, происходит
- 4. Белки, в отличие от жиров и углеводов,
- 5. Чрезмерное потребление белков вызывает усиленную работу пищеварительного
- 6. В основе существования всех живых систем лежит
- 7. Синтез белкаСинтез белка (трансляция) является самым сложным
- 8. В пятидесятых годах XX века было установлено, что
- 9. Синтез белка
- 10. Синтез белка требует больших затрат энергии –
- 11. Промежуточный обмен аминокислот в тканях Промежуточный метаболизм
- 12. Общие пути обмена аминокислотОбщие пути превращения аминокислот
- 13. Дезаминирование (отщепление аминогруппы)Превращение аминокислот с участием NH2-группы сводится
- 14. восстановительное – с образованием насыщенной жирной кислоты:гидролитическое – с образованием карбоновой гидроксикислоты:
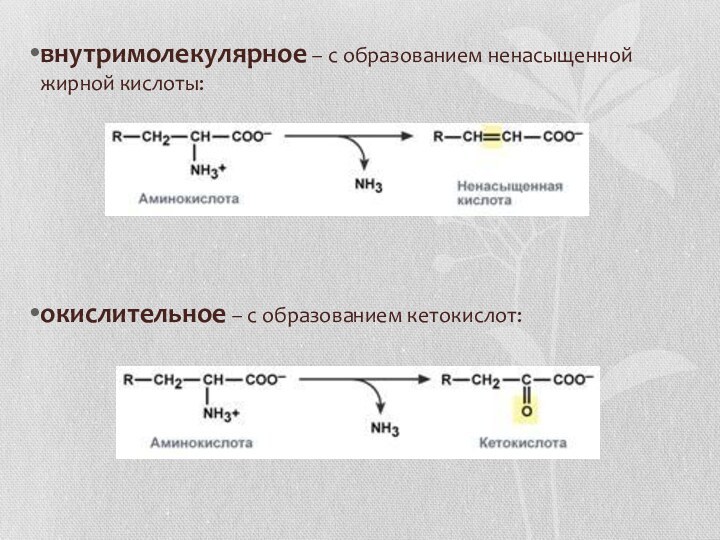
- 15. внутримолекулярное – с образованием ненасыщенной жирной кислоты:окислительное – с образованием кетокислот:
- 16. У человека окислительное дезаминирование является основным путем катаболизма аминокислот.
- 17. Трансаминирование -реакции межмолекулярного переноса амминогруппы (NH2—) от аминокислоты на α-кетокислоту без промежуточного образования аммиака.
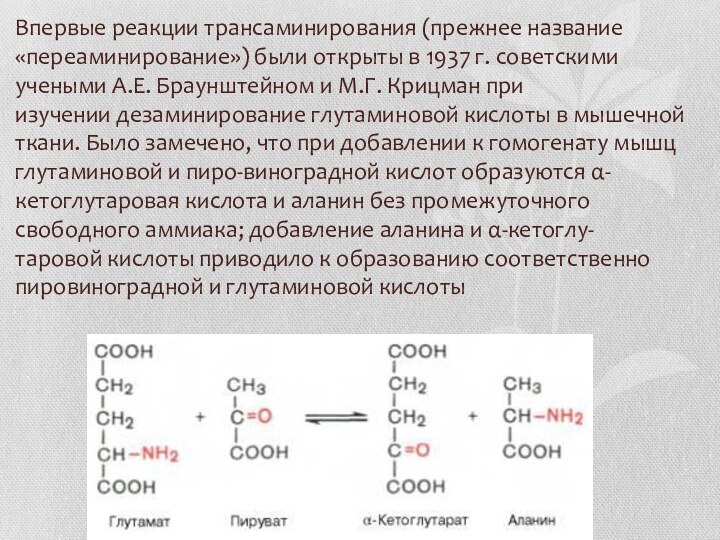
- 18. Впервые реакции трансаминирования (прежнее название «переаминирование») были открыты
- 19. Реакции трансаминирования являются обратимыми и, как выяснилось позже,
- 20. Декарбоксилирование -процесс отщепления карбоксильной группы аминокислот в виде СО2.Несмотря
- 21. В живых организмах открыты 4 типа декарбоксилирования аминокислот:α-Декарбоксилирование, характерное для тканей животных, при
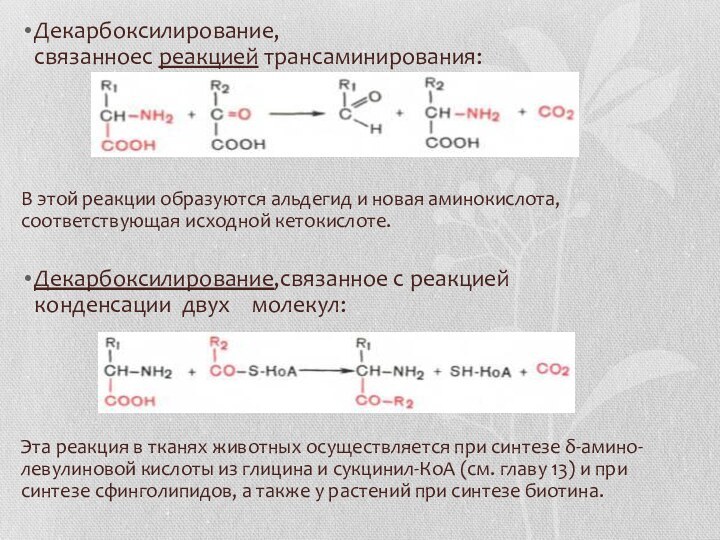
- 22. Декарбоксилирование, связанноес реакцией трансаминирования:В этой реакции образуются альдегид и новая аминокислота, соответствующая исходной кетокислоте.Декарбоксилирование,связанное с реакцией
- 23. Реакции декарбоксилирования в отличие от других процессов промежуточного обмена аминокислот являются
- 24. Скачать презентацию
- 25. Похожие презентации
Обмен белков Белки, поступающие с пищей, в своем неизменном виде не могут быть усвоены организмом. В желудочно-кишечном тракте белки подвергаются ферментативному расщеплению (гидролизу)* до отдельных аминокислот. Аминокислоты связаны друг с другом пептидными связями, которые под

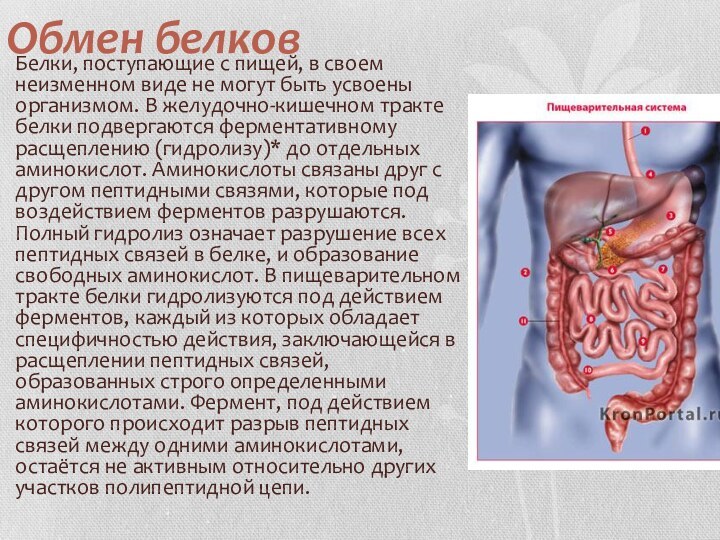
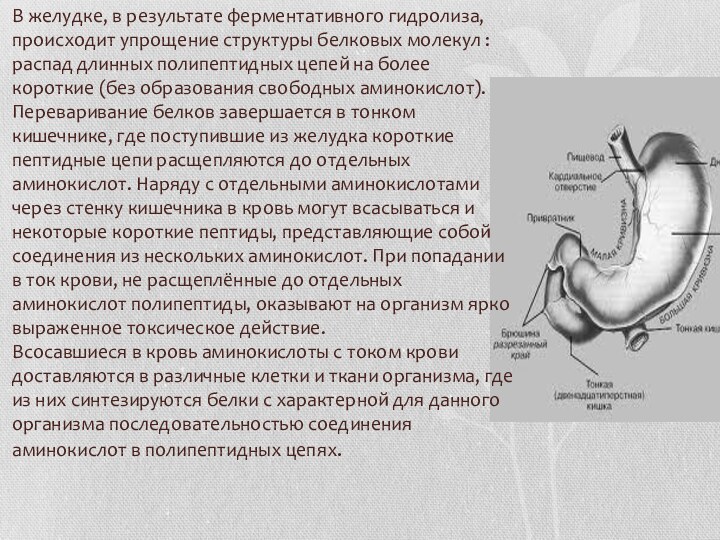
















Слайд 3 В желудке, в результате ферментативного гидролиза, происходит упрощение
структуры белковых молекул : распад длинных полипептидных цепей на
более короткие (без образования свободных аминокислот). Переваривание белков завершается в тонком кишечнике, где поступившие из желудка короткие пептидные цепи расщепляются до отдельных аминокислот. Наряду с отдельными аминокислотами через стенку кишечника в кровь могут всасываться и некоторые короткие пептиды, представляющие собой соединения из нескольких аминокислот. При попадании в ток крови, не расщеплённые до отдельных аминокислот полипептиды, оказывают на организм ярко выраженное токсическое действие. Всосавшиеся в кровь аминокислоты с током крови доставляются в различные клетки и ткани организма, где из них синтезируются белки с характерной для данного организма последовательностью соединения аминокислот в полипептидных цепях.Слайд 4 Белки, в отличие от жиров и углеводов, не
депонируются в организме. Аминокислоты, поступившие в ток крови и
не использованные для синтеза белков, подвергаются распаду с последующей утилизацией конечных продуктов их метаболизма. Часть аминокислот может быть использовано в процессе синтеза жиров и углеводов. Из аминокислот в клетках печени синтезируется креатин, - соединение, играющее важную роль в энергетике мышечных сокращений. В результате катаболизма (распада) аминокислот в организме образуются аммиак, углекислый газ и вода, - вещества, являющиеся конечными продуктами распада аминокислот.Слайд 5 Чрезмерное потребление белков вызывает усиленную работу пищеварительного аппарата,
ведёт к перенапряжению систем и органов, участвующих в обезвреживании
и выведении из организма конечных продуктов белкового обмена. При избыточном поступлении белков с пищей в желудочно-кишечном тракте образуются продукты их неполного расщепления. При попадании в нижние отделы кишечника не переваренные белки под действием кишечных бактерий, образующих микрофлору толстого кишечника, подвергаются гниению с выделением ядовитых веществ (индола, фенола, крезола и др.).Слайд 6 В основе существования всех живых систем лежит беспрерывная
взаимосвязь двух динамических процессов : катаболизма и анаболизма. В
организме постоянно происходит непрерывный распад и синтез белковых молекул – расщепление белков до аминокислот (катаболизм) и построение новых белковых молекул (анаболизм).Аминокислоты, не использованные в процессе белкового синтеза, могут служить в качестве субстратов для цикла трикарбоновых кислот, то есть являться источником энергии в мышечной клетке (пролин, метионин, валин, фенилаланин, аргинин, глутамин, аспарагин, тирозин). Такие аминокислоты как серин, глицин, цистеин, треонин и аланин являются предшественниками пировиноградной кислоты; лейцин, изолейцин, триптофан, тирозин, лизин – уксусной кислоты.
С током крови аминокислоты направляются в печень, в клетках которой локализованы процессы по превращению аминокислот в такой важный источник энергии для всех клеток организма, каким является глюкоза. Также из аминокислот в печени могут синтезироваться жирные кислоты.
Слайд 7
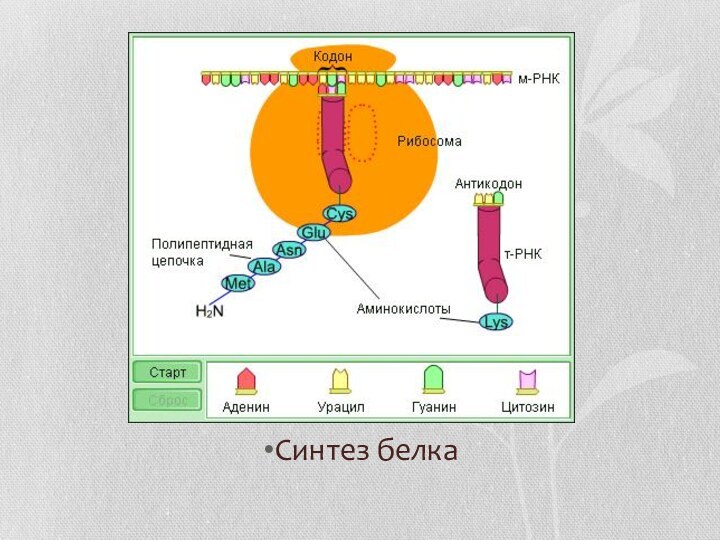
Синтез белка
Синтез белка (трансляция) является самым сложным из
биосинтетических процессов: он требует очень большого количества ферментов и
других специфических макромолекул, общее количество которых, видимо, доходит до трёхсот. Часть из них к тому же объединены в сложную трёхмерную структуру рибосом. Но несмотря на большую сложность синтез протекает с чрезвычайно высокой скоростью (десятки аминокислотных остатков в секунду). Процесс может замедляться и даже останавливаться ингибиторами-антибиотиками.Слайд 8 В пятидесятых годах XX века было установлено, что синтез
белка происходит в рибонуклеопротеиновых частицах, называющихся рибосомами. Диаметр рибосомы бактерии оставляет
18 нм, а их общее количество – десятки тысяч в клетке. Рибосомы эукариот несколько крупнее (21 нм).Сам процесс протекает в пять этапов.
Активация аминокислот
Инициация белковой цепи
Элонгация.
Терминация
Сворачивание и процессинг
Слайд 10 Синтез белка требует больших затрат энергии – 24,2
ккал/моль. После окончания синтеза белок при помощи специального полипептидного
лидера доставляется к месту своего назначения.Синтез белка контролируют гены-операторы. Совокупность рабочих генов – операторов и структурных генов – называется оперон. Опероны не являются самостоятельной системой, а «подчиняются» генам-регуляторам, отвечающим за начало или прекращение работы оперона. Свой контроль гены-регуляторы осуществляют при помощи специального вещества, которое они при необходимости синтезируют. Это вещество реагирует с оператором и блокирует его, что влечёт за собой прекращение работы оперона. Если же вещество реагирует с небольшими молекулами – индукторами, это будет являться сигналом к возобновлению работы системы.
Слайд 11
Промежуточный обмен аминокислот в тканях
Промежуточный метаболизм аминокислот белковых
молекул, как и других питательных веществ в организме, включает
катаболические (распад до конечных продуктов) и анаболические (биосинтез аминокислот) процессы, а также ряд других специфических превращений, сопровождающихся образованием биологически активных веществ. Условно промежуточный метаболизм аминокислот можно разделить на общие пути обмена и индивидуальные превращения отдельных аминокислот.
Слайд 12
Общие пути обмена аминокислот
Общие пути превращения аминокислот включают
реакции дезаминирования, трансаминирования, декарбоксилирования, биосинтеза и рацемизации. Реакции рацемизации
характерны только для микроорганизмов, физиологическая роль которой заключается в синтезе D-изомеров аминокислот для построения клеточной оболочки.
Слайд 13
Дезаминирование
(отщепление аминогруппы)
Превращение аминокислот с участием NH2-группы сводится к ее
отщеплению от углеродного скелета – реакции дезаминирования.
Существует четыре типа
реакций, катализируемых своими ферментами:1. Восстановительное дезаминорование 2. Гидролитическое дезаминированиие 3. Внутримолекулярное дезаминирование
4. Окислительное дезаминирование
Слайд 14
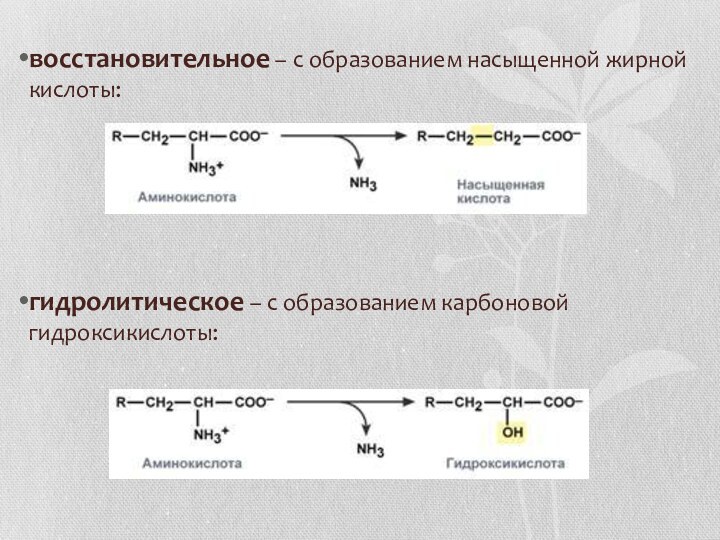
восстановительное – с образованием насыщенной жирной кислоты:
гидролитическое – с образованием
карбоновой гидроксикислоты:
Слайд 15
внутримолекулярное – с образованием ненасыщенной жирной кислоты:
окислительное – с образованием
кетокислот:
Слайд 16 У человека окислительное дезаминирование является основным путем катаболизма аминокислот. Однако
такие аминокислоты как серин и гистидин могут терять аминогруппу с использованием других
типов дезаминирования, а треонин сразу подвергается прямому расщеплению до глицина и ацетальдегида
Слайд 17
Трансаминирование
-реакции межмолекулярного переноса амминогруппы (NH2—) от аминокислоты на
α-кетокислоту без промежуточного образования аммиака.
Слайд 18 Впервые реакции трансаминирования (прежнее название «переаминирование») были открыты в
1937 г. советскими учеными А.Е. Браунштейном и М.Г. Крицман
при изучении дезаминирование глутаминовой кислоты в мышечной ткани. Было замечено, что при добавлении к гомогенату мышц глутаминовой и пиро-виноградной кислот образуются α-кетоглутаровая кислота и аланин без промежуточного свободного аммиака; добавление аланина и α-кетоглу-таровой кислоты приводило к образованию соответственно пировиноградной и глутаминовой кислотыСлайд 19 Реакции трансаминирования являются обратимыми и, как выяснилось позже, универсальными
для всех живых организмов.
В переносе аминогруппы активное участие принимает кофермент трансаминаз пиридоксальфосфат(производное витамина В6; который
в процессе реакции обратимо превращается в пиридоксаминфосфат.
Слайд 20
Декарбоксилирование
-процесс отщепления карбоксильной группы аминокислот в виде СО2.
Несмотря на
ограниченный круг аминокислот и их производных, подвергающихся декарбоксилированию в животных тканях, образующиеся
продукты реакции – биогенные амины – оказывают сильное фармакологическое действие на множество физиологических функций человека и животных.
Слайд 21
В живых организмах открыты 4 типа декарбоксилирования аминокислот:
α-Декарбоксилирование, характерное для тканей животных, при котором
от аминокислот отщепляется карбоксильная группа, стоящая по соседству с α-углеродным атомом. Продуктами реакции являются
СО2 и биогенные амины:ω-Декарбоксилирование, свойственное микроорганизмам. Например, из аспарагиновой кислоты этим путем образуется α-аланин:





























