- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему оксиди
Содержание
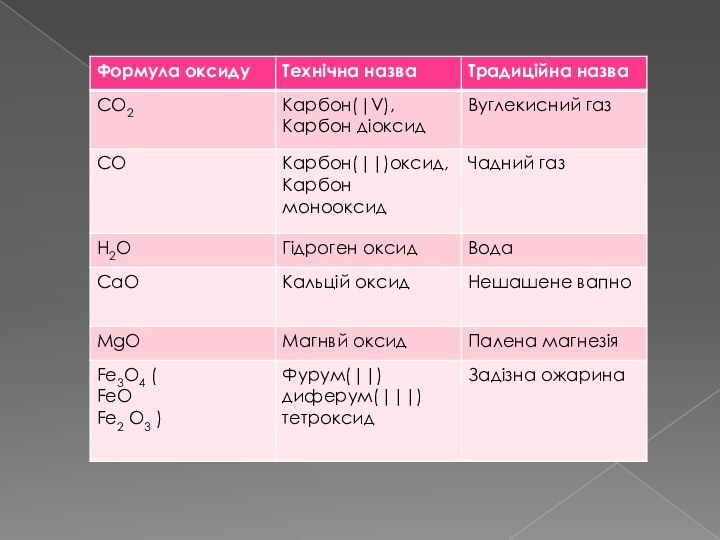
- 2. метаПознайомити з класифікацією оксидівРозглянутипоширення оксидів у природі
- 3. Оксидами - називаються складні речовини, до яких входять два елементи, один з яких оксиген.
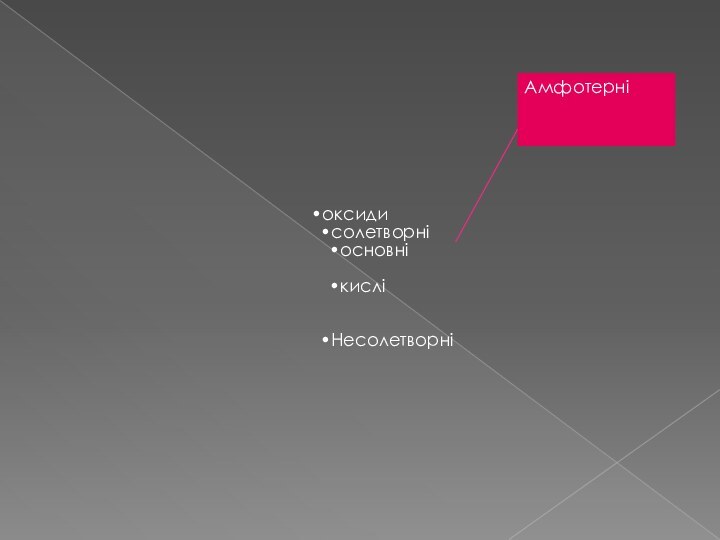
- 5. Амфотерні
- 7. Солетворні оксиди здатні утворювати солі під час
- 8. Способи добування оксидів1. Горіння простих і складних
- 9. Хімічні властивостіОсновні оксиди1. Взаємодіють (реагують) з водою:
- 10. Одержання Оксиди можна одержувати різними способами.Безпосереднім сполученням
- 11. Окси́д алюмі́ніюОкси́д алюмі́нію—сполук алюмінію з киснем Al2O3 безбарвна кристалічна речовина.
- 12. Алюміній має високу хімічну активність і тому
- 13. Експерименти з оксидами нітрогену. Реакція натрій нітриту
- 14. Налили в пляшку
- 15. Дослід 2 Після експерименту у нас залишилася
- 26. Скачать презентацию
- 27. Похожие презентации
метаПознайомити з класифікацією оксидівРозглянутипоширення оксидів у природі та житті людиниВластивостіОдержанняЕксперименти з оксидами нітрогену. Реакція натрій нітриту NaNO2 і хлоридної кислоти HCl























Слайд 2
мета
Познайомити з класифікацією оксидів
Розглянутипоширення оксидів у природі та
житті людини
і хлоридної кислоти HClСлайд 7 Солетворні оксиди здатні утворювати солі під час взаємодії
з кислотами або кислотами.
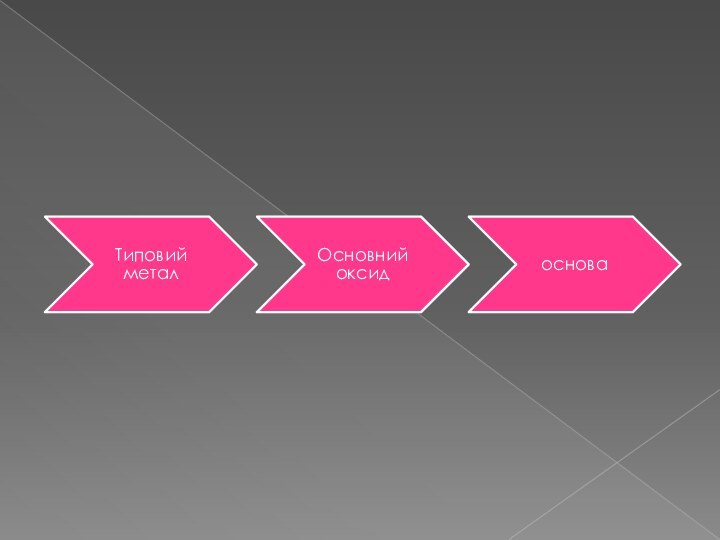
Основними називаються такі оксиди, яким відповідають
основи. Ці оксиди металів. Для них характрний фонний тип зв’язку. У металів, які входять до складу основних оксидів, ступінь окислення буває не вище + 3.Кислотними називають оксиди, яким відповідають кислоти. Утворюються неметалами і деякими металами, що виявляють високі ступені окислення.
Амфотерними називаються такі оксиди, які залежно від умов виявляють основні або кислотні властивості. До них належать деякі оксиди металів: ZnO, Al2O3, Cr2O3, PbO і ін.
Слайд 8
Способи добування оксидів
1. Горіння простих і складних речовин:
а)
С + О2 =СО2 ;2Сu + O2 = 2CuO
(окислення, крім благородних металів)б) СН4 + 2О2 = СО2 + 2Н2О
2. Розклад під час нагрівання складних оксигеновмісних сполук: солей, гідроксидів, кислот:
а) СаСО3 =t CaO + CO2
2Cu (NO3) 2 = 2CuO + 4NO2+ O2
б) 2Fe (OH) 3 = Fe2O3 + 3H2O
2CuOH = Cu2O + H2O
в) Н2СО3 = Н2О + СО2
Н2SiO 3= H2O + SiO2
S + 6HNO2 = H2SO4 + 6NO2 + 2H2O
B + 3HNO3 = H3BO3 + 3NO 2
3. Взаємодія металів з кислотами – окисниками:
3Сu + 8HNO3 розд. = 3Cu (NO3) 2 + 2NO + 4H2O
Cu + 2H2SO4 конц. =t CuSO 4 + SO2 + 2H2O
4. Окислення нищих оксидів і розкладання вищих оксидів:
а) 2СО + О2 = 2СО2
2NO + O2 = 2NO
б) 4CrO3 = 2Cr2O 3+ 3O2
Слайд 9
Хімічні властивості
Основні оксиди
1. Взаємодіють (реагують) з водою:
Тільки оксиди активних металів
(Na, K, Ca, Ba і т.д.) При цьому утворюютьсярозчинні основи (луги).
СаО + Н2О = Са (ОН) 2
Na2O + H2O = 2NaOH
2. Взаємодіють з кислотами
СuO + H2SO4 CuSO4 + H2O
3. Взаємодіють між собою
СaO + SiO2 = CaSiO3
CaO + CO2 = CaCO3 Амфотерні оксиди
1. Взаємодіють з кислотами:
ZnO + 2HCl = ZnCl2 + H2O
2. Взаємодіють з лугами:
ZnO + 2NaOH +H2O= Na2 [Zn (OH)2]
Zn + 2NaOH =cплав. Na2 ZnO2 + H2O
Кислотні оксиди
1. Не всі кислотні оксиди взаємодіють з водою. SiO2 і деякі інші з водою
не реагують.
SO3 + H2O H2SO4
P2O5 + 3H2O 2H3PO4
2. Взаємодіють з основами
CO2 + Ca (OH) 2 CaCO3 + H2O
Слайд 10
Одержання
Оксиди можна одержувати різними способами.
Безпосереднім сполученням елементів з
киснем:
2Zn + O2 = 2ZnO4Р + 5О2 = 2Р2О5
Окисленням різних
сполук киснем:СН4 + 2О2 = СО2 + 2Н2О2Н2S + 3О2 = 2SO2 + 2Н2О
Розкладом гідроксидів при нагріванні:
Ca(ОН)2 = СаО + Н2О2Fe(ОН)3 = Fe2О3 + 3Н2О
Розкладом солей кисневих кислот при нагріванні:
CaCO3 = CaO + СО2Cu2(ОН)2СО3 = CuO + СО2 + Н2О
Слайд 11
Окси́д алюмі́нію
Окси́д алюмі́нію—сполук алюмінію з киснем Al2O3 безбарвна кристалічна речовина.
Слайд 12 Алюміній має високу хімічну активність і тому в
природі зустрічається тільки в зв'язаному стані, у формі різних
мінералів і гірських порід . Близько 250 різних мінералів містять алюміній. Проте основною сировиною для виробництва глинозему служить боксит(приблизно 95 % світового виробництва глинозему). Пояснюється це головним чином тим, що вміст оксиду алюмінію в промислових сортах бокситу вище, а кремнезему нижче, ніж в інших алюмінієвих рудах, а також нефелінів таалунітів. Запаси сировинних матеріалів у світі в цілому обмежені, а в Україні взагалі немає промислових запасів цих мінералів.Слайд 13 Експерименти з оксидами нітрогену. Реакція натрій нітриту NaNO2
і хлоридної кислоти HCl
Дослід 1
Взяли безбарвну пляшку для
води з поліетилентерефталату (ПЕТФ) об'ємом 5-7 л. На дно пляшки насипали приблизно 20-30 см3 натрій нітриту NaNO2 і додали 25-30 мл концентрованої хлоридної кислоти. Чути шипіння, відбувається активне виділення бурого газу. Пляшка швидко заповнюється бурими парами.
При взаємодії натрій нітриту з розчином хлоридної або сульфатної кислот утворюється нітритна кислота HNO2NaNO2 + HCl = NaCl + HNO2 нітритна кислота нестійка, існує лише в розбавлених розчинах і легко розкладається з утворенням суміші нітроген (II) і (IV) оксидів 2HNO 2<=> N2O3 + H2O <=> NO + NO2 + H2O Закрили пляшку, обережно струсили, відкрили. Нічого невідбулося.
Слайд 14 Налили в пляшку приблизно
200 мл води і повторили дії: швидко закрили пляшку
і сильно струсили вміст. Бурий газ посвітлішав і майже знебарвився, стінки пляшкистиснулися. Діоксид нітрогену NO2, який знаходився в пляшці, прореагував з водою і киснем, при цьому утворилися нітратна кислота і монооксидт нітрогену.4N2O + 2H2O + O2 = 4HNO3 3NO2 + H2O = 2HNO3 + NO
Якщо пляшку відкрити, її вміст стане знову бурим - спочатку зверху, потім по всьому об'єму. Варто обережно "розпрямити" стінки пляшки, і такий перехід відбудеться моментально. Оксид нітрогену(II) NO швидко окисниться киснем до бурого діоксиду NO2.
2NO + O2 = 2NO2 Знову закрили пляшку і струсили її вміст. Газ всередині знебарвився, а стінки зморщилися. Якщо ми відкриємо корок, всередині пляшки моментально з'являться бурі пари. Описану процедуру можна повторювати кілька разів.