- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Основы органической химии
Содержание
- 2. Классификация
- 3. Ациклические
- 4. Число связей атома углерода
- 5. Циклические углеводороды
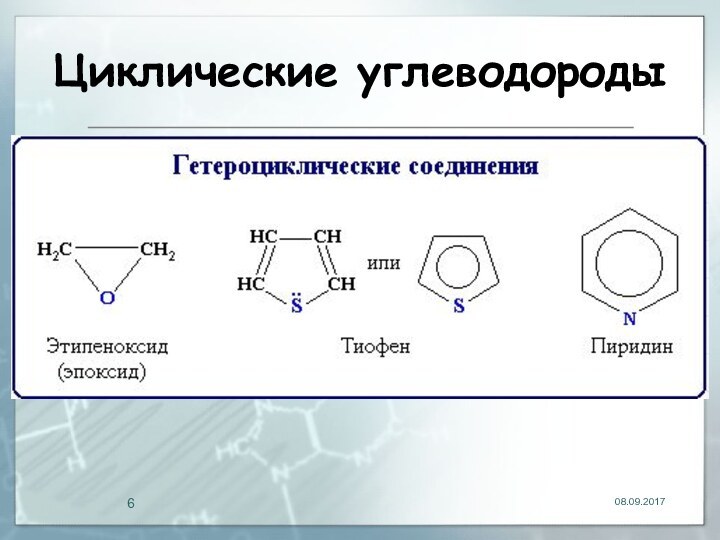
- 6. Циклические углеводороды
- 7. Классификация по функциональным группам
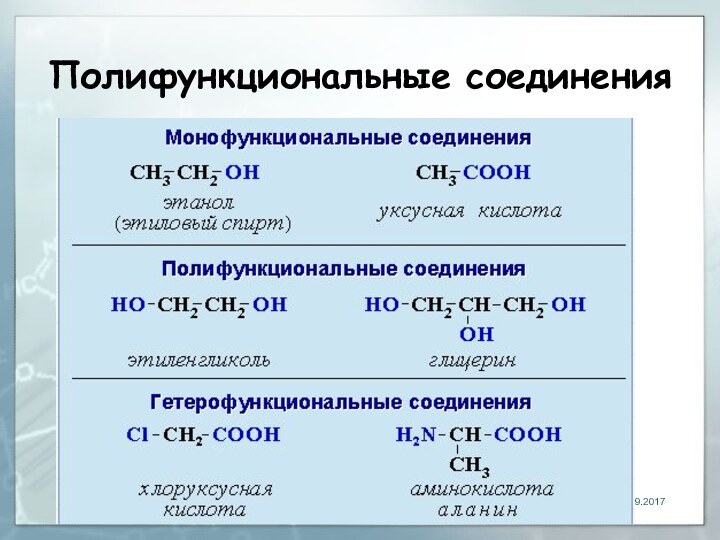
- 8. Полифункциональные соединения
- 10. Номенклатура соединений (по ИЮПАК (IUPAC)):заместительнаярадикально-функциональная
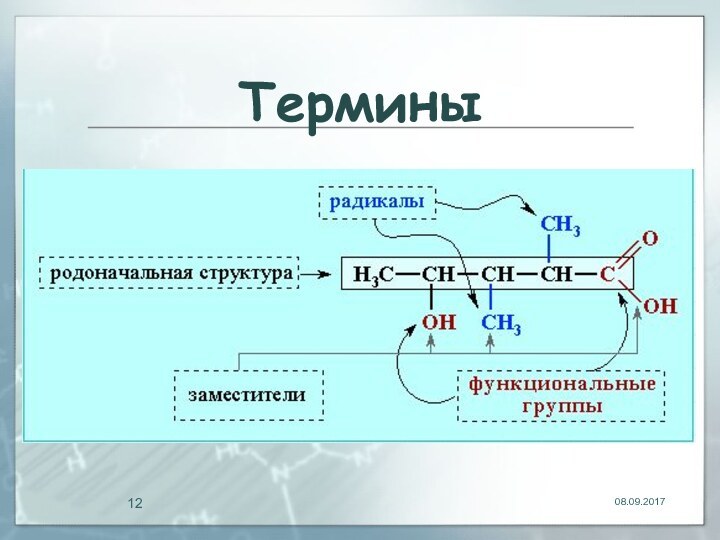
- 11. Термины
- 12. Термины
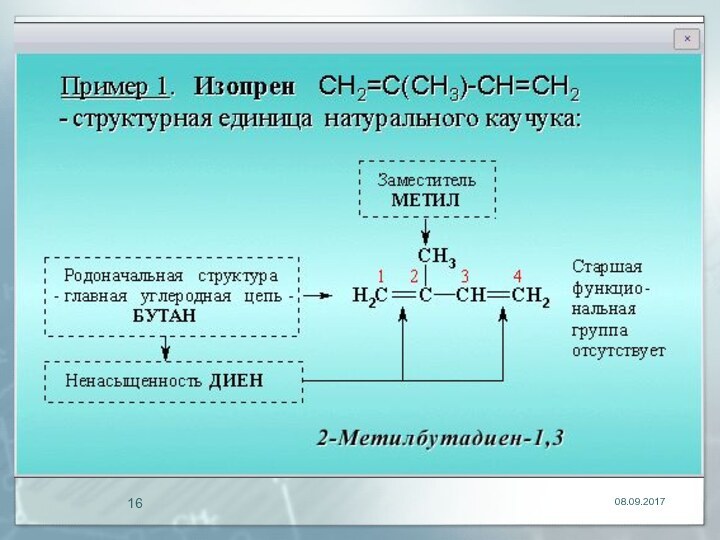
- 13. Заместительная номенклатура
- 14. Префиксы
- 15. Порядок старшинства
- 18. Радикально-функциональная номенклатура
- 19. Радикально-функциональная номенклатура
- 20. Контрольная работа
- 21. Контрольная работа
- 22. Контрольная работа
- 23. Контрольная работа
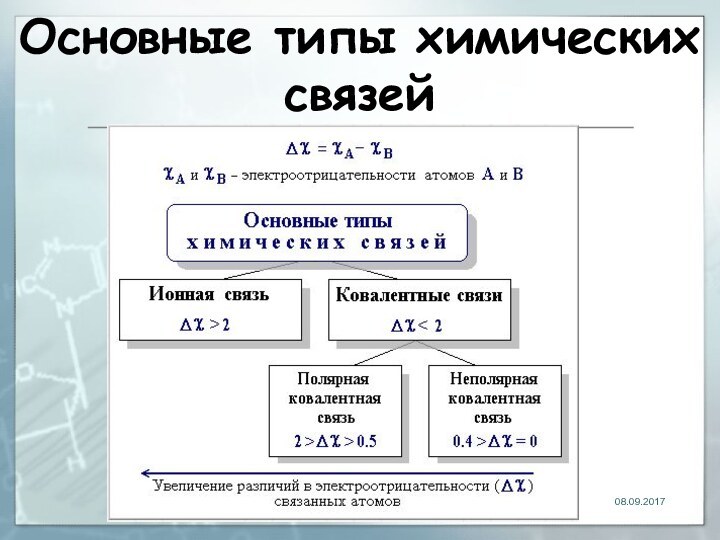
- 24. Основные типы химических связей
- 25. Ионная связь химическая связь, основанная на электростатическом
- 26. Электроотрицательность Способность атома удерживать внешние валентные электроныПодчиняется
- 27. Ковалентная связьСвязь, образованная путём обобществления пары электронов связываемых атомов
- 28. Свойства ковалентной связиНаправленностьНасыщаемостьПолярностьПоляризуемость
- 29. НаправленностьМолекулярное строение органических молекул имеет геометрическую форму.Количественной мерой направленности является угол между двумя связями (валентный угол)
- 30. Насыщаемость Способность атомов образовывать ограниченное число ковалентных связей.Количество связей определяется числом внешних атомных орбиталей атома.
- 31. Полярность Обусловлена неравномерным распределением электронной плотности вследствии различной электро-отрицательности атомов по шкале Л.Полинга:
- 32. Полярность Ковалентные связи делятся на полярные и неполярные. Неполярные связи между двумя одинаковыми атомами: Н—Н, С—С.
- 33. Полярность Полярные связи между двумя атомами с разной электроотрицательностью: Н—F, С—Сl.
- 34. Поляризуемость Смещение электронов под воздействием внешнего электрического поля другой частицы.
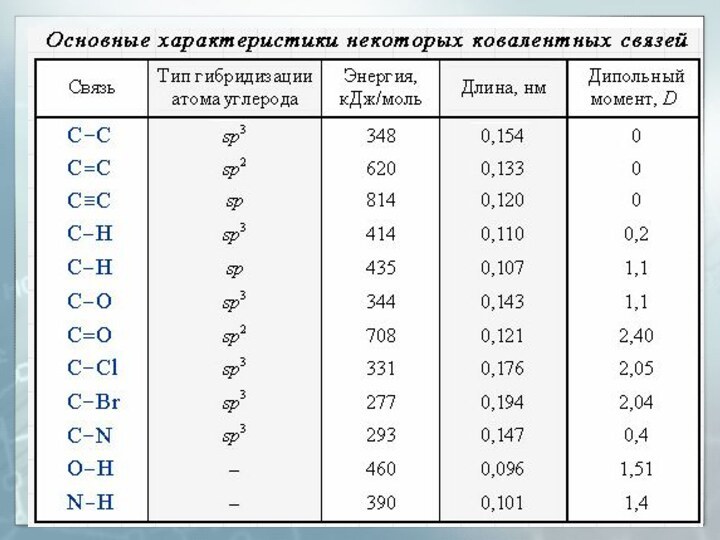
- 35. Длина связи Расстояние между центрами двух связанных атомов.На характеристики связей влияет их кратность
- 36. Энергия связи Энергия, выделяемая при образовании связи или необходимая для разъединения двух связанных атомов
- 37. Дипольный момент (μ или D) Величина, характеризующая полярность связи:l – длина связиq – эффективный заряд
- 39. Контрольная работа
- 40. Контрольная работа
- 41. Контрольная работа
- 42. Контрольная работа
- 43. Контрольная работа
- 44. Механизмы образования связиCвязь между атомами возникает при
- 45. ОБМЕННЫЙ МЕХАНИЗМв образовании связи участвуют одноэлектронные атомные
- 46. ДOНОРНО-АКЦЕПТОРНЫЙобразование связи происходит за счет пары электронов атома-донора и вакантной орбитали атома-акцептора:
- 47. Донорно-акцепторные связиКовалентная связь, образующаяся за счет пары
- 48. Донорно-акцeпторная связь отличается только способом образования; по свойствам она одинакова с остальными ковалентными связями
- 49. Кратные связиобразуются при обобществлении двумя атомами более
- 50. Кратные связиявляются сочетанием σ- и π-связейДвойная связь
- 51. Кратные связиявляются сочетанием σ- и π-связейТройная связь
- 52. Кратные связиЧисло электронных пар, участвующих в образовании
- 53. Электронные формулы молекулДля изображения электронного строения молекул, ионов или радикалов используются электронные формулы (структуры Льюиса)
- 54. Делокализованные π-связи. Сопряжениесвязь, электронная пара которой рассредоточена между несколькими (более 2) ядрами атомов
- 55. Делокализованные π-связиРассредоточение электронов - энергетически выгодный процесс, т.к. приводит к снижению энергии молекулы
- 56. Делокализованные π-связи
- 57. Система сопряжeния может быть открытой или замкнутой
- 58. Бензол
- 59. Водородные связи (Н-связи)Атом водорода, связанный с электро-отрицательным
- 60. Водородные связи (Н-связи)Эта связь значительно слабее других
- 61. Образование водородных связей В молекуле спирта R-O-H
- 62. Образование водородных связей Следовательно, возможно образование водородных связей между молекулами спирта:
- 63. Образование водородных связей Это приводит к ассоциации молекул и объясняет относительно высокую т.кип. спиртов:
- 64. Образование водородных связей В присутствии воды возникают водородные связи между молекулами спирта и воды:
- 65. Влияние водородных связей на свойства веществМежмолекулярные водородные
- 66. Влияние водородных связей на свойства веществОбразование Н-связей
- 67. Влияние водородных связей на свойства веществВнутримолекулярная водородная
- 68. Влияние водородных связей на свойства веществ
- 69. Контрольная работа
- 70. Контрольная работаКакие электронные формулы соответствуют соединениям с
- 71. Контрольная работаВ каких молекулах имеются делокализованные p-связи?а)
- 72. Контрольная работаУкажите соединения, в которых есть атомы
- 73. Взаимное влияние атомовВзаимное влияние атомов в молекуле,
- 74. Заместители - любой атом (кроме водорода), который
- 75. Электронные эффектыСмещение электронной плотности в молекуле, ионе, радикале под влияние заместителей, подразделяются на:- электронодонорные;- электроноакцепторные.
- 76. Электронодонорные заместителиатомная группировка (или атом), повышающая электронную плотность на остальной части молекулы
- 77. Электроноакцепторные заместителиатомная группировка (или атом), понижающая электронную плотность на связанном с ним углеводородном фрагменте
- 78. Электроноакцепторные заместителиДва вида влияний заместителей:индуктивный эффект (±I);мезомерный
- 79. Индуктивный эффектПередача по цепи сигма-связей электронного влияния заместителей, которое обусловлено различиями в электроотрицательности атомов
- 80. Индуктивный эффектНаправление смещения электронной плотности σ-связей обозначается стрелками и символами частичных зарядов (δ+ или δ-)
- 81. Индуктивный эффектИз-за слабой поляризуемости σ-связей I-эффект быстро
- 82. -I-эффектПроявляет заместитель, уменьшающий электронную плотностьЗаместитель приобретает частичный отрицательный заряд, атом углерода – положительный.
- 83. +I-эффектПроявляет заместитель, увеличива-ющий электронную плотностьЗаместитель приобретает частичный положительный заряд, атом углерода – отрицательный.
- 84. Мезомерный эффектПередача электронного влияния заместителей по сопряжённой π-системе.Благодаря подвижности π-электронов передаётся по цепи без затухания
- 85. Правила определения величины и знака М-эффекта
- 86. Правило 1.Величина М-эффекта растет с увеличением заряда заместителя. Ионы проявляют наиболее сильный М-эффект:
- 87. Правило 2-М-эффект заместителей тем сильнее, чем больше электроотрицательность имеющихся в заместителе элементов:
- 88. Правило 3Группа С=О в этом случае связана
- 89. Правило 3В хлорацильной группе -С(О)Cl атом хлора
- 90. Правило 4+М-эффект заместителя тем сильнее, чем меньше электроотрицательность гетероатома, входящего в его состав:
- 91. Правило 4Исключение составляют галогены:
- 92. +М-эффектХарактерен для групп:-OH, -NH2, -OR.В молекуле фенола
- 93. -М-эффектХарактерен для групп СOH, СООН, NО2.В молекуле фенола C6H5-СOH пи-орбиталь расположена перпендикулярно
- 94. Суммарный электронный эффектВ случае противоположной направленности индуктивного
- 95. Суммарный электронный эффектв молекуле анилина аминогруппа NH2
- 96. Суммарный электронный эффект
- 97. Пространственные эффекты(стерические) эффекты определяют доступность реакционных центров
- 98. Пространственные эффектыСкорость реакции присоединения по С=О-группе снижается в ряду:
- 99. 1.Контрольная работа
- 100. 2. Контрольная работа1 2 3 4
- 101. Углеводородыорганические соединения, в состав которых входят только
- 102. Многообразие углеводородов - атомы углерода способны соединяться между собой в цепи различного строения:
- 103. Многообразие углеводородов - даже при одинаковом количестве
- 104. Многообразие углеводородов - одному и тому же
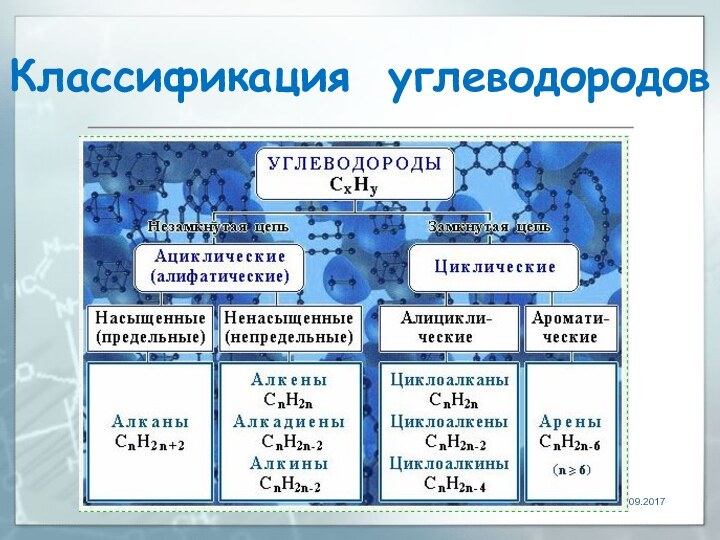
- 105. Многообразие углеводородов Классификацию углеводородов проводят по следующим
- 106. Классификация углеводородов 1. В зависимости от строения
- 107. Классификация углеводородов Среди циклических углеводородов выделяют: -
- 108. Классификация углеводородов 2. По степени насыщенности различают:
- 109. Классификация углеводородов
- 110. Алканы алифатические (ациклические) предельные углеводороды, в которых
- 111. Алканы Алканы – название предельных углеводородов по
- 112. Алканы углеводороды, состав которых выражается общей формулой CnH2n+2, где n – число атомов углерода
- 113. Приемы построения структурных формул изомеров1. Сначала изображаем
- 114. Приемы построения структурных формул изомеров2. Затем цепь
- 115. Приемы построения структурных формул изомеров3. Когда все
- 116. Приемы построения структурных формул изомеров4. После построения
- 117. Номенклатура Номенклатура органических соединений – система правил,
- 118. Радикалы в ряду алкановОбщее название одновалентных радикалов
- 119. Радикалы Радикалы подразделяются на первичные, вторичные и третичные:
- 120. Правила построения названий1. Для простейших алканов (С1-С4)
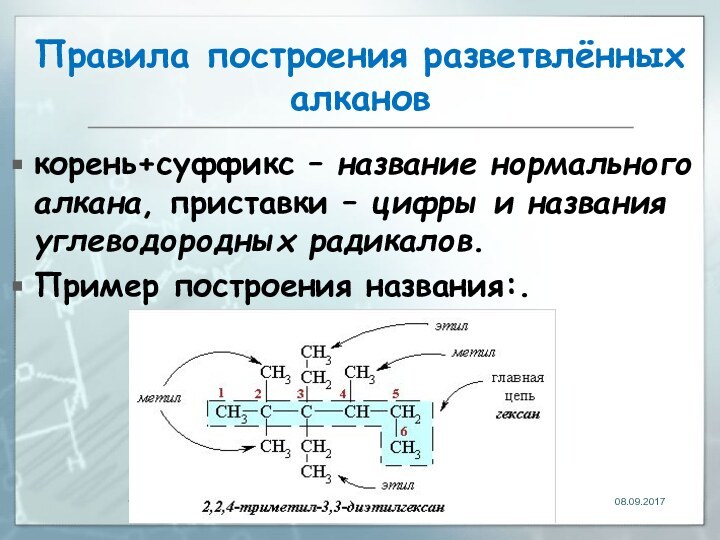
- 121. Правила построения названий3.В основе названия разветвленного алкана
- 122. Правила построения разветвлённых алкановкорень+суффикс – название нормального
- 123. 1.Контрольная работа1. Состав алканов отражает общая формула
- 124. 2. Контрольная работаКакие соединения относятся к гомологическому
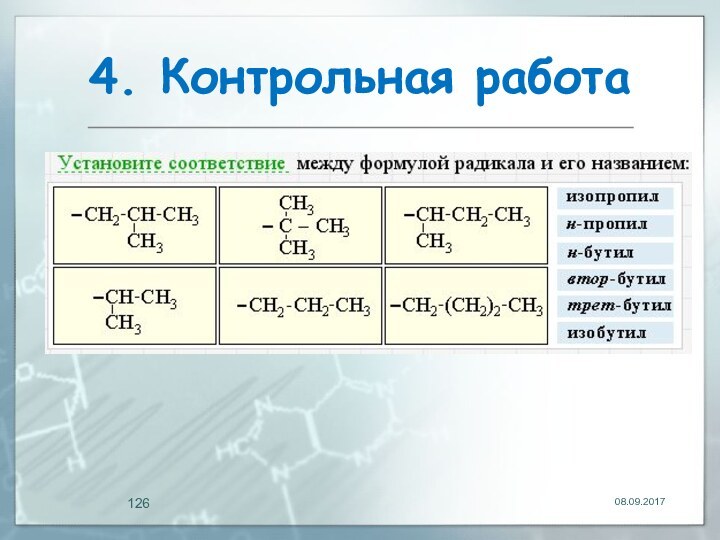
- 125. 3. Контрольная работаУкажите названия углеводородных радикалов:Ответ 1:
- 126. 4. Контрольная работа
- 127. Химические свойства алканов определяются его строением, т.е.
- 128. Химические свойства алканов 1. предельная насыщенность алканов
- 129. Химические свойства алканов 2. симметричность неполярных С–С
- 130. Крекинг алкановреакции расщепления углеродного скелета крупных молекул
- 131. Галогенопроизводные алканов (галогеналканы)Галогенопроизводные алканов широко применяются для
- 132. Галогенопроизводные алканов (галогеналканы)Чтобы получить алкан с нечётным количеством атомов углерода потребуется два различных галогеналкана:
- 133. Нуклеофильное замещение (SN)положительно заряженный углеродный атом,
- 134. Механизм-1 (SN1) - двухстадийныйCтадия 1. Алкилгалогенид, отщепляя
- 135. Механизм-1 (SN1) - двухстадийныйCтадия 2. Карбокатион взаимодействует с нуклеофилом (донором пары электронов) с образованием конечного продукта:
- 136. Механизм-2 (SN2) - одностадийныйзаключается в практически одновременном отщеплении галогенид-иона и присоединении гидроксид-аниона (без образования карбокатиона):
- 137. Получение алканов Алканы выделяют из природных источников:-
- 138. 1. Контрольная работаДайте названия радикалам следующих алканов:
- 139. 2.Контрольная работаНапишите процесс расщепления для следующих алканов,
- 140. Алкены (этиленовые углеводороды, олефины) - непредельные
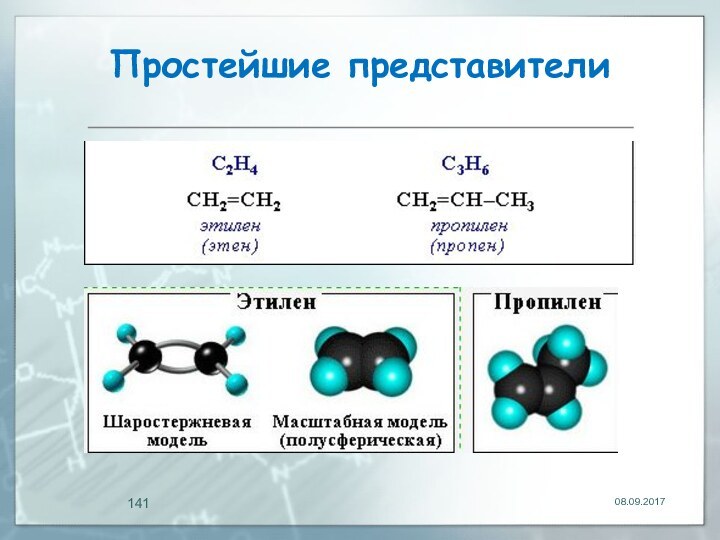
- 141. Простейшие представители
- 142. Алкены В отличие от предельных углеводородов, алкены
- 143. Номенклатура алкеновназвания алкенов производят от названий соответствующих
- 144. Номенклатура алкеновНумерацию углеродных атомов начинают с ближнего
- 145. Номенклатура алкеновВ номенклатуре различных классов органических соединений наиболее часто используются следующие одновалентные радикалы алкенов:
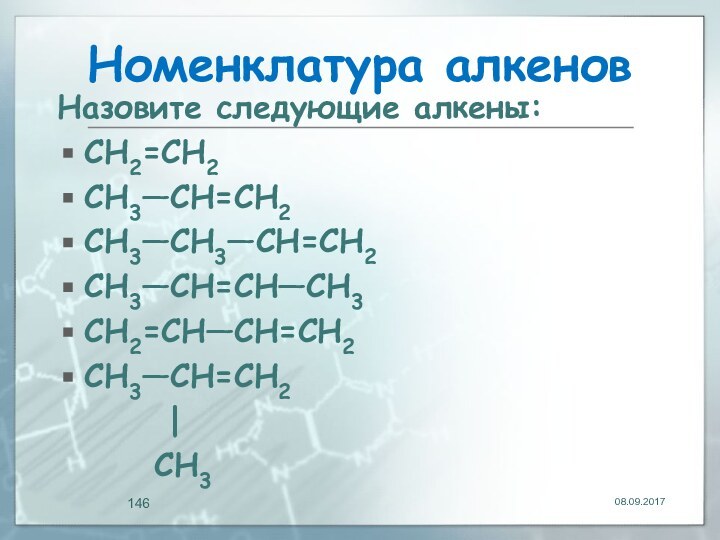
- 146. Номенклатура алкеновНазовите следующие алкены:CH2=CH2CH3—CH=CH2CH3—CH3—CH=CH2CH3—CH=CH—CH3CH2=CH—CH=CH2CH3—CH=CH2 | CH3
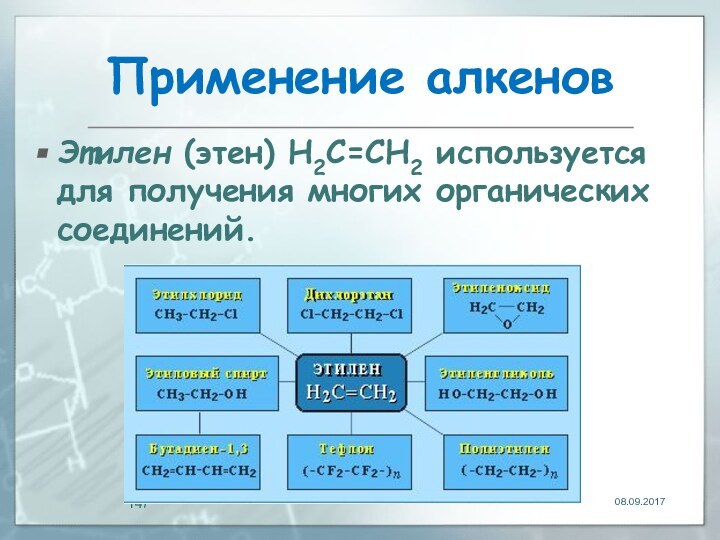
- 147. Применение алкенов Этилен (этен) Н2С=СН2 используется для получения многих органических соединений.
- 148. 1.Контрольная работаКакие модели соответствуют молекулам алкенов?
- 149. 2. Контрольная работаДайте названия следующих алкенов, полученных
- 150. 3.Контрольная работаНазовите соединение:Ответ 1: 3-метил-4-этилпентен-2 Ответ
- 151. 4. Контрольная работаДвойная связь является сочетанием .
- 152. 6. Контрольная работаКакова гибридизация атомов углерода в
- 153. Алкины Алкины (ацетиленовые углеводороды) – непредельные
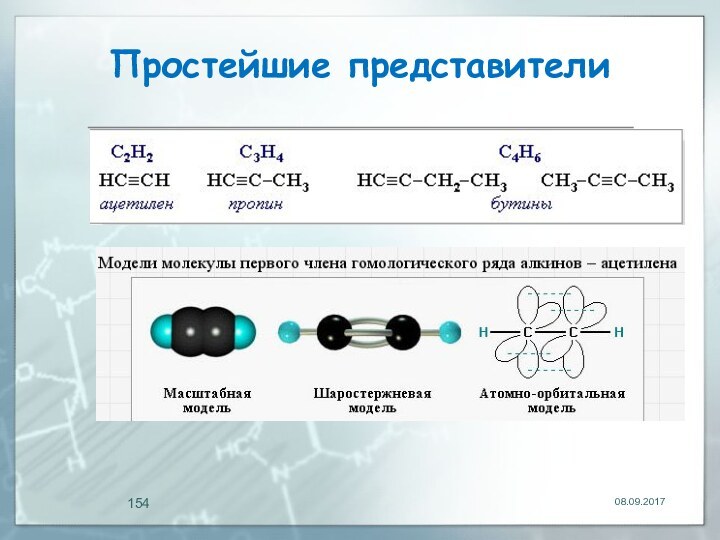
- 154. Простейшие представители
- 155. Алкины Тройную связь осуществляют шесть общих электронов:
- 156. Номенклатура алкиновназвания алкинов производят от названий соответствующих
- 157. Номенклатура алкиновНумерацию углеродных атомов начинают с ближнего
- 158. Номенклатура алкиновДля простейших алкинов применяются исторически сложившиеся
- 159. Назовите следующие алкины:CH2≡CH2CH3—CH ≡ CH2CH3—CH3—CH ≡ CH2CH3—CH
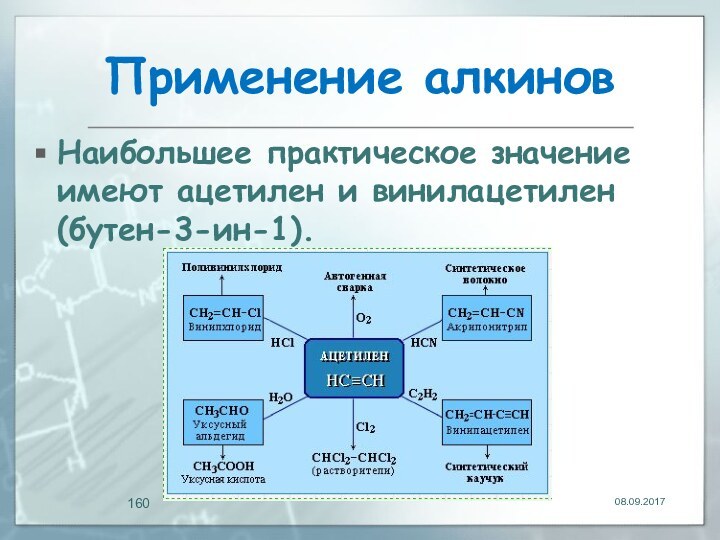
- 160. Применение алкинов Наибольшее практическое значение имеют ацетилен и винилацетилен (бутен-3-ин-1).
- 161. 1.Контрольная работаТройная связь является сочетанием: Ответ
- 162. 4. Контрольная работаКакова гибридизация атомов углерода в
- 163. АРЕНЫ (ароматические углеводороды) соединения, молекулы
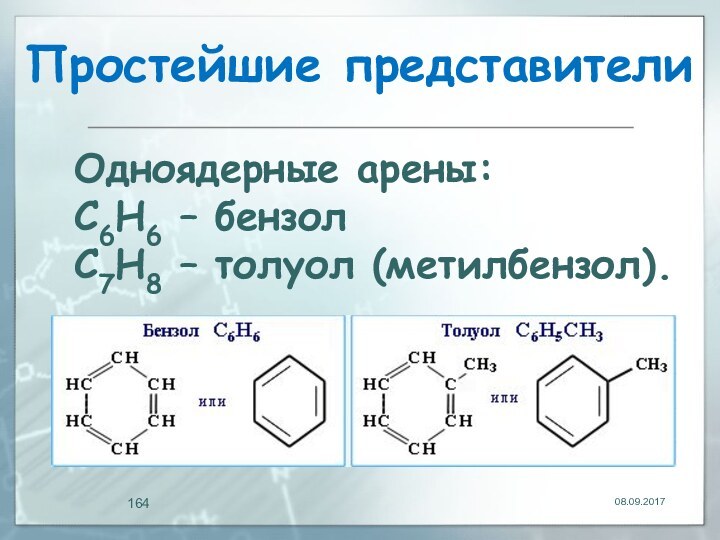
- 164. Простейшие представителиОдноядерные арены: С6Н6 – бензолС7Н8 – толуол (метилбензол).
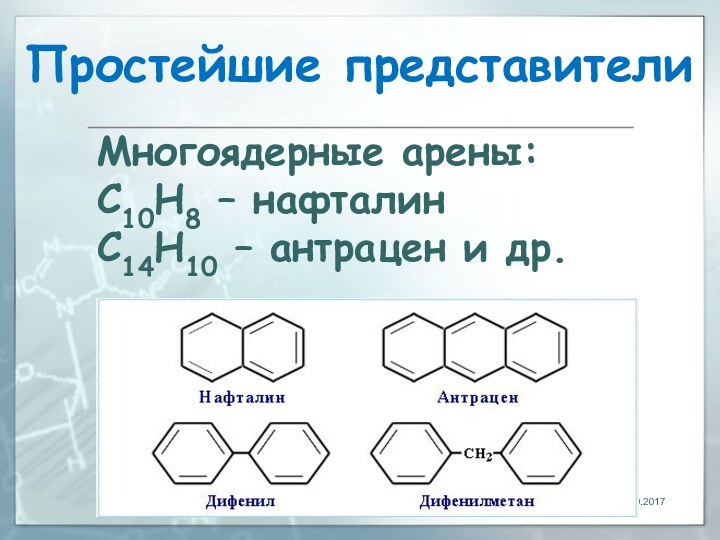
- 165. Простейшие представителиМногоядерные арены: С10Н8 – нафталинС14Н10 – антрацен и др.
- 166. Арены Ароматичность молекулы означает ее повышенную устойчивость,
- 167. Критерии ароматичности аренов:Атомы углерода в sp2-гибридизованном состоянии
- 168. Номенклатура ареновГомологи бензола – соединения, образованные заменой
- 169. Номенклатура ареновШироко используются тривиальные названия (толуол, ксилол,
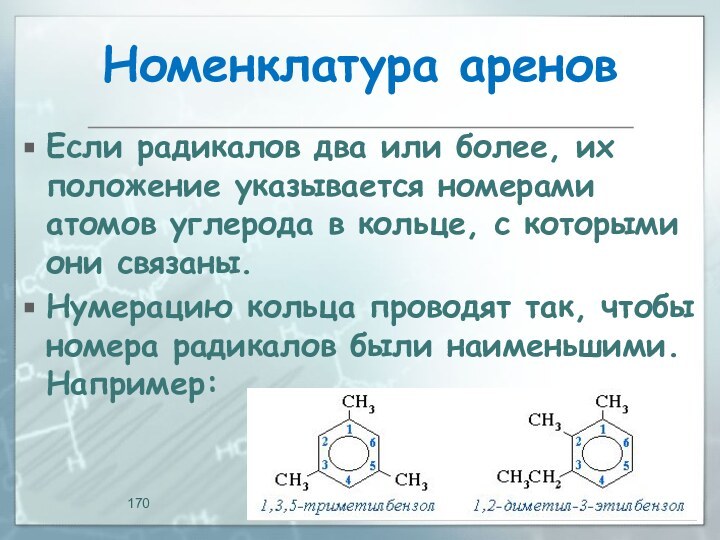
- 170. Номенклатура ареновЕсли радикалов два или более, их
- 171. Номенклатура ареновДля дизамещенных бензолов R-C6H4-R используется также
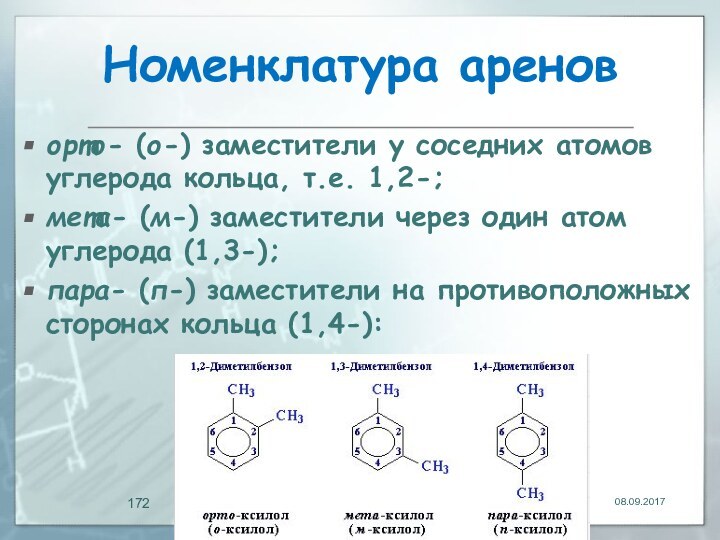
- 172. Номенклатура ареноворто- (о-) заместители у соседних атомов
- 173. Номенклатура ареновАроматические одновалентные радикалы имеют общее название
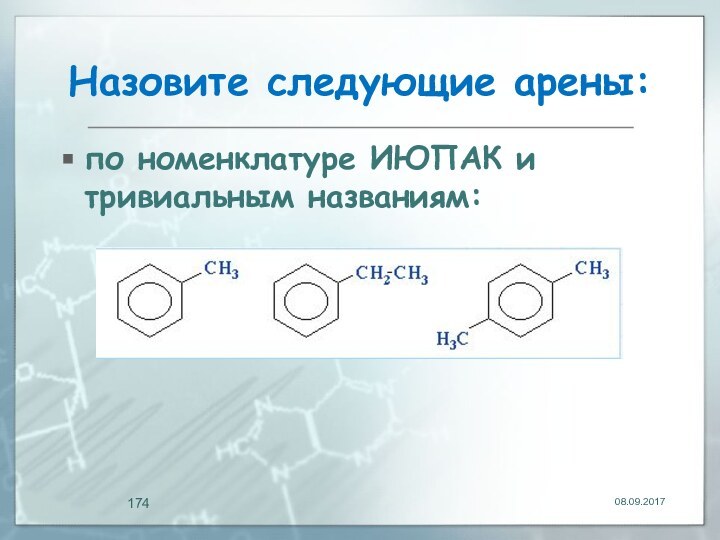
- 174. Назовите следующие арены:по номенклатуре ИЮПАК и тривиальным названиям:
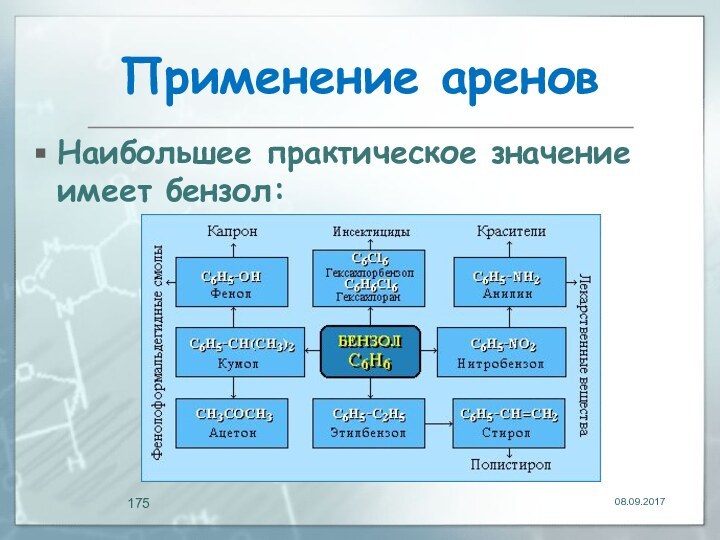
- 175. Применение аренов Наибольшее практическое значение имеет бензол:
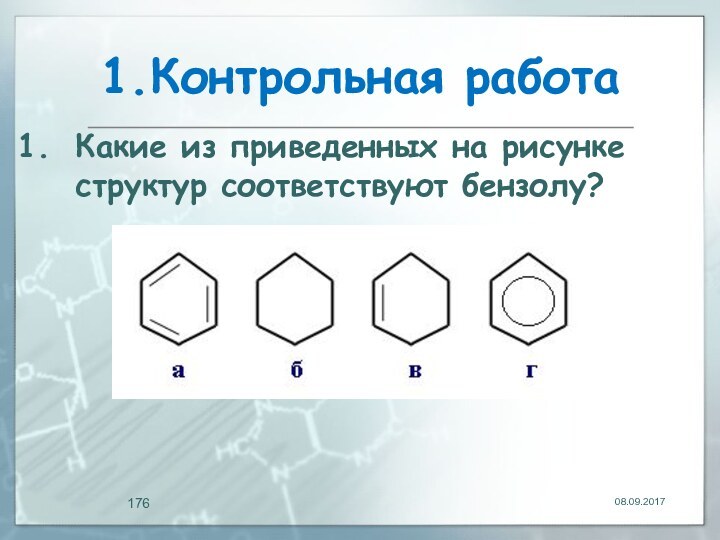
- 176. 1.Контрольная работаКакие из приведенных на рисунке структур соответствуют бензолу?
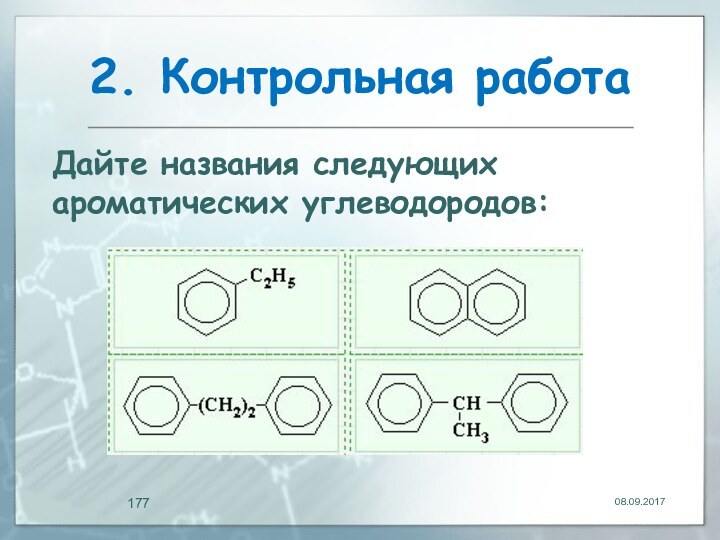
- 177. 2. Контрольная работаДайте названия следующих ароматических углеводородов:
- 178. 3.Контрольная работаКакой тип гибридизации характерен для атомов
- 179. 4. Контрольная работаНарисуйте следующие соединения:
- 180. Получение ареновПолучение и свойства бензола.Напишите уравнение реакции:(видеоролик exp6.exe в папке лабораторные опыты)
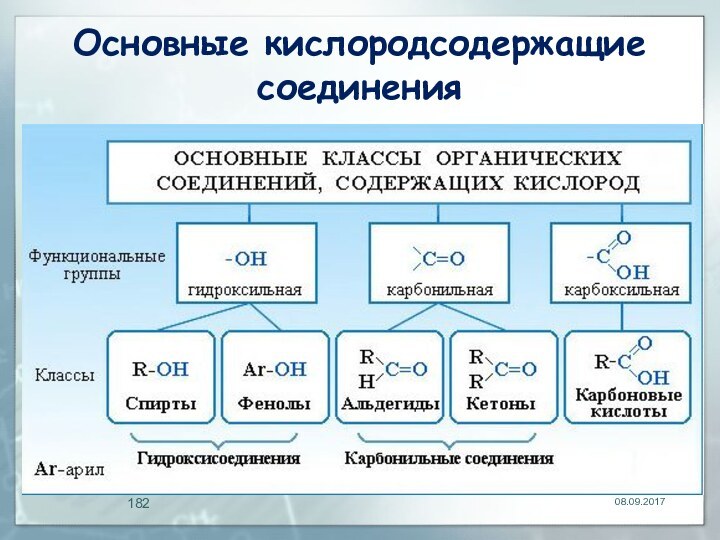
- 181. Кислородсодержащие органические соединенияизвестно большое число органических соединений,
- 182. Основные кислородсодержащие соединения
- 183. Функциональные группыHO–R–CHO - гидроксиальдегидыHO–R–CO–R’ - гидроксикетоныHO–R–COOH -
- 184. Строение кислородаКислород – элемент VI А группы
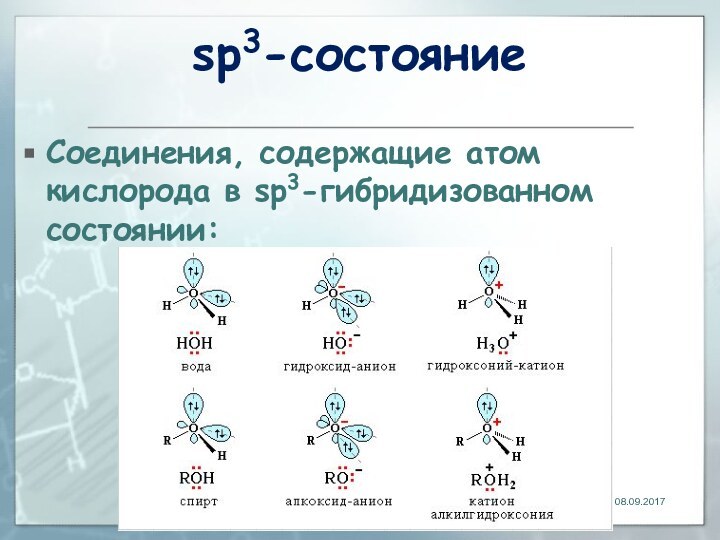
- 185. sp3-состояниеСоединения, содержащие атом кислорода в sp3-гибридизованном состоянии:
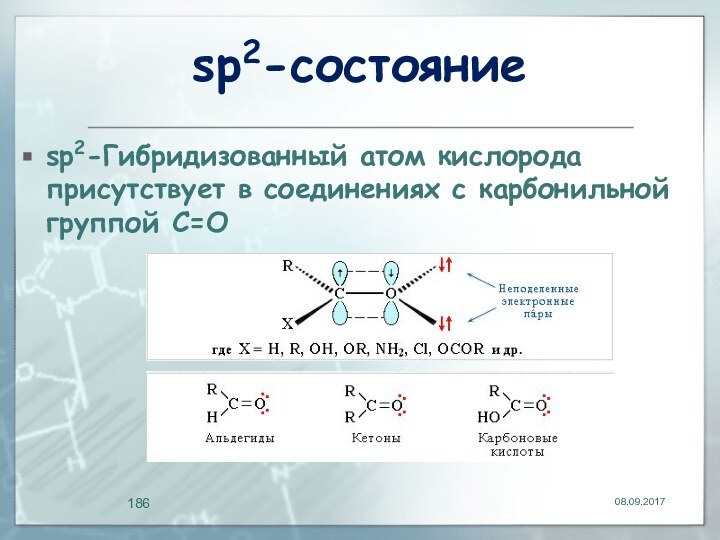
- 186. sp2-состояниеsp2-Гибридизованный атом кислорода присутствует в соединениях с карбонильной группой С=О
- 187. Гидроксисоединения вещества, содержащие одну или более гидроксильных
- 188. Спирты Спирты - соединения алифатического ряда, содержащие
- 189. Классификация спиртов1.По числу гидроксильных групп спирты подразделяются
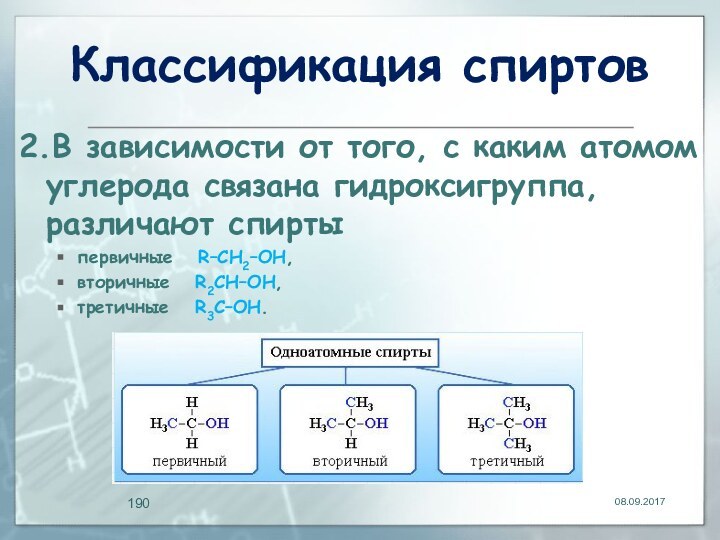
- 190. Классификация спиртов2.В зависимости от того, с каким
- 191. Классификация спиртов3. По строению радикалов, связанных с
- 192. Номенклатура спиртовСистематические названия даются по названию углеводорода
- 193. Номенклатура спиртовНумерация ведется от ближайшего к ОН-группе конца цепи:
- 194. Номенклатура спиртовВ многоатомных спиртах положение и число ОН-групп указывают суффиксами диол, триол и цифрами:
- 195. Номенклатура спиртовРадикально-функциональная номенклатура ИЮПАК, наличие функциональной группы
- 196. Номенклатура спиртовНазвания спиртов производят от названий радикалов с добавления слова спирт:
- 197. Назовите следующие спирты:CH3—OHCH3—CH2— OHCH3—CH2—CH2—OHCH3—CH2—CH2—CH2—OHCH3—CH2—CH2—CH2—CH2—OHCH3—CH2—CH2—CH2—CH2—CH2—OH
- 198. Фенолы гидроксисоединения, в молекулах которых ОН-группы связаны непосредственно с бензольным ядром:
- 199. Фенолы В зависимости от числа ОН-групп различают: одноатомные фенолы многоатомные. Среди многоатомных фенолов наиболее распространены двухатомные:
- 200. Номенклатура фенолов Одноатомные фенолы называются как производные от первого вещества этого ряда - фенола:
- 201. Номенклатура фенолов В названиях монозамещённых фенолов применяют
- 202. Номенклатура фенолов Для большинства многоатомных фенолов сохраняются тривиальные названия:
- 203. Образование сложных эфировСпирты вступают в реакции с
- 204. Образование сложных эфировНазвание сложного эфира образуется от
- 205. Простые эфиры Простыми эфирами называют органические вещества,
- 206. Простые эфиры Простые эфиры рассматриваются как производные
- 207. 1.Контрольная работаСоединение CH3–CHOH–CH2–CH3 относится к классу:
- 208. 2. Контрольная работаДайте названия следующих спиртов, полученных
- 209. 3. Контрольная работаВодород выделяется в реакции ...
- 210. Свойства спиртовВзаимодействие спирта и натрияНапищите уравнения реакций.(видеоролик op3.exe в папке лабораторные опыты-кислородсодержащие соединения)
- 211. Свойства спиртовОбразование глицерата меди.Напишите уравнение реакции:(видеоролик ор2.exe в папке лабораторные -опыты кислородсодержащие соединения)
- 212. Кислородсодержащие органические соединенияКарбонильными соединениями называют органические вещества,
- 213. Карбонильные соединенияВ зависимости от типа заместителя Х
- 214. Альдегидыорганические соединения, в молекулах которых атом углерода
- 215. Кетоны органические вещества, молекулы которых содержат карбонильную группу, соединенную с двумя углеводородными радикалами. Общие формулы: R2C=O, R–CO–R' или:
- 216. Кислородсодержащие соединения
- 217. Номенклатура альдегидовСистематические названия альдегидов строят по названию
- 218. Номенклатура альдегидовТривиальные названия производят от тривиальных названий тех кислот, в которые альдегиды превращаются при окислении:
- 219. Номенклатура кетоновСистематические названия кетонов несложного строения производят
- 220. Номенклатура кетоновВ более общем случае название кетона
- 221. Назовите следующие соединения:CH3—СO—С4H9CH3—CH2— СOHCH3—CH2—CH2—СOHCH3—CH2—CH2—CH2—СOHCH3—CH2—CH2—CH2—CH2—СOHCH3—CH2—CH2—CH2—CH2—CH2—СOHCH3—CH2—СO—CH2—CH3
- 222. 1.Контрольная работаСоединение CH3–CO–CH2–CH3 относится к классу:
- 223. 2. Контрольная работаДайте названия следующих альдегидов, полученных
- 224. Свойства альдегидовОкисление бензальдегида аммиачным раствором серебраНапищите уравнения реакций.(видеоролик op6.exe в папке лабораторные опыты-кислородсодержащие соединения)
- 225. Скачать презентацию
- 226. Похожие презентации
Классификация

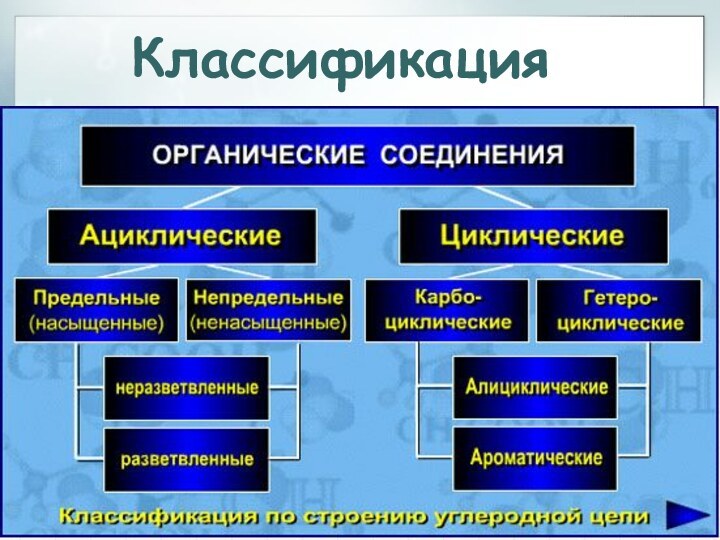







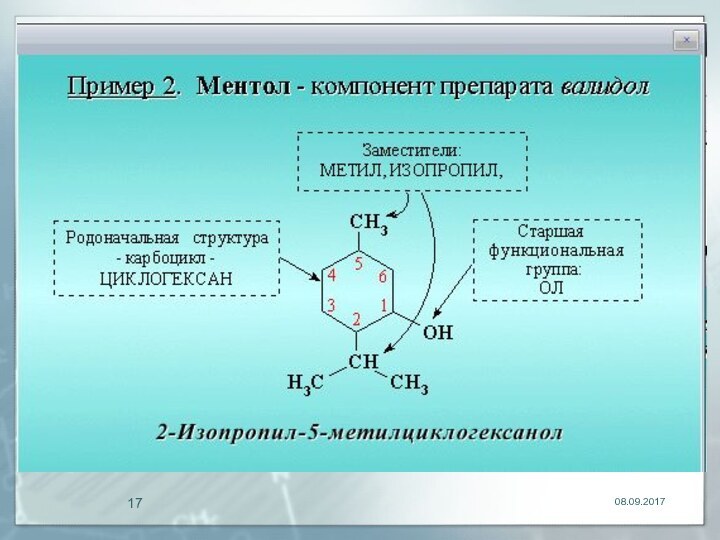


































































































































































Слайд 26
Электроотрицательность
Способность атома удерживать внешние валентные электроны
Подчиняется периодическому
закону: растет слева направо в периодах и снизу вверх
в главных подгруппах в таблице Д.И. Менделеева
Слайд 27
Ковалентная связь
Связь, образованная путём обобществления пары электронов связываемых
атомов
Слайд 29
Направленность
Молекулярное строение органических молекул имеет геометрическую форму.
Количественной мерой
направленности является угол между двумя связями (валентный угол)
Слайд 30
Насыщаемость
Способность атомов образовывать ограниченное число ковалентных связей.
Количество
связей определяется числом внешних атомных орбиталей атома.
Слайд 31
Полярность
Обусловлена неравномерным распределением электронной плотности вследствии различной
электро-отрицательности атомов по шкале Л.Полинга:
Слайд 32
Полярность
Ковалентные связи делятся на полярные и неполярные.
Неполярные связи между двумя одинаковыми атомами:
Н—Н, С—С.
Слайд 34
Поляризуемость
Смещение электронов под воздействием внешнего электрического поля
другой частицы.
Слайд 35
Длина связи
Расстояние между центрами двух связанных атомов.
На
характеристики связей влияет их кратность
Слайд 36
Энергия связи
Энергия, выделяемая при образовании связи или
необходимая для разъединения двух связанных атомов
Слайд 37
Дипольный момент (μ или D)
Величина, характеризующая полярность
связи:
l – длина связи
q – эффективный заряд
Слайд 44
Механизмы образования связи
Cвязь между атомами возникает при перекрывании
их атомных орбиталей с образованием молекулярных орбиталей (МО).
Различают
два механизма образования ковалентной связи:обменный;
донорно-акцепторный
Слайд 45
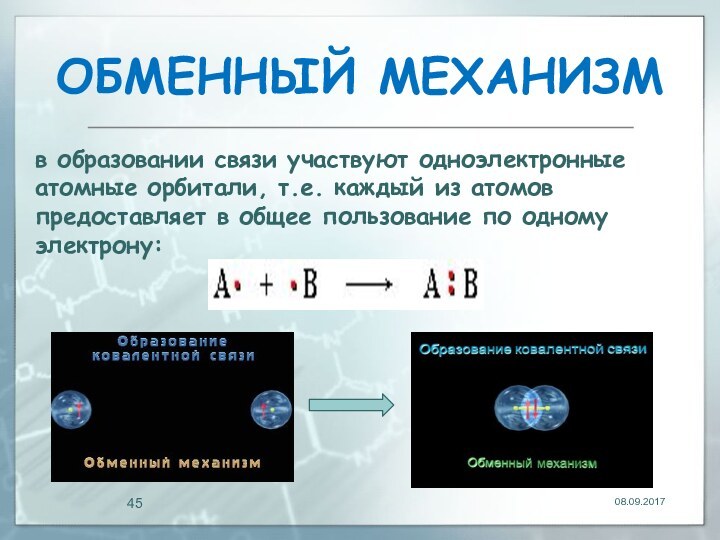
ОБМЕННЫЙ МЕХАНИЗМ
в образовании связи участвуют одноэлектронные атомные орбитали,
т.е. каждый из атомов предоставляет в общее пользование по
одному электрону:
Слайд 46
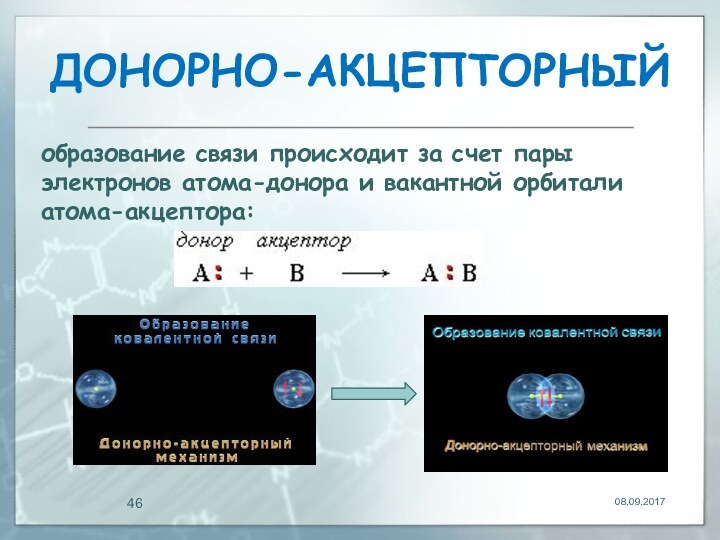
ДOНОРНО-АКЦЕПТОРНЫЙ
образование связи происходит за счет пары электронов атома-донора
и вакантной орбитали атома-акцептора:
Слайд 47
Донорно-акцепторные связи
Ковалентная связь, образующаяся за счет пары электронов
одного из атомов, т.е. по донорно-акцепторному механизму, называется дoнорно-акцeпторной
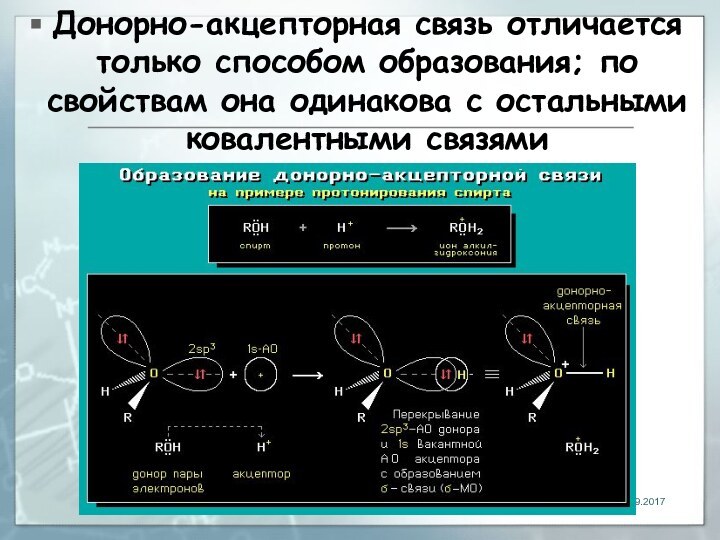
Слайд 48 Донорно-акцeпторная связь отличается только способом образования; по свойствам
она одинакова с остальными ковалентными связями
Слайд 49
Кратные связи
образуются при обобществлении двумя атомами более чем
одной пары электронов:
Н2С : : СН2; R2С :
: О; HС : : : CH; RС : : : N
Слайд 50
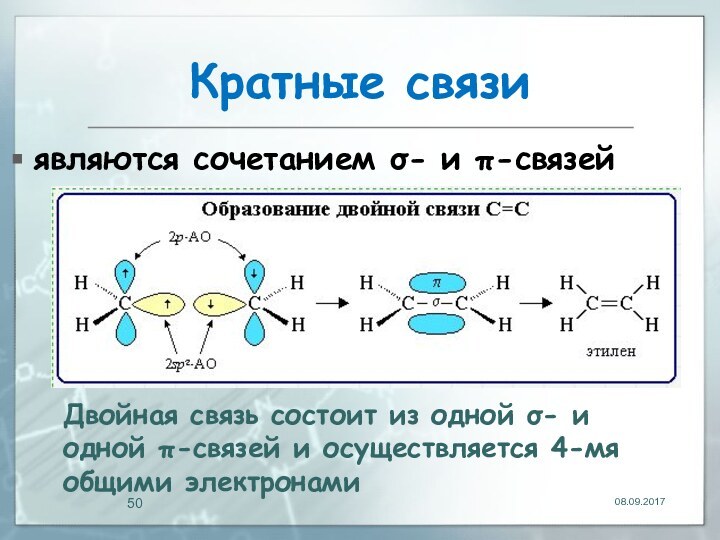
Кратные связи
являются сочетанием σ- и π-связей
Двойная связь состоит
из одной σ- и одной π-связей и осуществляется 4-мя
общими электронами
Слайд 51
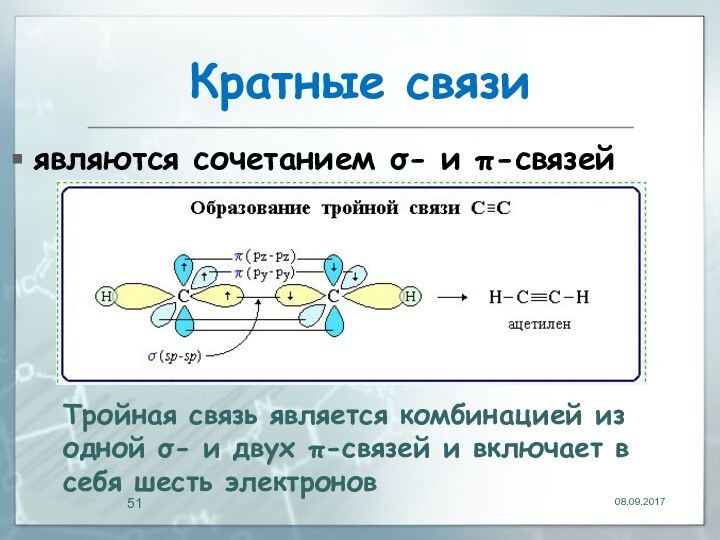
Кратные связи
являются сочетанием σ- и π-связей
Тройная связь является
комбинацией из одной σ- и двух π-связей и включает
в себя шесть электронов
Слайд 52
Кратные связи
Число электронных пар, участвующих в образовании ковалентной
связи называется порядком связи.
порядок простой связи равен 1,
двойной - 2,
тройной - 3
Слайд 53
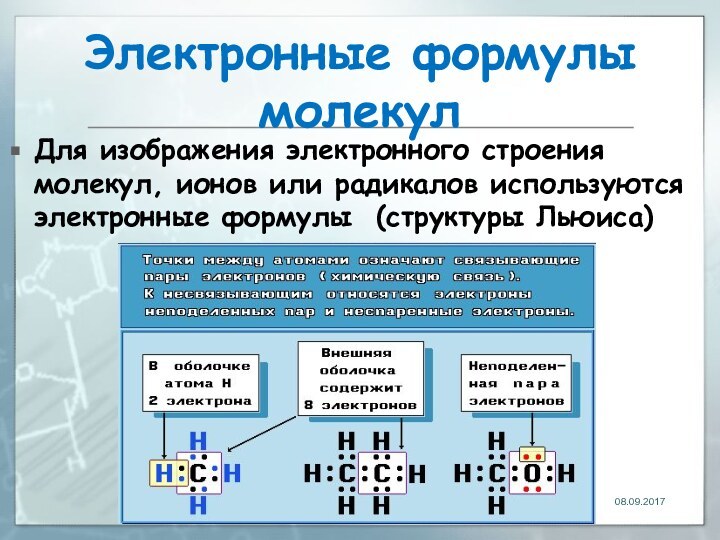
Электронные формулы молекул
Для изображения электронного строения молекул, ионов
или радикалов используются электронные формулы (структуры Льюиса)
Слайд 54
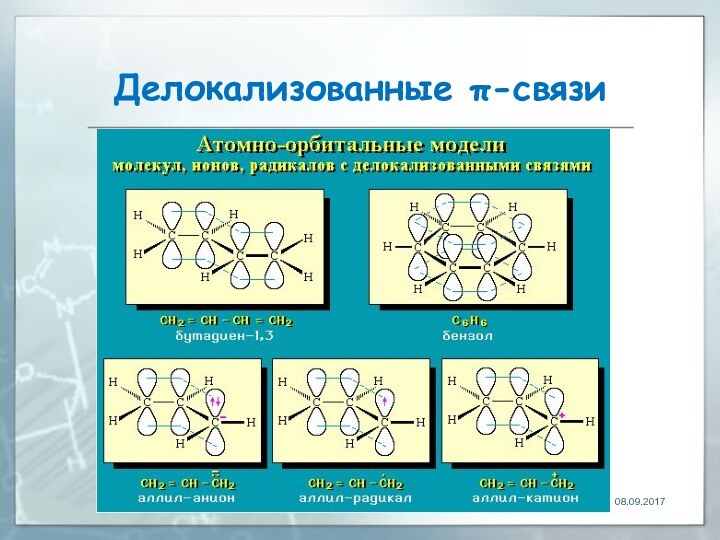
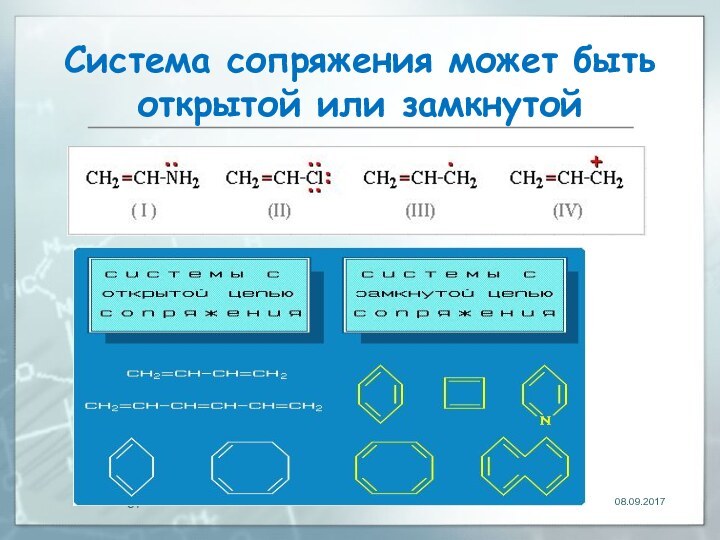
Делокализованные π-связи. Сопряжение
связь, электронная пара которой рассредоточена между
несколькими (более 2) ядрами атомов
Слайд 55
Делокализованные π-связи
Рассредоточение электронов - энергетически выгодный процесс, т.к.
приводит к снижению энергии молекулы
Слайд 59
Водородные связи (Н-связи)
Атом водорода, связанный с электро-отрицательным элементом
(азотом, кислородом, фтором и др.), испытывает недостаток электронов и
способен взаимодействовать с неподелённой парой электронов другого электроотрицательного атома.В результате возникает водородная связь, которая графически обозначается тремя точками:
Слайд 60
Водородные связи (Н-связи)
Эта связь значительно слабее других химических
связей (энергия ее образования 10-40 кДж/моль) и в основном
определяется электростатическим и донорно-акцепторным взаимодействиями:
Слайд 61
Образование водородных связей
В молекуле спирта R-O-H химическая
связь между атомом водорода и более электроотрицательным атомом кислорода
весьма полярна. Водород имеет частичный положительный заряд (δ+), а кислород - частичный отрицательный (δ-):
Слайд 62
Образование водородных связей
Следовательно, возможно образование водородных связей
между молекулами спирта:
Слайд 63
Образование водородных связей
Это приводит к ассоциации молекул
и объясняет относительно высокую т.кип. спиртов:
Слайд 64
Образование водородных связей
В присутствии воды возникают водородные
связи между молекулами спирта и воды:
Слайд 65
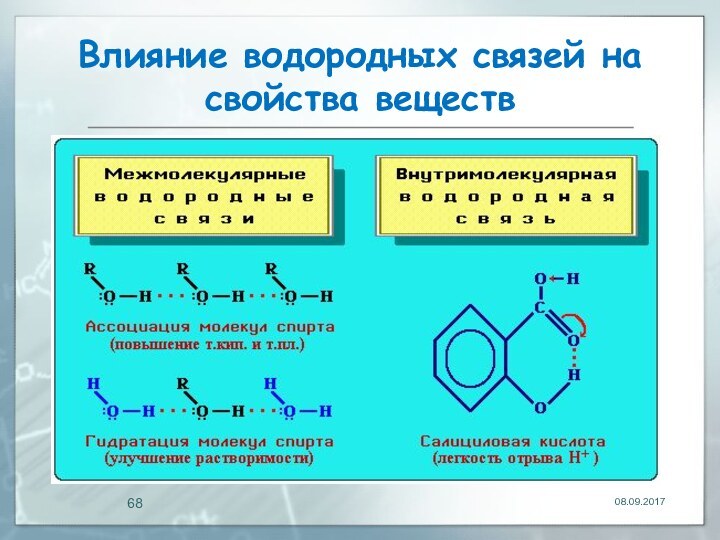
Влияние водородных связей на свойства веществ
Межмолекулярные водородные связи
обусловливают ассоциацию молекул, что приводит к повышению температур кипения
и плавления вещества.Например, этиловый спирт C2H5OH, способный к ассоциации, кипит при +78,3°С, а диметиловый эфир СН3ОСН3, не образующий водородных связей, лишь при 24°С (молекулярная формула обоих веществ С2Н6О).
Слайд 66
Влияние водородных связей на свойства веществ
Образование Н-связей с
молекулами растворителя способствует улучшению растворимости.
Так, метиловый и этиловый
спирты (CH3OH, С2Н5ОН), образуя Н-связи с молекулами воды, неограниченно в ней растворяются.
Слайд 67
Влияние водородных связей на свойства веществ
Внутримолекулярная водородная связь
образуется при благоприятном пространственном расположении в молекуле соответствующих групп
атомов и специфически влияет на свойства.Например, Н-связь внутри молекул салициловой кислоты повышает ее кислотность.
Слайд 70
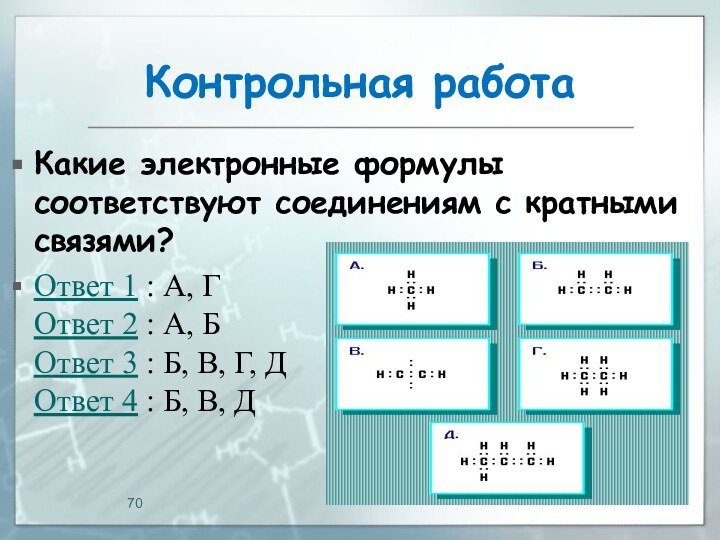
Контрольная работа
Какие электронные формулы соответствуют соединениям с кратными
связями?
Ответ 1 : А, Г
Ответ 2 : А, Б
Ответ
3 : Б, В, Г, Д
Ответ 4 : Б, В, Д
Слайд 71
Контрольная работа
В каких молекулах имеются делокализованные p-связи?
а) CH2=CH-CH2-CH=CH2
б) CH2=CH-CH=CH2
в) CH2=CH2
Ответ 1 : а, б
Ответ
2 : б, в
Ответ 3 : б
Ответ 4 : а
Слайд 72
Контрольная работа
Укажите соединения, в которых есть атомы водорода,
способные к образованию водородной связи:
а) CH3-O-CH3
б) CH3-NH2
в)
CH3-CH3 г) CH3-OH
Ответ 1 : а, г Ответ 2 : б, г Ответ 3 : а, б, г Ответ 4 : б, в, г
Слайд 73
Взаимное влияние атомов
Взаимное влияние атомов в молекуле, ионе,
радикале осуществляется под влиянием электронных и пространственных эффектов.
Это позволяет
определить реакционную способность органических соединений.
Слайд 74
Заместители -
любой атом (кроме водорода), который непосредственно
не участвует в реакции, но оказывает влияние на реагирующую
часть молекулы: на положение и активность реагирующего центра.
Слайд 75
Электронные эффекты
Смещение электронной плотности в молекуле, ионе, радикале
под влияние заместителей, подразделяются на:
- электронодонорные;
- электроноакцепторные.
Слайд 76
Электронодонорные заместители
атомная группировка (или атом), повышающая электронную плотность
на остальной части молекулы
Слайд 77
Электроноакцепторные заместители
атомная группировка (или атом), понижающая электронную плотность
на связанном с ним углеводородном фрагменте
Слайд 78
Электроноакцепторные заместители
Два вида влияний заместителей:
индуктивный эффект (±I);
мезомерный эффект
(±M).
В зависимости от смещения плотности различают положительные и отрицательные
эффекты.
Слайд 79
Индуктивный эффект
Передача по цепи сигма-связей электронного влияния заместителей,
которое обусловлено различиями в электроотрицательности атомов
Слайд 80
Индуктивный эффект
Направление смещения электронной плотности σ-связей обозначается стрелками
и символами частичных зарядов (δ+ или δ-)
Слайд 81
Индуктивный эффект
Из-за слабой поляризуемости σ-связей I-эффект быстро ослабевает
с удалением заместителя и через 3-4 связи практически равен
нулю.В зависмости от смещения наблюдают положительные +I-эффекты и олтрицательные -I-эффекты.
I-эффект водорода равен нулю.
Слайд 82
-I-эффект
Проявляет заместитель, уменьшающий электронную плотность
Заместитель приобретает частичный отрицательный
заряд, атом углерода – положительный.
Слайд 83
+I-эффект
Проявляет заместитель, увеличива-ющий электронную плотность
Заместитель приобретает частичный положительный
заряд, атом углерода – отрицательный.
Слайд 84
Мезомерный эффект
Передача электронного влияния заместителей по сопряжённой π-системе.
Благодаря
подвижности π-электронов передаётся по цепи без затухания
Слайд 86
Правило 1.
Величина М-эффекта растет с увеличением заряда заместителя.
Ионы проявляют наиболее сильный М-эффект:
Слайд 87
Правило 2
-М-эффект заместителей тем сильнее, чем больше электроотрицательность
имеющихся в заместителе элементов:
Слайд 88
Правило 3
Группа С=О в этом случае связана с
группировками, +М-эффект которых в ряду O-, NH2, OH, OR
уменьшается и, наконец, для CH3 и Н – равен нулю.
Слайд 89
Правило 3
В хлорацильной группе -С(О)Cl атом хлора проявляет
+М-эффект, однако он значительно слабее -I-эффекта
мезомерное взаимодействие невелико
вследствие относительно малой степени перекрывания существенно различаю-щихся орбиталей – 2р-АО sp2-гибридизованного атома углерода и 3р-АО хлора
Слайд 90
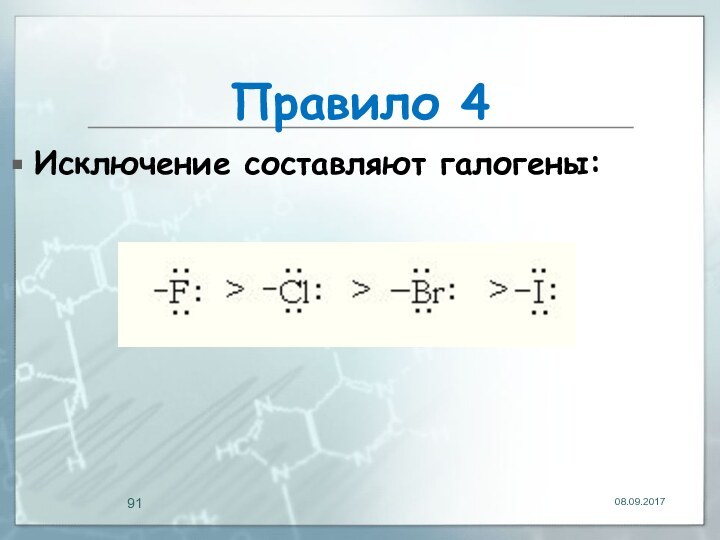
Правило 4
+М-эффект заместителя тем сильнее, чем меньше электроотрицательность
гетероатома, входящего в его состав:
Слайд 92
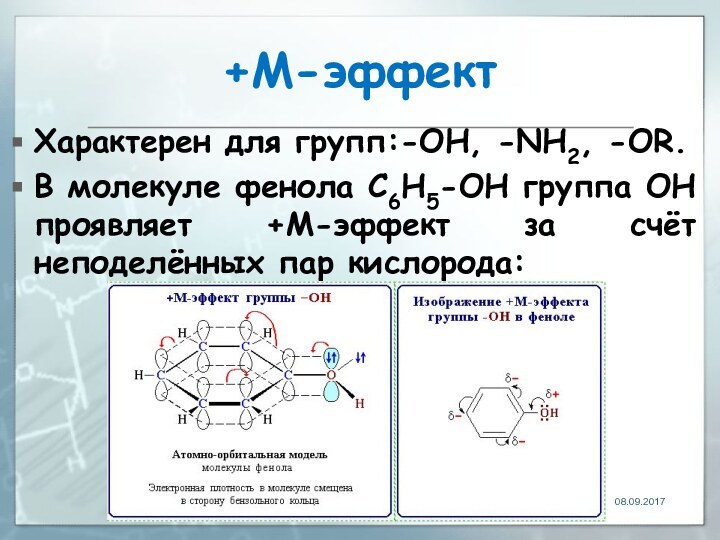
+М-эффект
Характерен для групп:-OH, -NH2, -OR.
В молекуле фенола C6H5-OH
группа ОН проявляет +М-эффект за счёт неподелённых пар кислорода:
Слайд 93
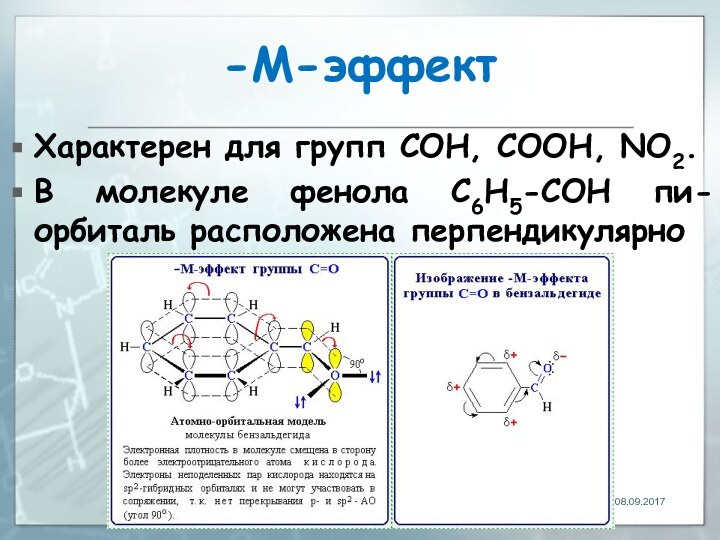
-М-эффект
Характерен для групп СOH, СООН, NО2.
В молекуле фенола
C6H5-СOH пи-орбиталь расположена перпендикулярно
Слайд 94
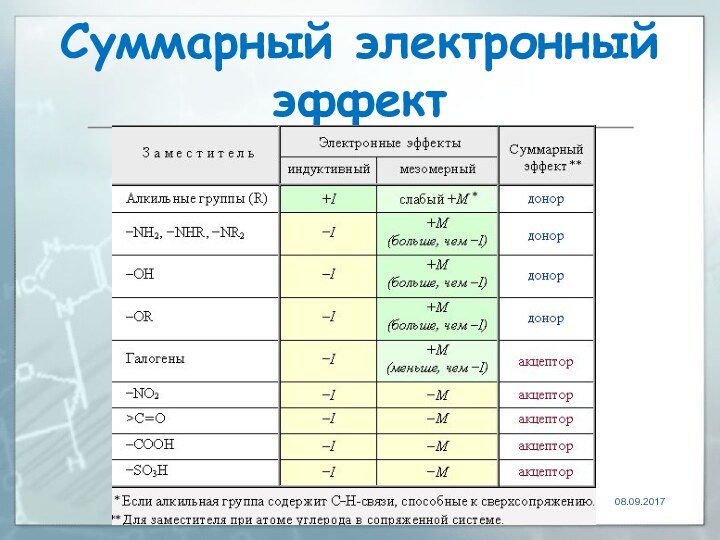
Суммарный электронный эффект
В случае противоположной направленности индуктивного и
мезомерного эффектов общее действие заместителя определяется более сильным эффектом.
Слайд 95
Суммарный электронный эффект
в молекуле анилина аминогруппа NH2 одновременно
проявляет -I-эффект (за счет большей электроотрицательности атома азота по
сравнению с углеродом) и +М-эффект (за счет участия неподеленной пары электронов в системе p-сопряжения):
Слайд 97
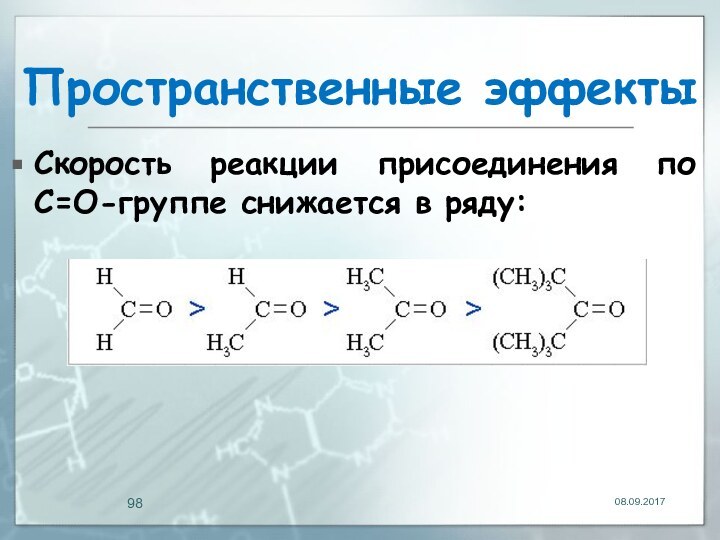
Пространственные эффекты
(стерические) эффекты определяют доступность реакционных центров в
молекуле.
Объёмные группы могут блокировать центры в молекуле и снижать
её реакционную способность.
Слайд 101
Углеводороды
органические соединения, в состав которых входят только два
элемента: углерод и водород.
CH4, C2H6, C3H6, C6H6, C8H10 и
т.п. В общем виде - СxHy.
Слайд 102
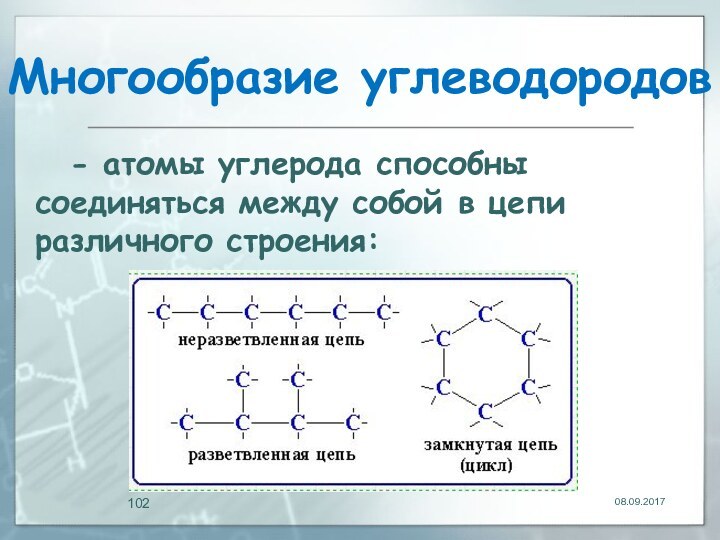
Многообразие углеводородов
- атомы углерода способны соединяться между
собой в цепи различного строения:
Слайд 103
Многообразие углеводородов
- даже при одинаковом количестве атомов
углерода в молекулах углеводороды могут отличаться числом атомов водорода:
C6H14, C6H12, C6H10, C6H8, C6H6
Слайд 104
Многообразие углеводородов
- одному и тому же элементному
составу молекул (одной молекулярной формуле) может соответствовать несколько различных
веществ – изомеров:
Слайд 105
Многообразие углеводородов
Классификацию углеводородов проводят по следующим структурным
признакам, определяющим свойства этих соединений:
- строение углеродной цепи
(углеродного скелета); - наличие в цепи кратных связей С=С и С≡C (степень насыщенности)
Слайд 106
Классификация углеводородов
1. В зависимости от строения углеродной
цепи углеводороды подразделяют на две группы:
- ациклические или
алифатические; - циклические
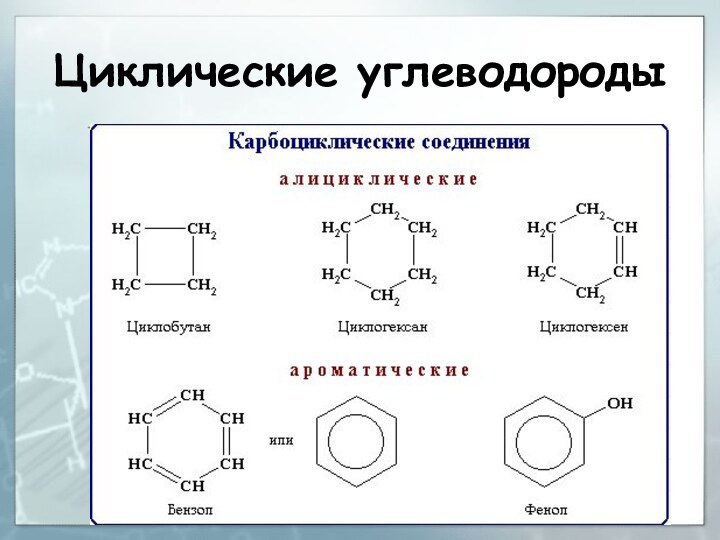
Слайд 107
Классификация углеводородов
Среди циклических углеводородов выделяют:
-
алициклические (т.е. алифатические циклические);
- ароматические (арены).
В
этом случае классификаци-онным признаком служит строение цикла.
Слайд 108
Классификация углеводородов
2. По степени насыщенности различают:
насыщенные
(предельные) углеводороды (алканы и циклоалканы);
ненасыщенные (непредельные), содержащие наряду
с одинарными связями С-С двойные и/или тройные связи (алкены, алкадиены, алкины, циклоалкены, циклоалкины)
Слайд 110
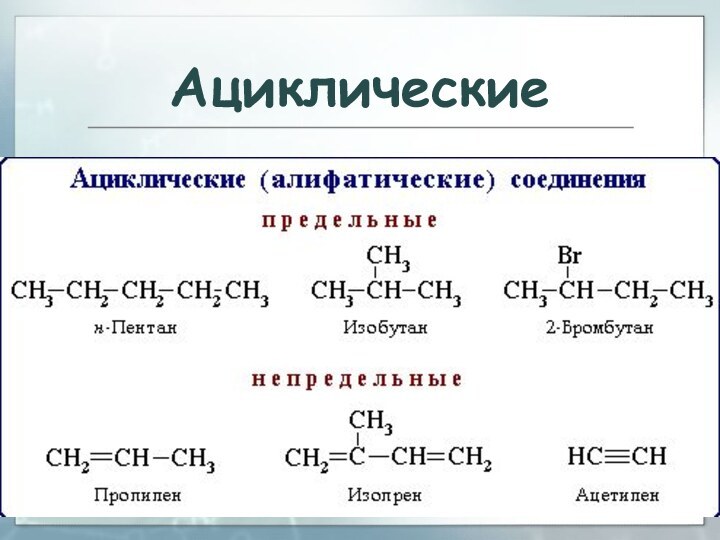
Алканы
алифатические (ациклические) предельные углеводороды, в которых атомы
углерода связаны между собой простыми (одинарными) связями в неразветвленные
или разветвленные цепи:
Слайд 111
Алканы
Алканы – название предельных углеводородов по международной
номенклатуре. Парафины – исторически сложившееся название, отражающее свойства этих
соединений. Предельными, или насыщенными, эти углеводороды называют в связи с полным насыщением углеродной цепи атомами водорода.
Слайд 112
Алканы
углеводороды, состав которых выражается общей формулой CnH2n+2,
где n – число атомов углерода
Слайд 113
Приемы построения структурных формул изомеров
1. Сначала изображаем молекулу
линейного изомера (ее углеродный скелет) на примере алкана С6Н14:
Слайд 114
Приемы построения структурных формул изомеров
2. Затем цепь сокращаем
на 1 атом углерода и этот атом присоединяем к
какому-либо атому углерода цепи как ответвление от нее, исключая крайние положения:
Слайд 115
Приемы построения структурных формул изомеров
3. Когда все положения
основной цепи исчерпаны, сокращаем цепь еще на 1 атом
углеродаТеперь в боковых ответвлениях разместятся 2 атома углерода:
Слайд 116
Приемы построения структурных формул изомеров
4. После построения углеродного
скелета изомера необходимо дополнить все углеродные атомы в молекуле
связями с водородом - С6Н14 соответствует 5 изомеров :
Слайд 117
Номенклатура
Номенклатура органических соединений – система правил, позволяющих
дать однозначное название каждому индивидуальному веществу.
В настоящее время общепринятой
является систематическая номенклатура ИЮПАК (IUPAC – International Union of the Pure and Applied Chemistry – Международный союз теоретической и прикладной химии)
Слайд 118
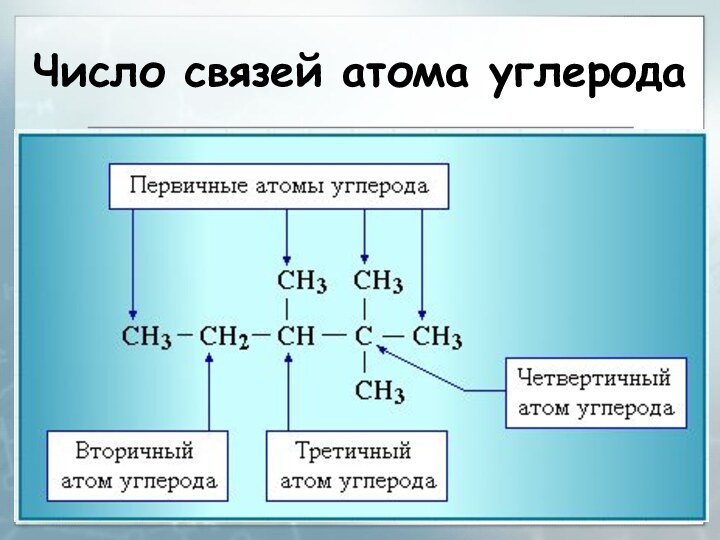
Радикалы в ряду алканов
Общее название одновалентных радикалов алканов
– алкилы – обpазовано заменой суффикса -ан на -ил:
метан – метил, этан – этил, пpопан – пpопилОдновалентные pадикалы выpажаются общей фоpмулой СnН2n+1 :
Слайд 120
Правила построения названий
1. Для простейших алканов (С1-С4) приняты
тpивиальные названия:
метан, этан, пpопан, бутан, изобутан.
2. Начиная
с пятого гомолога, названия нормальных (неpазветвленных) алканов стpоят в соответствии с числом атомов углеpода, используя гpеческие числительные и суффикс -ан: пентан, гексан, гептан, октан, нонан, декан и т.д.
Слайд 121
Правила построения названий
3.В основе названия разветвленного алкана лежит
название входящего в его конструкцию нормального алкана с наиболее
длинной углеродной цепью.При этом углеводоpод с pазветвленной цепью pассматpивают как пpодукт замещения атомов водоpода в ноpмальном алкане углеводоpодными pадикалами.
Слайд 122
Правила построения разветвлённых алканов
корень+суффикс – название нормального алкана,
приставки – цифры и названия углеводородных радикалов.
Пример построения названия:.
Слайд 123
1.Контрольная работа
1. Состав алканов отражает общая формула .
. .
а)CnH2n б) CnH2n+2 в) CnH2n-2 г) CnH2n-6
Варианты ответов (выберите правильный):
Ответ 1: формула а
Ответ 2: формула б
Ответ 3: формула в
Ответ 4: формула г
Слайд 124
2. Контрольная работа
Какие соединения относятся к гомологическому ряду
метана:
а) С2Н4 б) С3Н8 в) С4Н10
г) С5Н12
д) С7Н14 ? Ответ 1: соединения а, в, г Ответ 2: соединения б, г, д Ответ 3: соединения б, в, г Ответ 4: соединения г, д
Слайд 125
3. Контрольная работа
Укажите названия углеводородных радикалов:
Ответ 1: а
- н-пропил; б - н-бутил; в - изобутил; г - втор-бутил; д -
изопропил; е - трет-бутил. Ответ 2: а - изопропил; б - н-бутил; в - втор-бутил; г - изобутил; д - н-пропил; е - трет-бутил. Ответ 3: а - изопропил; б - н-пропил; в - изобутил; г - трет-бутил; д - н-бутил; е - втор-бутил
Слайд 127
Химические свойства алканов
определяются его строением, т.е. природой
входящих в его состав атомов и характером связей между
ними.Исходя из справочных данных о связях С–С и С–Н, можно предсказать, какие реакции характерны для алканов
Слайд 128
Химические свойства алканов
1. предельная насыщенность алканов не
допускает реакций присоединения, но не препятствует реакциям разложения, изомеризации
и замещения.
Слайд 129
Химические свойства алканов
2. симметричность неполярных С–С и
слабополярных С–Н ковалентных связей (см. значения дипольных моментов в
табл. 2.5.1) предполагает их гомолитический (симметричный) разрыв на свободные радикалы
Слайд 130
Крекинг алканов
реакции расщепления углеродного скелета крупных молекул при
нагревании и в присутствии катализаторов.
Два вида крекинга:
-
термический (без доступа воздуха)- каталитический
Слайд 131
Галогенопроизводные алканов (галогеналканы)
Галогенопроизводные алканов широко применяются для синтеза
алканов с заданным строением молекул.
Для этого используется реакция
взаимодействия их с активными металлами (реакция Вюрца-получение чётных алканов):
Слайд 132
Галогенопроизводные алканов (галогеналканы)
Чтобы получить алкан с нечётным количеством
атомов углерода потребуется два различных галогеналкана:
Слайд 133
Нуклеофильное
замещение (SN)
положительно заряженный углеродный атом, связанный с
галогеном, является центром атаки нуклефофильными частицами (OH-, OR-, CN-,
NH2- и др.) :
Слайд 134
Механизм-1 (SN1) - двухстадийный
Cтадия 1. Алкилгалогенид, отщепляя галоген
(электролитическая диссоциация), превращается в карбокатион:
Стадия 1 является лимитирующей. Поскольку
в ней участвует только одна частица
Слайд 135
Механизм-1 (SN1) - двухстадийный
Cтадия 2. Карбокатион взаимодействует с
нуклеофилом (донором пары электронов) с образованием конечного продукта:
Слайд 136
Механизм-2 (SN2) - одностадийный
заключается в практически одновременном отщеплении
галогенид-иона и присоединении гидроксид-аниона (без образования карбокатиона):
Слайд 137
Получение алканов
Алканы выделяют из природных источников:
- природный
и попутный газы,
- нефть,
- каменный уголь.
Используются
также синтетические методы.
Слайд 138
1. Контрольная работа
Дайте названия радикалам следующих алканов:
-
пропан
- декан
- октан
- этан
- пентан
- гексан
Слайд 139
2.Контрольная работа
Напишите процесс расщепления для следующих алканов, используя
общую формулу крекинга
- октан
- декан
- гептан
Слайд 140
Алкены
(этиленовые углеводороды, олефины) - непредельные алифатические
углеводороды, молекулы которых содержат двойную связь.
Общая формула ряда
алкенов:
Слайд 142
Алкены
В отличие от предельных углеводородов, алкены содержат
двойную связь С=С, которая осуществляется 4-мя общими электронами:
В
образовании такой связи участвуют атомы углерода в sp2-гибридизованном состоянии
Слайд 143
Номенклатура алкенов
названия алкенов производят от названий соответствующих алканов
(путем замены суффикса –ан на –ен:
2 атома С
→ этан → этен;
3 атома С →пропан → пропен Главная цепь выбирается таким образом, чтобы она обязательно включала в себя двойную связь.
Слайд 144
Номенклатура алкенов
Нумерацию углеродных атомов начинают с ближнего к
двойной связи конца цепи.
Цифра, обозначающая положение двойной связи,
ставится обычно после суффикса –ен. Например:
Слайд 145
Номенклатура алкенов
В номенклатуре различных классов органических соединений наиболее
часто используются следующие одновалентные радикалы алкенов:
Слайд 146
Номенклатура алкенов
Назовите следующие алкены:
CH2=CH2
CH3—CH=CH2
CH3—CH3—CH=CH2
CH3—CH=CH—CH3
CH2=CH—CH=CH2
CH3—CH=CH2
|
CH3
Слайд 147
Применение алкенов
Этилен (этен) Н2С=СН2 используется для получения
многих органических соединений.
Слайд 149
2. Контрольная работа
Дайте названия следующих алкенов, полученных из
алканов:
- пропан
- декан
- октан
- этан
- пентан- гексан
Слайд 150
3.Контрольная работа
Назовите соединение:
Ответ 1: 3-метил-4-этилпентен-2
Ответ 2: 3-метил-2-этилпентен-3
Ответ 3: 3,4-диметилгексен-2
Ответ 4: 2-этил-3-метилпентен-2
Слайд 151
4. Контрольная работа
Двойная связь является сочетанием . .
.
Ответ 1: двух σ-связей
Ответ 2: двух π-связей
Ответ 3: одной σ-связи и одной π-связи
Ответ 4: ионной связи и ковалентной связи
Слайд 152
6. Контрольная работа
Какова гибридизация атомов углерода в молекуле
алкена:
Ответ 1: 1 и 4 – sp2, 2 и
3 – sp3
Ответ 2: 1 и 4 – sp3, 2 и 3 – sp2
Ответ 3: 1 и 4 – sp3, 2 и 3 – sp
Ответ 4: 1 и 4 – не гибридизованы, 2 и 3 – sp2
Слайд 153
Алкины
Алкины (ацетиленовые углеводороды) – непредельные алифатические
углеводороды, молекулы которых содержат одну тройную связь.
Общая формула алкинов:
Слайд 155
Алкины
Тройную связь осуществляют шесть общих электронов:
В
образовании тройной связи участвуют атомы углерода в sp-гибридизованном состоянии.
Слайд 156
Номенклатура алкинов
названия алкинов производят от названий соответствующих алканов
(путем замены суффикса –ан на –ин:
2 атома С
→ этан → этин;
3 атома С →пропан → пропин Главная цепь выбирается таким образом, чтобы она обязательно включала в себя тройную связь.
Слайд 157
Номенклатура алкинов
Нумерацию углеродных атомов начинают с ближнего к
тройной связи конца цепи.
Цифра, обозначающая положение тройной связи,
ставится обычно после суффикса –ин.Например:
Слайд 158
Номенклатура алкинов
Для простейших алкинов применяются исторически сложившиеся названия:
ацетилен (этин), аллилен (пропин), кротонилен (бутин-1), валерилен (пентин-1).
В номенклатуре
наиболее часто используются следующие одновалентные радикалы алкинов:
Слайд 159
Назовите следующие алкины:
CH2≡CH2
CH3—CH ≡ CH2
CH3—CH3—CH ≡ CH2
CH3—CH ≡
CH—CH3
CH2 ≡ CH—CH=CH2
CH3—CH ≡ CH2
|
CH3
Слайд 160
Применение алкинов
Наибольшее практическое значение имеют ацетилен и
винилацетилен (бутен-3-ин-1).
Слайд 161
1.Контрольная работа
Тройная связь является сочетанием:
Ответ 1 : трех
σ-связей Ответ 2 : одной σ- и двух π-связей
Ответ 3 : двух σ- и одной π -связи Ответ 4 : трех π-связей
Слайд 162
4. Контрольная работа
Какова гибридизация атомов углерода в следующей
молекуле:
Ответ 1 : 1 – sp, 2 – sp,
3 – sp2, 4 – sp2, 5 – sp3
Ответ 2 : 1 – sp, 2 – sp2, 3 – sp2, 4 – sp, 5 – sp3
Ответ 3 : 1 – sp3, 2 – sp, 3 – sp, 4 – sp2, 5 – sp2
Ответ 4 : 1 – sp2, 2 – sp3, 3 – sp3, 4 – sp, 5 – sp
Слайд 163
АРЕНЫ
(ароматические углеводороды)
соединения, молекулы которых содержат устойчивые
циклические группы атомов (бензольные ядра) с особым характером химических
связей.Общая формула алкинов:
Слайд 166
Арены
Ароматичность молекулы означает ее повышенную устойчивость, обусловленную
делокализацией π-электронов в циклической системе.
Термин "ароматические соединения" возник давно
в связи с тем, что некоторые представители этого ряда веществ имеют приятный запах.
Слайд 167
Критерии ароматичности аренов:
Атомы углерода в sp2-гибридизованном состоянии образуют
циклическую систему.
Атомы углерода располагаются в одной плоскости (цикл
имеет плоское строение). Замкнутая система сопряженных связей содержит 4n+2π-электронов (n – целое число)
Слайд 168
Номенклатура аренов
Гомологи бензола – соединения, образованные заменой одного
или нескольких атомов водорода в молекуле бензола на углеводородные
радикалы (R).
Слайд 169
Номенклатура аренов
Широко используются тривиальные названия (толуол, ксилол, кумол
и т.п.).
Систематические названия строят из названия углеводородного радикала
(приставка) и слова бензол (корень):
Слайд 170
Номенклатура аренов
Если радикалов два или более, их положение
указывается номерами атомов углерода в кольце, с которыми они
связаны.Нумерацию кольца проводят так, чтобы номера радикалов были наименьшими. Например:
Слайд 171
Номенклатура аренов
Для дизамещенных бензолов R-C6H4-R используется также и
другой способ построения названий, при котором положение заместителей указывают
перед тривиальным названием соединения приставками: орто- (о-); мета- (м-); пара- (п-)
Слайд 172
Номенклатура аренов
орто- (о-) заместители у соседних атомов углерода
кольца, т.е. 1,2-;
мета- (м-) заместители через один атом углерода
(1,3-);пара- (п-) заместители на противоположных сторонах кольца (1,4-):
Слайд 173
Номенклатура аренов
Ароматические одновалентные радикалы имеют общее название "арил".
Из
них наиболее распространены в номенклатуре органических соединений два:
C6H5-
(фенил) C6H5CH2- (бензил)
Слайд 178
3.Контрольная работа
Какой тип гибридизации характерен для атомов углерода
в молекуле бензола? Ответ 1: sp3 Ответ 2: sp Ответ
3: sp3d Ответ 4: sp2
Слайд 180
Получение аренов
Получение и свойства бензола.
Напишите уравнение реакции:
(видеоролик exp6.exe
в папке лабораторные опыты)
Слайд 181
Кислородсодержащие органические соединения
известно большое число органических соединений, в
состав которых наряду с углеродом и водородом входит кислород.
атом кислорода содержится в различных функциональных группах, определяющих принадлежность соединения к определенному классу.
Слайд 183
Функциональные группы
HO–R–CHO - гидроксиальдегиды
HO–R–CO–R’ - гидроксикетоны
HO–R–COOH - гидроксикислоты
ROR’
- простые эфиры
RCOOR’ - сложные эфиры
RCONH2 - амиды
(RCO)2O -
ангидридыRCOCl - хлорангидриды
Слайд 184
Строение кислорода
Кислород – элемент VI А группы 2-го
периода периодической системы; порядковый номер 8; атомная масса 16;
электроотрицательность 3,5.Электронная конфигурация в основном состоянии 1s22s22p4:
Слайд 186
sp2-состояние
sp2-Гибридизованный атом кислорода присутствует в соединениях с карбонильной
группой С=О
Слайд 187
Гидроксисоединения
вещества, содержащие одну или более гидроксильных групп
–ОН, связанных с углеводородным радикалом:
спирты R–OH
фенолы
Ar–OH R – алкил (алифатический радикал); Ar – арил (ароматический радикал, радикал фенил -C6H5)
Слайд 188
Спирты
Спирты - соединения алифатического ряда, содержащие одну
или несколько гидроксильных групп.
Общая формула спиртов с одной
гидроксигруппой R–OH.
Слайд 189
Классификация спиртов
1.По числу гидроксильных групп спирты подразделяются на
одноатомные (одна группа -ОН),
многоатомные (две и более групп
-ОН).Современное название многоатомных спиртов - полиолы (диолы, триолы и т.д):
двухатомный спирт – этиленгликоль (этандиол)
HO–СH2–CH2–OH
трехатомный спирт – глицерин (пропантриол-1,2,3)
HO–СH2–СН(ОН)–CH2–OH
Слайд 190
Классификация спиртов
2.В зависимости от того, с каким атомом
углерода связана гидроксигруппа, различают спирты
первичные R–CH2–OH,
вторичные R2CH–OH,
третичные R3C–OH.
Слайд 191
Классификация спиртов
3. По строению радикалов, связанных с атомом
кислорода, спирты подразделяются на:
предельные, или алканолы (СH3CH2–OH)
непредельные,
или алкенолы (CH2=CH–CH2–OH) ароматические (C6H5CH2–OH).
Слайд 192
Номенклатура спиртов
Систематические названия даются по названию углеводорода с
добавлением суффикса -ол и цифры, указывающей положение гидроксигруппы (если
это необходимо):
Слайд 194
Номенклатура спиртов
В многоатомных спиртах положение и число ОН-групп
указывают суффиксами диол, триол и цифрами:
Слайд 195
Номенклатура спиртов
Радикально-функциональная номенклатура ИЮПАК, наличие функциональной группы отражают
не суффиксом, а названием соответствующего класса соединений:
C2H5OH -
этиловый спирт;
C2H5Cl - этилхлорид;
CH3–O–C2H5 - метилэтиловый эфир;
CH3–CO–CH=CH2 – метилвинилкетон.
Слайд 196
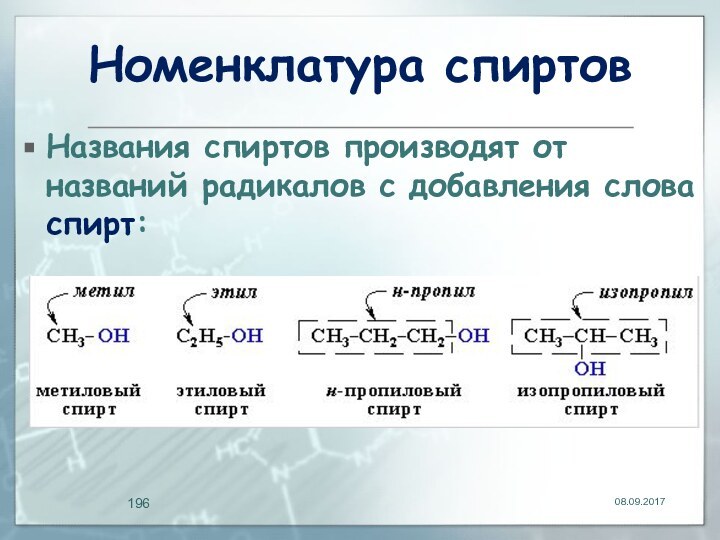
Номенклатура спиртов
Названия спиртов производят от названий радикалов с
добавления слова спирт:
Слайд 197
Назовите следующие спирты:
CH3—OH
CH3—CH2— OH
CH3—CH2—CH2—OH
CH3—CH2—CH2—CH2—OH
CH3—CH2—CH2—CH2—CH2—OH
CH3—CH2—CH2—CH2—CH2—CH2—OH
Слайд 198
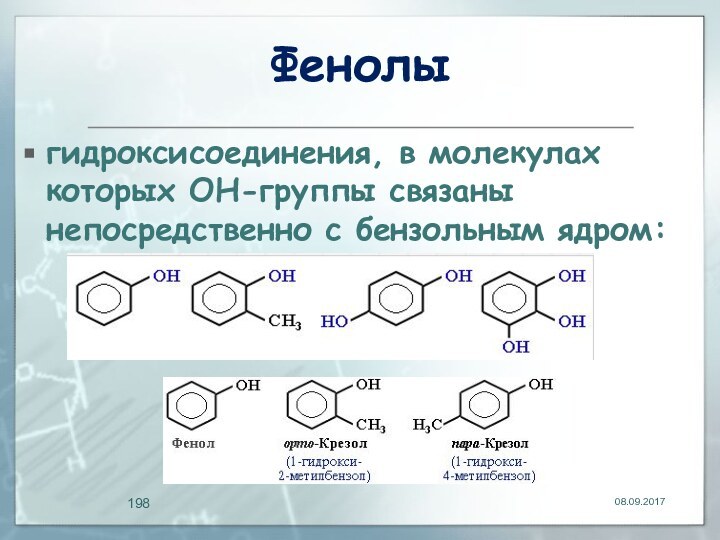
Фенолы
гидроксисоединения, в молекулах которых ОН-группы связаны непосредственно
с бензольным ядром:
Слайд 199
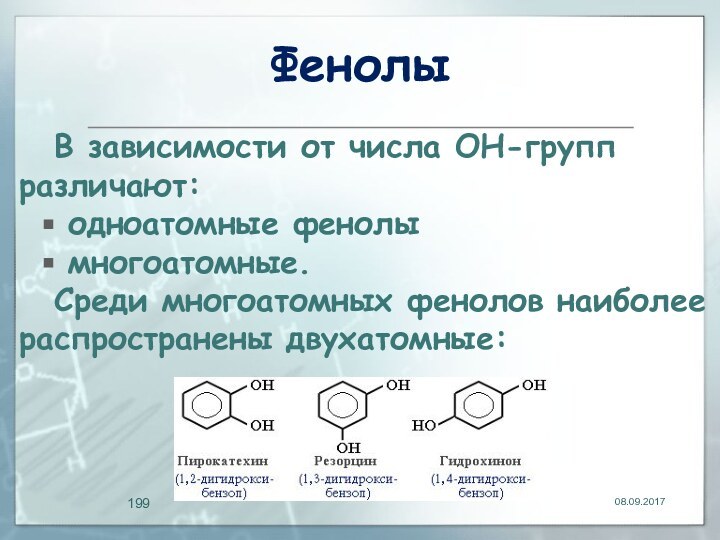
Фенолы
В зависимости от числа ОН-групп различают:
одноатомные
фенолы
многоатомные.
Среди многоатомных фенолов наиболее распространены двухатомные:
Слайд 200
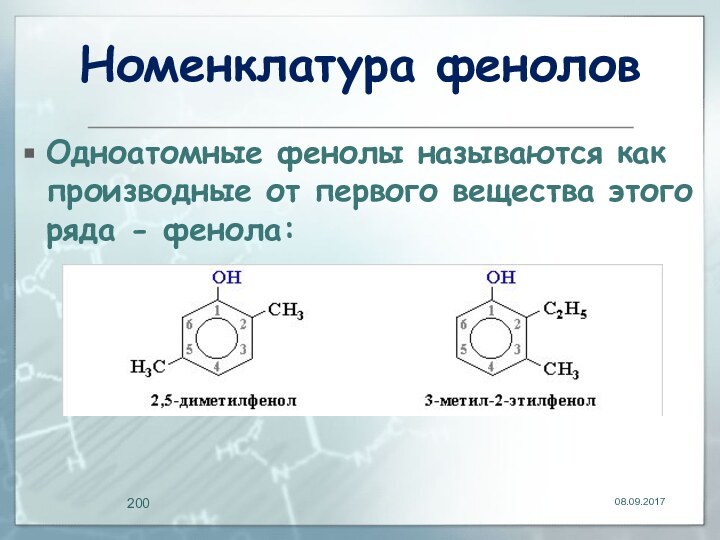
Номенклатура фенолов
Одноатомные фенолы называются как производные от
первого вещества этого ряда - фенола:
Слайд 201
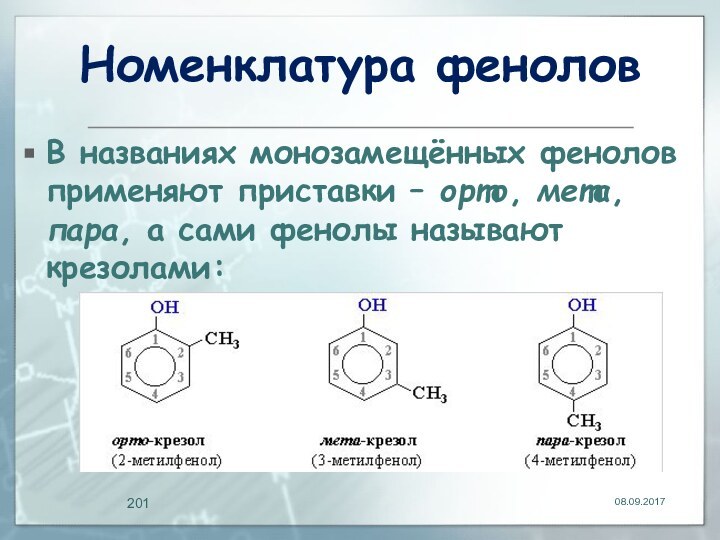
Номенклатура фенолов
В названиях монозамещённых фенолов применяют приставки
– орто, мета, пара, а сами фенолы называют крезолами:
Слайд 202
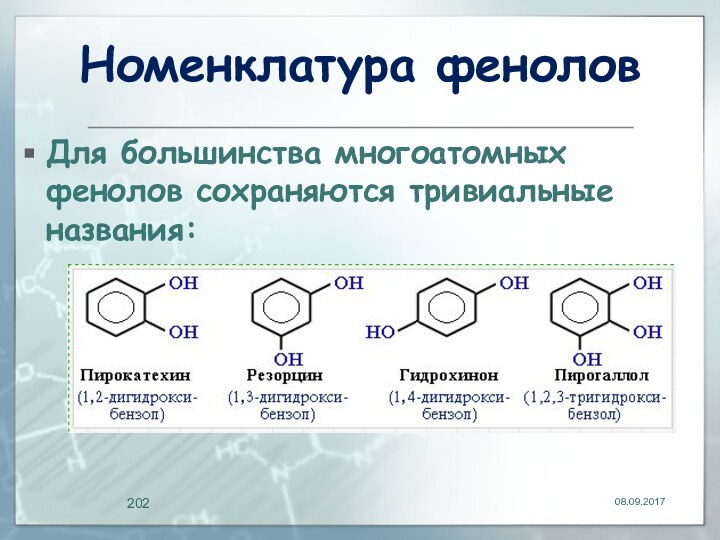
Номенклатура фенолов
Для большинства многоатомных фенолов сохраняются тривиальные
названия:
Слайд 203
Образование сложных эфиров
Спирты вступают в реакции с минеральными
и органическими кислотами, образуя сложные эфиры.
Реакция обратима (обратный
процесс – гидролиз сложных эфиров):
Слайд 204
Образование сложных эфиров
Название сложного эфира образуется от углеводородного
радикала:
Реакционная способность одноатомных спиртов в этих реакциях убывает от
первичных к третичным.
Слайд 205
Простые эфиры
Простыми эфирами называют органические вещества, молекулы
которых состоят из углеводородных радикалов, соединенных атомом кислорода: R'–O–R",
где R' и R" - различные или одинаковые радикалы.
Слайд 206
Простые эфиры
Простые эфиры рассматриваются как производные спиртов.
Названия этих соединений строятся из названий радикалов (в порядке
возрастания молекулярной массы) и слова "эфир": CH3OCH3 - диметиловый эфир;
C2H5OCH3 - метилэтиловый эфир.
Слайд 207
1.Контрольная работа
Соединение CH3–CHOH–CH2–CH3 относится к классу:
Ответ 1
: алканов Ответ 2 : алкенов Ответ 3 :
алканолов Ответ 4 : фенолов Ответ 5 : алкандиолов :
Слайд 208
2. Контрольная работа
Дайте названия следующих спиртов, полученных из
алканов:
- бутан
- гептан
- октан
- пропан
- пентан- гексан
Слайд 209
3. Контрольная работа
Водород выделяется в реакции ...
Ответ 1:
этанол + уксусная кислота Ответ 2: этанол + Na
металлический Ответ 3: этанол + водный раствор NaOH Ответ 4: этанол + уксусный альдегид
Слайд 210
Свойства спиртов
Взаимодействие спирта и натрия
Напищите уравнения реакций.
(видеоролик op3.exe
в папке лабораторные опыты-кислородсодержащие соединения)
Слайд 211
Свойства спиртов
Образование глицерата меди.
Напишите уравнение реакции:
(видеоролик ор2.exe в
папке лабораторные -опыты кислородсодержащие соединения)
Слайд 212
Кислородсодержащие органические соединения
Карбонильными соединениями называют органические вещества, в
молекулах которых имеется группа >С=О (карбонил или оксогруппа).
Общая формула
карбонильных соединений:
Слайд 213
Карбонильные соединения
В зависимости от типа заместителя Х эти
соединения подразделяют на:
альдегиды ( Х = Н );
кетоны ( Х = R, R' );
карбоновые кислоты ( Х = ОН )
производные (Х = ОR, NH2, NHR, Hal и т.д.).
Слайд 214
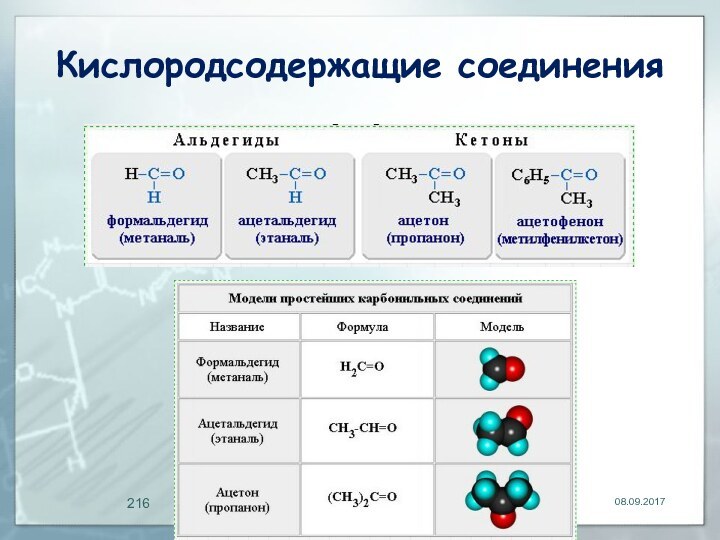
Альдегиды
органические соединения, в молекулах которых атом углерода карбонильной
группы (карбонильный углерод) связан с атомом водорода.
Общая формула: R–CН=O или
Функциональная группа –СН=О называется альдегидной.
Слайд 215
Кетоны
органические вещества, молекулы которых содержат карбонильную группу,
соединенную с двумя углеводородными радикалами.
Общие формулы: R2C=O, R–CO–R' или:
Слайд 217
Номенклатура альдегидов
Систематические названия альдегидов строят по названию соответствующего
углеводорода и добавлением суффикса -аль. Нумерацию цепи начинают с
карбонильного атома углерода:
Слайд 218
Номенклатура альдегидов
Тривиальные названия производят от тривиальных названий тех
кислот, в которые альдегиды превращаются при окислении:
Слайд 219
Номенклатура кетонов
Систематические названия кетонов несложного строения производят от
названий радикалов (в порядке увеличения) с добавлением слова кетон
(ИЮПАК):CH3–CO–CH3 - диметилкетон (ацетон);
CH3CH2CH2–CO–CH3 – метилпропилкетон.
Слайд 220
Номенклатура кетонов
В более общем случае название кетона строится
по названию соответствующего углеводорода и суффикса -он; нумерацию цепи
начинают от конца цепи, ближайшего к карбонильной группе (заместительная номенклатура):CH3–CO–CH3 - пропанон (ацетон);
CH3CH2CH2–CO–CH3 - пентанон-2;
CH2=CH–CH2–CO–CH3 - пентен-4-он-2.
Слайд 221
Назовите следующие соединения:
CH3—СO—С4H9
CH3—CH2— СOH
CH3—CH2—CH2—СOH
CH3—CH2—CH2—CH2—СOH
CH3—CH2—CH2—CH2—CH2—СOH
CH3—CH2—CH2—CH2—CH2—CH2—СOH
CH3—CH2—СO—CH2—CH3
Слайд 222
1.Контрольная работа
Соединение CH3–CO–CH2–CH3 относится к классу:
Ответ 1
: алканов Ответ 2 : алкенов Ответ 3 :
алканолов Ответ 4 : кетонов Ответ 5 : альдегидов
Слайд 223
2. Контрольная работа
Дайте названия следующих альдегидов, полученных из
алканов:
- бутан
- гептан
- октан
- пропан
- пентан- гексан





























